2株枯草芽孢杆菌的分离鉴定及特性研究
巴翠玉, 张林波, 张培军, 赵福广, 李月红
(1吉林农业大学 动物科学技术学院,吉林 长春 130118; 2 吉林农业大学 生命科学学院,吉林 长春 130118;3吉林省卫生监测检验中心,吉林 长春 130000)
2株枯草芽孢杆菌的分离鉴定及特性研究
巴翠玉1,2, 张林波1,2, 张培军3, 赵福广1,2, 李月红1,2
(1吉林农业大学 动物科学技术学院,吉林 长春 130118; 2 吉林农业大学 生命科学学院,吉林 长春 130118;3吉林省卫生监测检验中心,吉林 长春 130000)
【目的】寻求适合制作水产类微生态制剂的益生菌。【方法】 从养鱼塘底泥和健康鲫鱼Carassiusauratus肠道中分离芽孢杆菌,结合细菌形态学、生理生化特征和16S rRNA序列分析对其进行鉴定,对菌株安全性、高温耐受性、酸性耐受性、拮抗性及产酶情况等特性进行研究。【结果】分离到2株芽孢杆菌,分别命名为B1和B2,细菌形态学、生理生化特征和16S rRNA序列分析的结果显示,B1和B2均为枯草芽孢杆菌Bacillussubtilis。特性研究结果证实B1、B2菌株都具有较好的安全性、高温耐受性和酸性耐受性,可对致病性大肠埃希菌Escherichiacoli、金黄色葡萄球菌Staphylococcusaureus、嗜水气单胞菌Aeromonashydrophila以及温和气单胞菌A.sobria有良好的体外抑菌能力,均具有产脂肪酶、淀粉酶、蛋白酶和纤维素酶的能力。【结论】分离到2株性能优良的枯草芽孢杆菌,可将其作为水产微生态制剂的候选菌株。
枯草芽孢杆菌; 分离鉴定; 菌株特性; 鲫鱼; 16S rRNA
枯草芽孢杆菌Bacillussubtilis是一类好氧产芽孢的革兰阳性杆状细菌,大小为(0.7~0.8)μm×(2~3)μm,无荚膜,有鞭毛, 能运动,广泛存在于土壤、湖泊、海洋和动植物的体表,无致病性。菌落粗糙、不透明、扩张、污白色或微带黄色。在营养缺乏的条件下,枯草芽孢杆菌停止生长,同时加快代谢作用,产生多种大分子的水解酶和抗生素,并诱导自身的能动性和趋化性,从而恢复生长。在极端的条件下,还可以诱导产生抗逆性很强的内源孢子[1]。由于枯草芽孢杆菌具有生长速度快、营养简单以及耐热、可产抗逆芽孢等突出特征,而使其不仅有利于在微生态制剂生产、加工等环境中的存活、定殖与繁殖, 并且其成本较低,施用方便,储存期长,因此现已成为一种理想的微生态制剂菌种,可有效减少或替代抗生素在养殖过程中的使用。我国农业部2003年12月9日在第318号公告中公布了15种可以作为微生物饲料添加剂的菌种,其中就包括枯草芽孢杆菌。本试验对从鲫鱼肠道和养殖池底泥中分离到的2株芽孢杆菌进行菌落形态观察、生理生化特征和16S rRNA 序列分析来综合鉴定,并对其安全性、耐受性、拮抗性和产酶情况进行了分析,以期得到高生物活性的益生菌菌株,为进一步研制水产类微生态制剂提供优良的益生菌菌种。
1 材料与方法
1.1 供试菌株及试验材料
指示菌:嗜水气单胞菌Aeromonashydrophila、温和气单胞菌A.sobria、金黄色葡萄球菌Staphylococcusaureus和大肠埃希菌Escherichiacoli均由吉林农业大学水产研究室保存。
试验动物:健康的当年鲫鱼Carassiusauratus200尾,平均体质量(55.42±0.58) g,购自吉林省新立城水库。
主要试剂:产淀粉酶筛选培养基、蛋白酶筛选培养基和纤维素酶筛选培养基按赵东等[2]方法配制,产脂肪酶筛选培养基按李璟等[3]方法配制,革兰染色试剂盒购自上海铭睿生物科技有限公司、细菌基因组DNA提取试剂盒、Taq酶等购自TaKaRa公司。
主要设备: PhoenixTM100 型全自动微生物分析仪(美国BD公司),YXQ-LS-50A立式压力蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂),恒温培养箱(金坛市国旺试验仪器厂 ),SW-CJ-2FD型超净工作台(上海博讯实业有限公司医疗设备厂),TG-16WS台式高速离心机(长沙湘智离心机仪器有限公司),LifePro梯度PCR仪(杭州博日科技有限公司),凝胶成像系统(基因有限公司)。
1.2 菌株的分离
无菌条件下分别取养殖池底泥和鲫鱼肠道,加入无菌的生理盐水制成匀浆,将匀浆稀释至合适稀释度,取其中3个最适稀释度的稀释液200 μL涂布于芽孢杆菌分离培养基上,37 ℃恒温培养箱中培养24 h。挑取形态一致的优势菌群进行纯培养,待菌落形态生长一致时,挑取单菌落,用体积分数为80%的甘油对其进行菌落的保藏,备用。
1.3 菌株的鉴定
1.3.1 形态学及生理生化鉴定 观察菌落形态及革兰染色效果,并用PhoenixTM100 型全自动微生物分析仪,参考说明书方法对菌落进行生理生化鉴定。
1.3.2 16S rRNA序列分析鉴定 16S rRNA序列扩增参考魏亚松等[4]设计的特异性引物:正向引物Primer A 5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物Primer B:5′-AAGGAGGTGATCCAGCCGCA-3′,由上海生工生物工程有限公司合成。用细菌基因组DNA提取试剂盒提取基因组DNA,以此为模板进行PCR扩增。PCR反应体系(50 μL):TaKaRa LA-Taq0.5 μL, DNA模板2 μL,10×PCR Buffer 5 μL,dNTP Mixture 8 μL,上、下游引物各2 μL,双蒸水30.5 μL。PCR程序:94 ℃预变性5 min,94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸7 min。PCR产物纯化后交由上海生工生物工程有限公司进行测序。测序结果通过NCBI数据库进行Blast比对分析,通过MEGA5.0构建系统发育树。
1.4 安全性试验
试验鲫鱼经1周驯化后,选择适应环境、体格健壮的鲫鱼200尾,随机分4组,1组为对照组,其余3组为试验组(试验I、II和III组),每组50尾鱼,采用腹腔注射方法,对照组每尾鱼注射0.1 mL无菌液体LB,3个试验组分别注射0.1 mL含有芽孢杆菌菌悬液1×109、1×108和1×107cfu·mL-1的液体LB。23 ℃ 水温条件下饲养 7 d,观察并记录死亡情况,最后剖检,观察有无病变。
1.5 高温耐受性试验
参照文献[5]的方法,将菌株用液体LB培养基培养 48 h后, 3 500 r· min-1离心 30 min,取上清液,无菌操作将其稀释至一定的倍数,将最后2个梯度各分成3组,分别置于 80、90和100 ℃水浴锅中30 min,流水冷却,以室温下未经水浴的菌株培养作为对照,采用平板计数法计算水浴后的存活率,据此判断其对温度的耐受性,每个试验重复3次。
1.6 酸性耐受性试验
参照文献[6],将芽孢杆菌菌悬液分别接种到pH为3.0、4.0、5.0的液体LB培养基中,使芽孢杆菌初始浓度约为1×106cfu·mL-1,37 ℃条件下 120 r· min-1摇床中培养,1 h后取200 μL涂布于固体培养基上,进行平板计数,计算存活率,每个试验重复3次。
1.7 体外抑菌试验
采用牛津杯法测定各个菌株的抑菌活性[7]。活化指示菌和芽孢杆菌,调整菌浓度为106cfu·mL-1,取指示菌200 μL用涂布棒均匀涂布于固体LB平板,取无菌牛津杯置于其上,使其紧贴于培养基上,每个牛津杯加入0.2 mL 芽孢杆菌菌液。将平板置于30 ℃恒温箱培养24 h后测抑菌圈直径,计算抑菌圈与菌圈直径的比值。试验重复3次。
1.8 产酶试验
1.8.1 平板法胞外酶活性初筛 挑选单菌落点种于纤维素酶筛选培养基、淀粉酶筛选培养基、蛋白酶筛选培养基和脂肪酶筛选培养基,37 ℃条件下培养48 h后观察,如有透明圈则表示细菌产酶。观察淀粉酶筛选培养基时需滴加鲁哥氏碘液。计算水解圈与菌落直径的比值,其大小表示初筛酶活性。
1.8.2 发酵液法胞外酶活性测定 选取胞外酶活性初筛结果中4种胞外酶均有活性的菌株进行胞外酶活性测定。淀粉酶活性采用碘-淀粉比色法[8]测定,纤维素酶活性采用羧甲基纤维素钠盐( CMC-Na) 酶活性测定方法[9]测定,蛋白酶活性采用福林酚法[10]测定。脂肪酶活性采用橄榄油乳化液法[11]测定。
1.9 数据处理
用Excel统计分析数据,试验结果用平均数±标准差表示。
2 结果与分析
2.1 形态学及生理生化鉴定结果
从养殖池底泥和鲫鱼肠道中各分离出1株芽孢杆菌,分别命名为B1和B2。2株菌的菌落形态都呈白色近似圆形,不透明,表面干燥没有光泽,中间褶皱边缘不整齐;革兰染色结果为阳性,在显微镜下观察菌体呈杆状,两端钝圆,孢囊无明显膨胀,无伴孢晶体。用PhoenixTM100 型全自动微生物分析仪对菌株B1和B2 进行鉴定,结果见表1,参照《伯杰细菌鉴定手册》及仪器分析结果,初步鉴定这2株菌均为枯草芽孢杆菌。
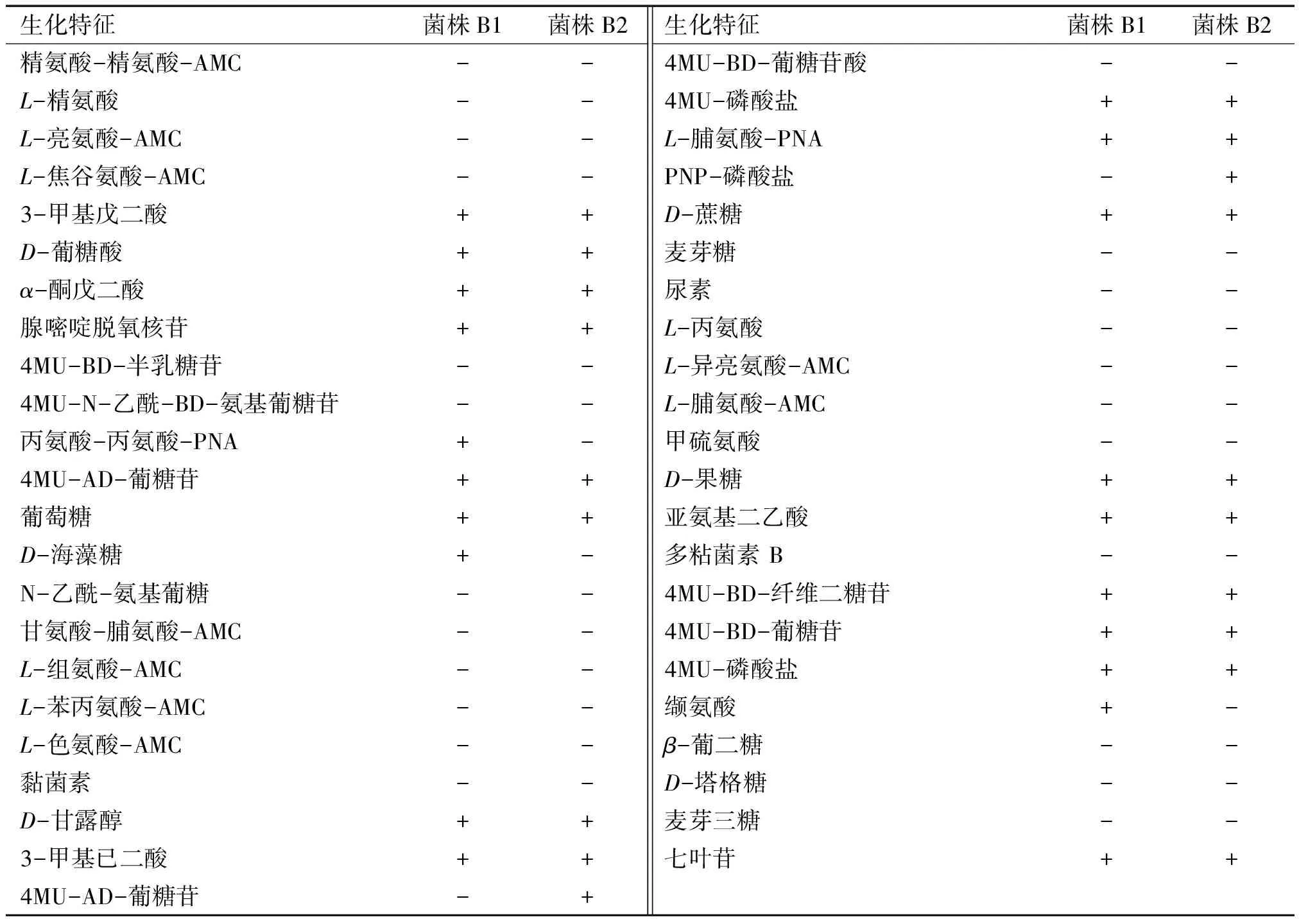
表1 菌株生化鉴定结果1)
1)“+ ”表示生化反应阳性; “- ”表示生化反应阴性。
2.2 分子生物学鉴定结果
以菌株B1和B2的基因组DNA为模板进行PCR扩增,结果扩增到特异性的16S rRNA片段大小为1 500 bp(图1)。将2株菌的测序结果在NCBI中进行Blast比对,结果表明:菌株B1与菌株BacillussubtilisBS3902(登录号:EU047884.1)的序列相似性为99%;菌株B2与B.subtilisAER314-2(登录号:KR967391.1)的序列相似性为99%。通过MEGA5.0软件构建系统进化树,结果显示菌株B1和B2都与枯草芽孢杆菌亲缘关系最近,聚类为一支(图2)。

M:250 bp DNA marker DL4500;1:菌株B1;2:菌株B2 。
图1 菌株 16S rRNA PCR扩增结果
Fig.1 PCR amplification of 16S rRNA gene in two strains

图2 菌株16S rRNA系统发育分析
2.3 安全性试验结果
注射0.1 mL浓度分别为1×109、1×108和1×107cfu·mL-1的枯草芽孢杆菌菌悬液后,与对照组相比,鲫鱼未出现死亡,解剖发现对照组和试验组内脏菌正常无变异。说明2株枯草芽孢杆菌都有很好的安全性。
2.4 高温耐受性试验结果
高温耐受性试验结果见表2。由表2可知,2株枯草芽孢杆菌对不同温度的耐受性不同,在相同时间(30 min)内,菌株在80 ℃条件下的存活率明显高于100 ℃条件下的存活率,并随着温度的上升存活率不断下降。表2数据显示,菌株B2对高温的耐受能力略强于B1。
表2 不同水浴温度下枯草芽孢杆菌的存活率
Tab.2 The livability ofBacillussubtilisstrain under different temperatures%

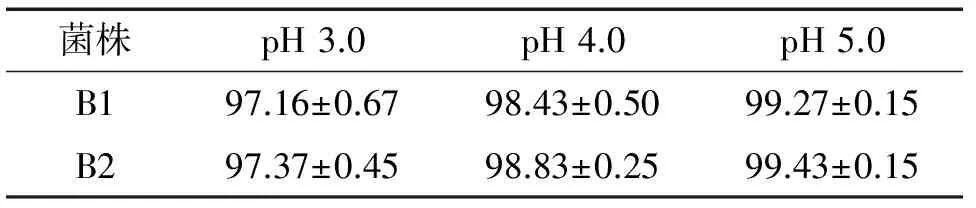
2.5 酸性耐受性试验结果
由表3可知,2株芽孢杆菌分别在pH 3.0、4.0、5.0条件下处理1 h后的存活率都在97%以上,说明2个菌株都有较好的酸性耐受能力。在pH3.0、4.0和5.0条件下,菌株B1的存活率分别为97.16%、98.43%和99.27%,菌株B2的存活率分别为97.37%、98.83%和99.43%。
表3 不同pH环境下枯草芽孢杆菌的存活率
Tab.3 The livability ofBacillussubtilisstrain under different pH%
2.6 体外抑菌试验结果
以大肠埃希菌、金黄色葡萄球菌、嗜水气单胞菌和温和气单胞菌为指示菌,进行抑菌性分析,抑菌圈直径大小可反映这2株枯草芽孢杆菌对致病菌体外抑制能力的强弱,结果见表4,菌株B2的抑菌圈/菌圈直径比数值上均大于菌株B1,说明菌株B2比B1对这4种指示菌可能有较强的抑制作用。
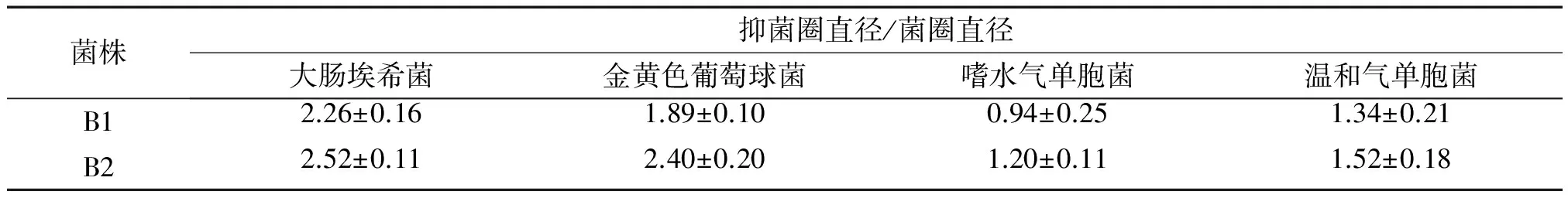
表4 枯草芽孢杆菌对指示菌的拮抗作用
2.7 产酶试验结果
2.7.1 平板法胞外酶活性初筛结果 由表5可以看出,菌株B1和B2都可产淀粉酶、脂肪酶、蛋白酶和纤维素酶,不同菌株产酶种类和能力不同。对于2株枯草芽孢杆菌,反映其产淀粉酶能力的染色圈直径/菌落直径(H/C)及产蛋白酶能力的H/C数值上均为B2>B1;反映其产纤维素酶能力的H/C及产脂肪酶能力的H/C数值上均为B1>B2;说明菌株B2较B1产淀粉酶和蛋白酶能力水平可能较高,产纤维素酶和脂肪酶能力可能稍弱。

表5 不同菌株胞外酶活性初筛结果
2.7.2 发酵液法胞外酶活性测定结果 因发现平板法H/C不能完全代表菌株产酶能力,所以对产酶菌株进行发酵液法胞外酶产酶活性测定是非常必要的。由表6可以看出,产蛋白酶、纤维素酶和脂肪酶活力较高的菌株为B2,产淀粉酶活力较高的菌株为B1,与初筛结果有所不同。

表6 不同菌株发酵液的胞外酶活性
3 讨论与结论
近年来,芽孢杆菌类微生态制剂被广泛应用于水产养殖以替代或减少抗生素的使用,降低其带来的危害,使用的芽孢杆菌类型也是多种多样。枯草芽孢杆菌因在缺乏营养或不良环境时,可以通过生成内生孢子来增强其抗逆性,并且其耐加工、耐储藏、耐胃酸,稳定性较好,也可以通过孢子形式进入到消化道,并且可与肠道上的特异性结合位点结合,形成优势菌群,进行生物夺氧,也可以产生多种代谢物质,抑制病原菌的生长,是较好的微生态制剂菌种,具有开发为微生态制剂的潜在优势。胡凡光等[12]选用从健康大菱鲆鱼Psettamaxima体肠道分离培养的同源枯草芽孢杆菌制成的饲料添加剂对大菱鲆进行促生长影响的研究。结果表明:与对照组相比试验组降低了饲料系数,提高了蛋白质效率和增重率。李卫芬等[13]将草鱼Ctenopharyngodonidellus试验组饲喂含枯草芽孢杆菌( 108cfu·kg-1) 的基础日粮,结果发现:试验组肠道内容物中胰蛋白酶、脂肪酶和淀粉酶活性比对照组显著提高;肝胰脏中脂肪酶和胰蛋白酶活性也比对照组显著提高。肠道菌群数量分析显示,与对照组相比,试验组肠道芽孢杆菌和假单胞菌数量极显著提高,而致病性弧菌和大肠埃希菌数量却极显著降低。丁祥力等[14]从淡水养殖污水和底泥中分离出1株枯草芽孢杆菌WH-5,试验证明其具有改善淡水养殖水体水质的有效作用。
微生态制剂在生产过程中一般把筛选益生菌作为关键的一步,因为种属特异性是筛选合适益生菌的一个先决条件,不同来源的芽孢杆菌在不同动物胃肠道内的黏附繁殖能力及相关生理功能有所不同,故一般认为从相应的水产养殖环境分离菌株用于筛选水产微生态制剂更具合理性,所以本试验从养殖池底泥和鲫鱼肠道中进行芽孢杆菌的分离,分离得到2株芽孢杆菌,分别命名为B1和B2。运用传统的细菌形态学观察、生理生化试验及16S rRNA序列对分离出的2株芽孢杆菌进行分析鉴定,结果B1和B2均为枯草芽孢杆菌。优良的水产微生态制剂应具备安全、耐高温、抗酸腐蚀、抑菌能力强、可产酶等特点[15],故本试验从这几方面对B1和B2这2株枯草芽孢杆菌的益生特性进行了探究。菌株安全性试验结果表明,这2株枯草芽孢杆菌均具有安全性,无致病能力。高温耐受性和pH耐受性试验发现,这2株枯草芽孢杆菌均具有良好的耐高温和耐酸能力,且B2菌株的效果数值上好于B1菌株。体外抑菌试验的抑菌能力:B2>B1,两者均对大肠埃希菌、金黄色葡萄球菌、嗜水气单胞菌和温和气单胞菌有抑制效果,对大肠埃希菌的抑制效果最好。产酶试验结果表明:B1和B2菌株都能够分泌淀粉酶、蛋白酶、纤维素酶和脂肪酶,有望用于鱼虾等的饲料添加剂,促进鱼虾生长及提高饲料利用率;同时,可利用枯草芽孢杆菌分解养殖水体中过剩饵料中的有机物,净化水体及脱氮[16]。因此,枯草芽孢杆菌B1和B2适合用于研发水产类微生态制剂,并需进一步研究其功能和机理。本研究为进一步研制水产类微生态制剂提供了优良的益生菌菌种参考。
[1] 沈卫锋, 牛宝龙, 翁宏飚, 等. 枯草芽孢杆菌作为外源基因表达系统的研究进展[J]. 浙江农业学报, 2005, 17(4): 234-238.
[2] 赵东, 牛广杰, 彭志云, 等. 包包曲中5株枯草芽孢杆菌的分离与初步鉴定[J]. 中国酿造, 2010(8): 65-68.
[3] 李璟, 兰贵红, 张飞伟, 等. 产脂肪酶微生物的筛选鉴定及脂肪酶lipA基因克隆[J]. 广东农业科学, 2012, 39(17): 138-142.
[4] 魏亚松, 邹玲, 温建新, 等. 水貂肠道枯草芽孢杆菌的分离及16S rRNA鉴定[J]. 中国动物检疫, 2013, 30(6): 36-39.
[5] 陈海华. 一株益生芽孢杆菌的筛选及其肠道菌群调节作用研究[D]. 重庆:第三军医大学, 2005.
[6] 周金敏, 吴志新, 曾令兵, 等. 黄颡鱼肠道病原拮抗性芽孢杆菌的筛选与特性研究[J]. 水生生物学报, 2012, 36(1): 78-84.
[7] 刘冬梅, 李理, 杨晓泉, 等. 用牛津杯法测定益生菌的抑菌活力[J]. 食品研究与开发, 2006, 27(3): 110-111.
[8] 白燕, 王维新. 刺参肠道蛋白酶、淀粉酶、脂肪酶与纤维素酶活性的测定方法[J]. 饲料工业, 2012, 33(20): 28-32.
[9] 赵玉萍, 杨娟. 四种纤维素酶酶活测定方法的比较[J]. 食品研究与开发, 2006, 27(3): 116-118.
[10]中华人民共和国专业标准. 蛋白酶活力测定方法: SB/T10317-1999[S]. 北京: 中国标准出版社, 1999.
[11]郭晓军, 郭威, 袁洪水, 等. 一株饲用产脂肪酶芽孢杆菌的筛选及其紫外诱变育种[J]. 中国饲料, 2015,15(12): 27-29.
[12]胡凡光, 郭萍萍, 麻丹萍. 饲料中添加枯草芽孢杆菌对促进大菱鲆生长及养殖水环境的影响[J]. 渔业现代化, 2014, 41(2): 7-11.
[13]李卫芬, 沈涛, 陈南南, 等. 饲料中添加枯草芽孢杆菌对草鱼消化酶活性和肠道菌群的影响[J]. 大连海洋大学学报, 2012, 27(3): 221-225.
[14]丁祥力, 王震, 陈薇, 等. 枯草芽孢杆菌WH-5的分离鉴定及净水研究[J]. 湖南农业科学, 2012(1): 15-19.
[15]邵建军, 朱瑞良. 微生态制剂的作用及应用中应注意的问题[J]. 四川畜牧兽医, 2003, 30(9): 45-46.
[16]JOONG K K, KYOUNG J P, KYOUNG S C, et al. Aerobic nitrification-denitrification by heterotrophicBacillusstrains[ J] . Bioresour Technol, 2005, 96(17):1897-1906.
【责任编辑 李晓卉】
Isolation, identification and characterization oftwo strains ofBacillussubtilis
BA Cuiyu1,2, ZHANG Linbo1,2, ZHANG Peijun3, ZHAO Fuguang1,2, LI Yuehong1,2
(1 Animal Science and Technology College,Jilin Agricultural University,Changchun 130118,China;2 College of Life Sciences,Jilin Agricultural University,Changchun 130118,China;3 Jilin Province Health Surveillance Inspection Center,Changchun 130000,China)
【Objective】 To explore potential probiotics in order to develop microecological agents for aquiculture.【Method】Bacillusstains were isolated from the pond sediment and healthy carp (Carassiusauratus) intestine. The strains were identified by the morphological, physiological and biochemical characteristics and 16S rRNA sequence analysis. The safety, high temperature tolerance, pH tolerance, antagonistic effects and enzyme production of the strains were studied.【Result】 TwoBacillusstrains were isolated and named B1 and B2. They were identified asB.subtilisby morphology, physiological and biochemical characteristics and 16S rRNA sequence analysis. The B1 and B2 strains had good safety, high temperature tolerance and strong tolerance of acid. They had good antibacterial activity against pathogenicEscherichiacoli,Staphylococcusaureus,AeromonashydrophilaandA.sobriainvitro, and had the ability to produce lipase, amylase, protease and cellulase. 【Conclusion】TwoB.subtilisstrains were isolated, and both can be used as candidates for developing microecological agents for aquiculture.
Bacillussubtilis; isolation and identification; strain characteristic;Carassiusauratus;16S rRNA
2016- 06- 22 优先出版时间:2017-04-12
巴翠玉(1992—),女,硕士研究生,E-mail:bacuiyu@163.com; 通信作者:李月红(1968—),女,教授,博士,E-mail:liyhong@sina.com
国家自然科学基金(30972191);吉林省现代农业产业技术体系(201506),吉林省留学人员创新创业项目(201523)
S917.1
A
1001- 411X(2017)03- 0046- 06
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.s.20170412.1427.018.html
巴翠玉, 张林波, 张培军, 等.2株枯草芽孢杆菌的分离鉴定及特性研究[J].华南农业大学学报,2017,38(3):46- 51.

