2株番木瓜根际促生菌的解磷解钾作用
叶维雁++吴海波++刘惠民++熊智++王樱潼
摘要:用平板涂布、划线与固体平板-透明圈法从番木瓜根际土壤中筛选出2株解磷解钾细菌(PK-1、PK-2)。通过摇瓶培养,测定PK-1、PK-2发酵液中水溶性磷、水溶性钾含量和磷、钾总量;分析PK-1、PK-2解磷解钾能力;对PK-1、PK-2进行分子鉴定。结果表明,PK-1溶解无机磷能力的溶量为1.63 μg/mL,PK-2溶量为 17.26 μg/mL,溶解无机磷能力表现为PK-1﹤PK-2,即PK-2具有更强的解无机磷能力;PK-1溶解有机磷能力的溶量为 8.49 μg/mL,PK-2溶量为2.38 μg/mL,溶解有机磷能力表现为PK-1>PK-2,即PK-1的解有机磷能力更好;PK-1溶解钾能力的溶量为8.15 μg/mL,PK-2溶量为8.49 μg/mL,溶解钾能力表现为PK-1﹤PK-2,PK-1 和PK-2的解钾能力接近。经16S rDNA序列分析,初步鉴定PK-1为肠杆菌属(Enterobacter),PK-2為芽孢杆菌属(Bacillus)。供试菌株PK-1和PK-2具有良好的解磷解钾功能,可为进一步研制专用的番木瓜微生物肥料提供菌种资源和依据。
关键词:番木瓜;根际促生菌;解磷;解钾;鉴定;肠杆菌层;芽孢杆菌属
中图分类号: S182文献标志码: A文章编号:1002-1302(2017)06-0247-04
植物根际促生菌(plant growth promoting rhizobacteria,简称PGPR)指生存于植物根际系统,并能促进或调节植物生长的一类微生物,通常具有固氮、溶磷、解钾、产生植物激素、分泌抗生素等生理活性[1-4]。目前,研究比较多的是PGPR的解磷、解钾、固氮功能。磷和钾是植物生长必需的大量营养元素,而我国土壤中可供植物直接吸收利用的磷、钾资源有限,在生产实践中,为了提高作物产量,每年都要向土壤中施入大量的可溶性磷肥和钾肥,造成土壤板结、地力下降、环境污染、农产品品质下降等问题[5]。PGPR在其生命活动过程中通常能将土壤矿物质中难以被植物吸收的磷、钾释放出来,转化成易溶性的养分,提升有效磷、有效钾的供应水平,促进植物生长。随着人们环保意识的日益提高,应用PGPR的解磷解钾能力促进植物生长及提高其产量越来越受到关注,PGPR作为一种宝贵的资源逐渐成为研究热点[6]。番木瓜(Carica papaya L.)是热带、亚热带地区广泛栽培的多年生常绿大型草本植物,别称万寿果、木瓜,果实含有丰富的糖类、胡萝卜素、木瓜酶,富含钙、磷、钾等矿物质,还具有清除自由基、增强人体免疫力、抗病原体等保健作用[7-8]。目前,PGPR解磷解钾作用在许多作物上的应用已得到诸多报道,但在番木瓜上的应用却鲜有报道。因此,开展番木瓜PGPR菌株解磷解钾能力的研究,对研制新型微生物肥料以提高番木瓜的产量和质量具有重要的现实意义。
本研究从番木瓜根际土壤中筛选出2株PGPR,并对其解磷解钾作用进行分析,旨在为进一步研究番木瓜PGPR的生态适应性,研制番木瓜的微生物肥料提供理论依据。
1材料与方法
1.1仪器与试剂
所用仪器主要有超净工作台、电热恒温鼓风干燥箱、立式压力蒸汽灭菌器、恒温培养振荡器、原子吸收分光光度计、紫外-可见分光光度计、高速冷冻离心机、电子分析天平、纯水机、恒温水浴锅、多功能梯度PCR仪、电泳仪、凝胶成像仪、微波炉、乙醇灯、1 L移液器;所用试剂主要有琼脂、琼脂糖、蛋白胨、酵母浸出汁、牛肉膏、氯化钠、葡萄糖、2×Taq PCR MasterMix。
1.2土样
采自云南省西双版纳州普文镇的番木瓜地,土壤系番木瓜的根际土壤。
1.3培养基
1.3.1菌株分离纯化培养基菌株的分离纯化采用牛肉膏蛋白胨培养基(NA)。
1.3.2解无机磷培养基(1)解无机磷固体培养基:葡萄糖1000 g,Ca3(PO4)2 5.00 g,MgCl2 5.00 g,MgSO4·7H2O 0.25 g,KCl 0.20 g,(NH4)2SO4 0.10 g,琼脂15.00 g,溶于去离子水中,加热溶化,混匀,加去离子水定容至1 L,调pH值为7.4,分装于250 mL锥形瓶中,121 ℃灭菌20 min,分装。(2)解无机磷液体培养基:除缺少琼脂外,其他物质含量与解无机磷固体培养基相同。
1.3.3解有机磷培养基解有机磷固体培养基:
(1)蒙金娜基础培养基。葡萄糖10.00 g、(NH4)2SO4 050 g、MgSO4·7H2O 0.30 g、NaCl 0.30 g、KCl 0.30 g、FeSO4·7H2O 0.36 g、MnSO4·H2O 0.03 g、CaCO3 500 g、琼脂15.00 g,溶于去离子水中,加热溶化,混匀,加去离子水定容至1.00 L,调pH值至7.4,分装于250 mL锥形瓶中,121 ℃ 灭菌20 min,分装。
(2)卵黄稀释液。用乙醇擦净鸡蛋外壳,用解剖刀切破鸡蛋两端,流去蛋清后将蛋黄流入已灭菌的锥形瓶中,约加入等量的无菌水,摇匀。
(3)将蒙金娜基础培养基熔化,冷却至50 ℃后,立即加入卵黄液,每100 mL基础培养基加卵黄稀释液3~4 mL作为有机磷源,混匀后分装于培养皿内凝成平板。
解有机磷液体培养基:除缺少琼脂外,其他物质含量与解有机磷固体培养基相同。
1.3.4解钾培养基(1)解钾固体培养基:蔗糖10.0 g,酵母膏0.5 g,(NH4)2SO4 1.0 g,Na2HPO4 2.0 g,MgSO4·7H2O 0.5 g,CaCO3 1.0 g,钾长石粉10.0 g,琼脂15.0 g,溶于去离子水中,加热溶化,混匀,加去离子水定容至1.0 L,调pH值至7.4,分装于250 mL锥形瓶中,121 ℃灭菌20 min,分装。(2)解钾液体培养基:除缺少琼脂外,其他物质含量与解钾固体培养基相同。
1.4分离及纯化菌株
取番木瓜根,用无菌去离子水轻柔冲洗,以去除外围土壤,用刷子刷取番木瓜根际土1 g,加入装有100 mL无菌去离子水和若干玻璃珠的锥形瓶中,150 r/min混合30 min,使根际土壤中的微生物细胞充分分散,制作根际土混合液。将根际土混合液梯度稀释后,分别从10-2、10-3、10-4、10-5、10-6稀释度中吸取100 μL稀释液涂布于NA固体培养基上,设3个重复。于37 ℃恒温培养箱内培养,根据菌落颜色、形状、大小等特征,观察并挑取不同的单菌落在NA培养基上划线纯化,连续3~5次划线,获取纯化的菌株,4 ℃斜面保存,备用。
1.5解磷能力的测定
1.5.1解磷能力的平板测定(1)解无机磷:将活化好的菌株点接于解无机磷固体培养基平板上,于37 ℃恒温培养箱中培养7 d,观察透明圈的产生情况,并测量透明圈直径(D)和菌落直径(d),根据D/d值大小確定解无机磷能力的大小[9]。 (2)解有机磷:与解无机磷能力平板测定方法相同。
1.5.2解磷能力的摇瓶测定解无机磷:(1)种子液制备。菌株经平板划线活化后,挑取1环接入40 mL NA液体培养基中,以不接菌的NA培养基为对照,37 ℃、150 r/min恒温摇床培养2~4 d,制备菌液。用分光光度计测定各菌液的吸光度(600 nm),最后用无菌去离子水将各菌液稀释成相同吸光度作为种子液。(2)发酵液制备。按40 mL解无机磷液体培养基接入1 mL种子液接入菌种,同时接入(1)中的NA培养基 1 mL 作为对照,发酵液及对照在37 ℃、150 r/min条件下培养7 d。(3)发酵液处理。发酵液在冷冻离心机下以 8 000 r/min 的转速离心15 min后取上清液2 mL移至50 mL容量瓶中,用钼锑抗比色法[10]测定发酵液中可溶性磷含量。细菌溶解无机磷的量=发酵液可溶性磷含量-对照培养液可溶性磷含量。
发酵液静置30 min,磷酸钙沉底后,移取2 mL上清液至50 mL锥形瓶中,加H2O2溶液0.5 mL,微波炉加热消解,沸腾后改用小火维持,浓缩至1~2 mL后关闭微波炉用余热将溶液蒸干,以除掉过量的H2O2溶液,冷却,用5 mL去离子水冲洗锥形瓶内壁,加浓硫酸2滴(约0.1 mL),摇匀后小心转动锥形瓶,使酸液同内壁接触,然后加热1~2 min,使残渣溶解,溶液剩3~4 mL并冷却后,转入50 mL容量瓶中,用去离子水定容至50 mL作为待测液。按上述步骤处理对照。待测液8 000 r/min离心15 min,取上清液,用钼锑抗比色法测定发酵液中全磷含量。
解有机磷:与解无机磷能力的摇瓶测定方法相同。
细菌溶解有机磷的量=发酵液可溶性磷含量-对照培养液可溶性磷含量。
1.6解钾能力的测定
1.6.1解钾能力的平板测定将活化好的菌株点接于解钾固体培养基平板上,于37 ℃恒温培养箱中培养7 d,观察透明圈的产生情况,并测量透明圈直径(D)和菌落直径(d),根据D/d值大小确定菌株的解钾能力。
1.6.2解钾能力的摇瓶测定(1)种子液制备。菌种经平板划线活化后,挑取1环接入40 mL NA培养基中,以不接菌的NA培养基为对照,37 ℃、150 r/min恒温摇床培养2~4 d,制备菌液。用分光光度计测定各菌液的吸光度(600 nm),最后用无菌去离子水将各菌液稀释成相同吸光度为种子液。(2)发酵液制备。按35 mL解钾液体培养基接入1 mL种子液接入菌种,同时接入(1)中的NA培养基1 mL作为对照,发酵液及对照在37 ℃、150 r/min条件下培养7 d。(3)发酵液处理。发酵液在冷冻离心机下以8 000 r/min的转速离心 8 min,取上清液5 mL用去离子水稀释8倍,使用原子吸收分光光度计测定有效钾浓度。
细菌溶解钾的量=发酵液可溶性钾含量-对照培养液可溶性钾含量。
发酵液静置30 min,钾长石粉沉底后,移取5 mL上清液至50 mL锥形瓶中,加H2O2 溶液1.5 mL,微波炉加热消解,沸腾后改用小火维持,浓缩至3 mL后关闭微波炉用余热将溶液蒸干,以除掉过量的H2O2溶液,冷却,用15 mL去离子水冲洗锥形瓶内壁,加浓硫酸5滴(约0.25 mL),摇匀后小心转动锥形瓶,使酸液同内壁接触,然后加热1~2 min,使残渣溶解,溶液剩6~8 mL并冷却后,转入50 mL容量瓶中,用去离子水定容至50 mL作为待测液。按上述步骤处理对照。待测液8 000 r/min离心8 min后,取上清液,用原子吸收分光光度计测定发酵液中全钾含量。
1.716S rDNA基因序列分析
斜面保存的菌株经NA液体培养基摇菌活化后使用离心柱型细菌基因组DNA提取试剂盒(北京百泰克生物技术有限公司)提取细菌基因组DNA,保存于-20 ℃冰箱内。以总DNA为模板,采用细菌16S rDNA通用引物[11]进行PCR,扩增16S rDNA近乎全长片段。引物由生工生物工程(上海)股份有限公司合成,其序列为27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1 492R:5′-GGTTACCTTGTTACGACTT-3′。
PCR采用50 μL反应体系:2×Taq PCR MasterMix 25.0 μL,10 μmol/L引物各2.5 μL,DNA模板1.0 μL(20 ng左右),灭菌去离子水补足至50.0 μL。
PCR扩增程序:94 ℃预变性5 min;94 ℃变性1 min,58 ℃复性1 min,72 ℃延伸3 min,30个循环;72 ℃延伸 5 min。PCR产物经1.0%琼脂糖凝胶电泳检测后送生工生物工程(上海)股份有限公司测序。根据测序所得16S rDNA序列在GenBank中Blast搜索同源序列。通过MEGA 6软件,以邻接法(Neighbour-Joining)构建系统发育进化树,Bootstrap 值为1 000[12]。
2结果与分析
2.1解磷解钾的平板测定
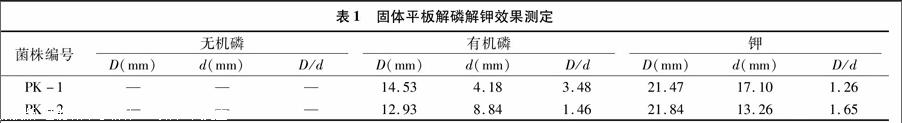
从云南省西双版纳州普文镇的番木瓜根际土壤里筛选得到2株解磷解钾细菌,编号为PK-1和PK-2。通过固体平板法,根据透明圈直径D与菌落直径d的比值,即D/d值的大小初步测定菌株PK-1和PK-2的解磷解钾能力。由表1可知,菌株PK-1和PK-2在解有机磷与解钾能力方面都存在一定的差异。解有机磷方面,PK-1和PK-2的透明圈直径都超过了12.00 mm,PK-1的D/d值达到3.48,大于 PK-2 的1.46,说明PK-1的解有机磷能力较强;解钾方面,PK-1与PK-2的透明圈直径都超过了21.00 mm,PK-2的D/d值达到1.65,大于PK-1的1.26,说明PK-2的解钾能力强于PK-1;解无机磷方面,PK-1和PK-2均未出现透明圈。
2.2解磷解钾的摇瓶测定
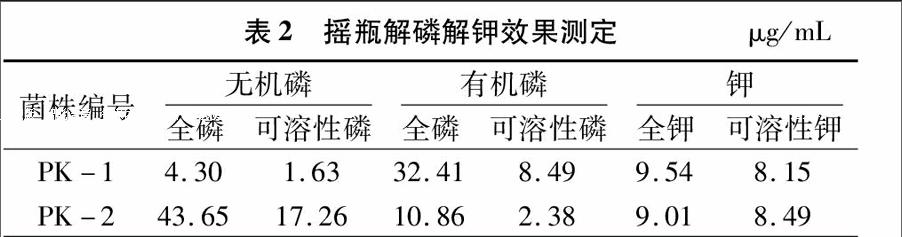
对菌株PK-1和PK-2进行7 d的解磷解钾摇瓶培养后测得发酵液中无机磷全磷与可溶性磷含量、有机磷全磷与可溶性磷含量及全钾与可溶性钾含量(表2)。由表2可知,菌株PK-1和PK-2对无机磷、有机磷和钾都表现出不同的降解作用。解无机磷(磷酸钙)方面,PK-1和PK-2发酵液中全磷的质量浓度分别为4.30、43.65 μg/mL,同时PK-1和PK-2的解磷量分别为1.63、17.26 μg/mL,说明PK-2解无机磷的能力明显强于PK-1;在解有机磷(卵磷脂)方面,PK-1 和PK-2发酵液中全磷的质量浓度分别为32.41、10.86 μg/mL,同时PK-1和PK-2的解磷量分别为8.49、2.38 μg/mL,说明PK-1对有机磷的溶解能力明显强于 PK-2,与固体平板法测定的解有机磷能力的结果一致;解钾方面,PK-1和PK-2发酵液中全钾的质量浓度分别为954、9.01 μg/mL,同时PK-1和PK-2的解钾量分别为815、849 μg/mL,说明PK-2的解钾能力略强于PK-1,与固体平板法测定的解钾能力的结果一致。
2.316S rDNA基因序列测定及分析
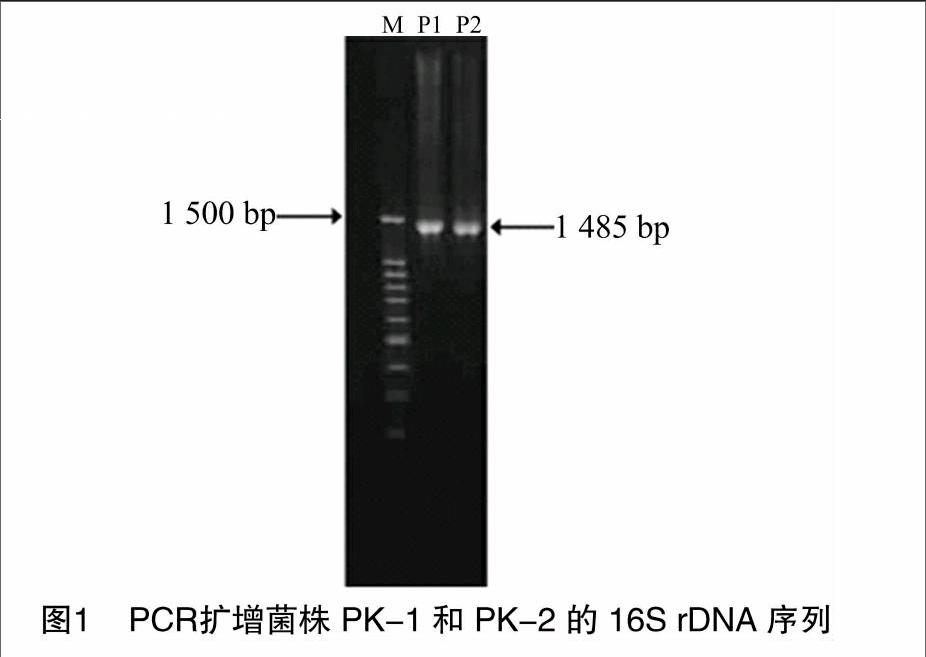
提取的菌株PK-1和PK-2基因组DNA经1.0%琼脂糖凝胶电泳检测,条带清晰,无非特异性条带,可用作16S rDNA PCR扩增的模板。菌株PK-1和PK-2的16S rDNA PCR 扩增采用1.0%琼脂糖凝胶电泳检测,结果在1 485 bp处有1条明亮的特征条带,并且无其他非特异性条带(图1)。
将菌株PK-1和PK-2的16S rDNA基因测序所得序列,采用Blast进行同源性比较,与GenBank中的核酸数据对比分析,选取同源性较高的代表菌株,以16S rDNA基因序列为基础,构建系统发育树。从图2中可以看出菌株PK-1与肠杆菌属(Enterobacter)的细菌自然聚为1支,它的16S rDNA序列与河生肠杆菌[Enterobacter amnigenus (JQ063000)]有较高的同源性,相似度达100%,因此可鉴定菌株PK-1为肠杆菌属。菌株PK-2与芽孢杆菌属(Bacillus)聚為1群(图3),它的16S rDNA序列与同温层芽孢杆菌[Bacillus stratosphericus (KX262677)]有较高的同源性,相似度为100%,因此可将菌株PK-2鉴定为芽孢杆菌属。
3结论与讨论
从云南省西双版纳州普文镇番木瓜根际土壤中筛选得到2株解磷解钾细菌PK-1和PK-2,通过平板测定D/d值和摇瓶测定发酵液中的全磷、全钾含量和可溶性磷、可溶性钾含量评价其解磷、解钾能力。在解磷解钾能力的平板测定试验中,PK-1解有机磷的D/d值为3.48,大于PK-2的1.46;PK-2解钾的D/d值为1.65,大于PK-1的1.26;解无机磷平板里PK-1和PK-2均没有出现透明圈。解磷、解钾能力的摇瓶测定试验中PK-2溶解无机磷的量为17.26 μg/mL,明显高于PK-1的 1.63 μg/mL;PK-1溶解有机磷的量为8.49 μg/mL,明显高于PK-2的2.38 μg/mL;PK-2溶解钾的量为8.49 μg/mL,略高于PK-1的8.15 μg/mL。解有机磷和解钾方面,菌株PK-1和PK-2在摇瓶测定试验和平板测定试验中的解磷、解钾效果基本一致,这进一步验证了固体平板试验的结果,说明溶解有机磷的能力为PK-1>PK-2,PK-2溶解钾的能力大于PK-1但不显著;解无机磷方面,菌株 PK-1和PK-2在平板测定试验中均无透明圈出现,但在摇瓶测定试验中PK-1和PK-2表现出一定的解无机磷
能力(PK-2>PK-1),造成这种现象的原因可能是PK-1和PK-2的菌体在固体和液体环境中解无机磷能力不同,也可能是因为固体平板中磷酸钙的浓度过大,PK-1和PK-2的菌体溶解了部分磷酸钙但还不足以形成明显的透明圈。解磷解钾细菌在生长过程中能分泌一些物质,并向周围扩散,使菌落周围的培养基中磷酸钙、卵磷脂和钾长石矿粉溶解呈透明状,因而固体平板-透明圈法是判定菌株是否具有解磷、解钾能力的常用方法,适合进行解磷解钾菌的初筛,但存在一定的局限性,使用摇瓶培养测定能对菌株的解磷、解钾能力进行量化,更为准确和科学[13-15]。
通过16S rDNA对菌株进行初步鉴定,确定菌株PK-1属于肠杆菌属,菌株PK-2属于芽孢杆菌属,而肠杆菌属和芽孢杆菌属是较常见的解磷细菌和解钾细菌[16-19]。菌株PK-1和PK-2同时具有较强的解磷、解钾能力,这是一些其他的植物根际促生菌所不具备的特性,可进一步研发成为番木瓜微生物肥料生产菌种,具有重要的理论意义和实践价值。关于菌株PK-1和PK-2对番木瓜促生作用及对土壤微环境的影响等有待进一步研究。
参考文献:
[1]康贻军,程洁,梅丽娟,等. 植物根际促生菌的筛选及鉴定[J]. 微生物学报,2010,50(7):853-861.
[2]Ahmad F,Ahmad I,Khan M S. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J]. Microbiological Research,2008,163(2):173-181.
[3]Verma J P,Yadav J,Tiwari K N,et al. Impact of plant growth promoting rhizobacteria on crop production[J]. International Journal of Agricultural Research,2010,5(11):954-983.
[4]Sheng X F,Huang W Y. The conditions of releasing K-releasing by a silicate bacterial strain NBT[J]. Agric Sci in China,2002,1(6):595-604.
[5]Adesemoye A O,Kloepper J W. Plant-microbes interactions in enhanced fertilizer-use efficiency[J]. Applied Microbiology and Biotechnology,2009,85(1):1-12.
[6]胡江春,薛德林,马成新. 植物根际促生菌(PGPR)的研究与应用前景[J]. 应用生态学报,2004,15(10):963-966.
[7]Almora K,Pino J A,Hernandez M,et al. Evaluation of volatiles from ripening papaya(Carica papaya L.,var. Maradol Roja)[J]. Food Chemistry,2004,86(1):127-130.
[8]Dawkins G,Hewitt H,Wint Y,et al. Antibacterial effects of Carica papaya fruit on common wound organisms[J]. The West Indian Medical Journal,2003,52(4):290-292.
[9]万璐,康丽华,廖宝文,等. 红树林根际解磷菌分离、培养及解磷能力的研究[J]. 林业科学研究,2004,17(1):89-94.
[10]中國土壤学会. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,1999.
[11]Bochner B R. New technologies to assess genotype-phenotype relationships[J]. Nature Reviews Genetics,2003,4(4):309-314.
[12]Felsenstein J. Confidence limits on phylogenies:an approach using the bootstrap[J]. Evolution,1985,39(4):783-791.
[13]Nautiyal C S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiology
Letters,1999,170(1):265-270.
[14]王舒,张林平,张扬,等. 红壤区油茶根际解磷细菌的筛选、鉴定及其解磷能力[J]. 林业科学研究,2015,28(3):409-416.
[15]罗华元,常寿荣,王绍坤,等. 云烟高端品牌植烟区根际土壤高效解钾菌的筛选[J]. 西南农业学报,2011,24(5):1813-1817.
[16]王岳坤,于飞,唐朝荣. 海南生态区植物根际解磷细菌的筛选及分子鉴定[J]. 微生物学报,2009,49(1):64-71.
[17]任嘉红,刘辉,吴晓蕙,等. 南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果[J]. 微生物学报,2012,53(3):295-303.
[18]刘璇,孔凡玉,张成省,等. 烟草根际解钾菌的筛选与鉴定[J]. 中国烟草科学,2012,33(3):28-31.
[19]秦文旺,牧耀贵,吕利华,等. 一株解钾高活性胶质芽孢杆菌的筛选与育种[J]. 山西农业科学,2015,43(4):434-438.王晓飞,邓超冰,许桂苹,等. 应用体外模拟法评价土壤中重金属的人体健康风险[J]. 江苏农业科学,2017,45(6):251-254.
doi:10.15889/j.issn.1002-1302.2017.06.065

