隐性听力下降小鼠耳蜗内毛细胞突触的病理改变
尹彦波 袁雅生 迟放鲁
(复旦大学附属眼耳鼻喉医院耳鼻喉科 上海 200031)
隐性听力下降小鼠耳蜗内毛细胞突触的病理改变
尹彦波 袁雅生 迟放鲁△
(复旦大学附属眼耳鼻喉医院耳鼻喉科 上海 200031)
目的 探讨噪声暴露后出现暂时性阈移的小鼠在听觉反应阈值完全恢复正常后耳蜗内毛细胞突触的病理改变。方法 将小鼠分为正常对照组和实验组,实验组小鼠进行强度98 dB SPL、时长2 h的噪声暴露,建立暂时性阈移模型。将对照组和暂时性阈移模型小鼠进行全基底膜铺片并行免疫荧光染色,共聚焦显微镜拍照成像并观察细胞形态。利用耳蜗长度计算耳蜗所处的频率位置,最后用图形处理软件对突触结构进行三维重建,观察对照组小鼠和实验组小鼠的耳蜗内毛细胞突触前、后结构的空间分布规律及其病理改变特点。结果 对照组小鼠耳蜗内毛细胞的突触复合体有明显的分布特点,每个内毛细胞通过5~30个突触与耳蜗神经纤维形成突触连接,靠近蜗轴侧的突触前结构体积较大,与之相匹配的突触后结构体积较小。靠近柱细胞侧的突触前结构体积偏小,与之相匹配的突触后结构体积偏大。实验组小鼠在高强度噪声暴露后第2天听觉测试结果显示,听性脑干反应(auditory brain-stem response,ABR)和畸变产物耳声发射(distortion product otoacoustic emission,DPOAE)阈值升高30~40 dB,2周后再次测试显示阈值恢复正常,但是ABR的Ⅰ波波幅下降46.1%,且耳蜗内毛细胞的突触复合体结构数量也减少了41.3%。 而内毛细胞和螺旋神经节细胞没有明显丢失。结论听觉阈值功能测试对判断小鼠耳蜗内毛细胞突触的损害和丢失不敏感;而听觉阈上功能测试对评价小鼠耳蜗内毛细胞突触的损害和丢失相对敏感。
噪声性聋; 暂时性阈移; 隐性听力下降; 突触; 小鼠
耳聋是临床上常见的疾病,往往严重影响患者的生活质量。导致耳聋的病因有基因因素,也有环境因素(如噪声暴露、创伤和药物等)。每年有出生缺陷的新生儿中,就包括大量的听力障碍患儿。据中国残疾人联合会的抽样调查统计显示,我国听力残疾人数约占总残疾人数的1/4。轻中度听力障碍患者可以借助助听器来改善听力;重度听力障碍患者需要安装价格昂贵的人工耳蜗来恢复听力[1],这些都会给社会和家庭带来沉重的经济和精神负担。因此,早期发现听力下降和尽早实施临床干预可以避免和减轻听力障碍的进一步加重。
目前国内职业病防治所和许多企业都非常重视噪声性聋的防护工作,对长期在噪声环境下工作的工人发放防噪耳塞并进行定期的听力检测和筛查,一旦发现异常,尽早调离噪声工作岗位,避免听力的进一步下降和严重伤害[2]。但是,许多听力障碍患者并不能及时就医进行诊断和治疗。尤其对于那些隐性听力下降的患者,临床并不能及时发现。因此,及早发现听力下降比较隐匿的人群、及早给予预防和治疗具有重要的临床意义。
本研究拟对小鼠在噪声暴露箱内实施2 h 98 dB的噪声暴露,暴露后第2天及2周后进行听力测试,并观察小鼠耳蜗内毛细胞基底区的突触结构及病理改变,以期为隐性听力下降的临床患者的研究提供更多的实验依据。
材 料 和 方 法
实验动物及主要试剂 SPF级CBA小鼠,18~22 g,8~10周龄,按照随机数表法分为对照组(18只)和实验组(18只),动物饲养及动物实验方案均严格按照动物伦理委员会实验动物规范执行。
隐性听力下降动物模型的建立 将实验组小鼠放入噪声暴露箱中,98 dB (8~16 kHz)噪声暴露2 h,噪声箱内进行噪声暴露前必须先进行校准,以保住噪声暴露的一致性。
电生理数据的采集 两组小鼠脑干诱发电位和耳声发射测试均在隔音室内测试,室内温度控制在31 ℃。使用胺酮(100 mg/kg,i.p)和甲苯噻嗪(10 mg/kg,i.p)联合用药进行麻醉,脑干诱发电位的刺激信号采用5 ms的短纯音,刺激速率固定在30次/秒。耳声发射的两个频率比为1∶1.2,两个频率的强度差为10 dB。得到的畸变产物耳声发射信号频率为2f1-f2。
全基底膜铺片 所有小鼠全身心脏灌注4%甲醛溶液固定,然后耳蜗灌注固定,在4%多聚甲醛溶液里放置2 h;EDTA除钙2天,加入5%的马血清,室温静置1 h;加入一抗,37 ℃过夜;加入小鼠(IgG1)抗CtBP2@1∶200,小鼠(IgG2α)抗GluA2@1∶2 000兔抗VAT@1∶200;第2天,冲洗3次,用时10 min;加入二抗,37 ℃静置1 h;加入山羊抗小鼠(IgG1)@1∶1 000,山羊抗小鼠(IgG2a)@1∶1 000,鸡抗兔@1∶200,冲洗;加入二抗,37 ℃静置1 h;加入山羊抗小鼠(IgG1)@1∶1 000,山羊抗小鼠(IgG2a)@1∶1 000,鸡抗兔@1∶200,冲洗。加入小鼠抗TuJ抗体@1∶500。加入小鼠抗PV31∶300。具体染色步骤和方法参考文献[3]。
免疫荧光共聚焦成像 使用德国Zeiss共聚焦显微镜观察两组小鼠完整的内毛细胞和突触的形态,每张图片上有大约10个内毛细胞,这些图像最终由Amira Imaging 图像处理软件进行突触形态的分析。
统计学处理 实验数据采用SPSS19.0软件进行统计学分析,计量资料采用t检验,P<0.05为差异有统计学意义。
结 果
正常突触结构的分布规律 共聚焦显微镜下可见,对照组小鼠每个突触复合体的前结构和后结构完美地匹配在一起,靠近蜗轴侧的突触前结构体积偏大,与之相对应的突触后结构体积偏小。在蜗轴侧和柱式细胞侧的这一条轴在线,突触前结构逐渐变小,突触后结构逐渐变大。到了柱式细胞侧,突触前结构体积偏小,突触后结构体积偏大,低放电率的传入纤维分布在蜗轴一侧,具有体积大的突触前结构(CtBP2)和体积小的突触后结构(GluA2),处理安静环境下低强度(阈值强度)刺激的声音。高放电率的传入纤维分布在柱细胞一侧,具有体积小的突触前结构和体积大的突触后结构,处理噪声环境下高强度(阈上强度)刺激的声音。螺旋神经节发出的不同放电率的传入神经纤维通过突触和内毛细胞连接。每个内毛细胞连接5~30个耳蜗传入神经纤维,不同的频率连接的神经纤维数目不一样。敏感频率连接的耳蜗传入神经纤维数目较多,非敏感频率(低频和高频)连接的耳蜗传入神经纤维数目较少,这样的解剖结构符合生物对外界不同频率和不同强度声音的敏感性(图1)。
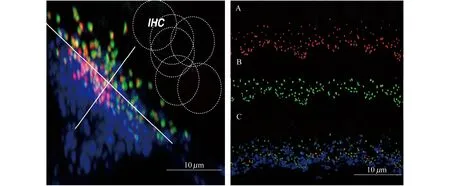
A:Inner hair cell area innmunostained for presynaptic ribbons.B:Inner hair cell area innmunostained for postsynaptic glutamate receptors.C:Inner hair cell area innmunostained for presynaptic ribbons,postsynaptic glutamate receptors and efferent terminals.
暂时性阈移小鼠听觉反应阈值的变化 噪声暴露的强度大小和时间长短对耳蜗损害的部位和程度有密切关系。实验组小鼠在98 dB SPL的噪声暴露2 h,暴露后的第1天,ABR和DPOAE阈值均升高了30~40 dB,2周后测试阈值均已恢复正常。对阈移进行统计学分析,发现噪声暴露后1天,与正常阈值相比阈值移动差异有统计学意义(P<0.01),但2周后阈值恢复正常,与正常阈值相比差异无统计学意义(图2)。
暂时性阈移听觉反应阈值恢复正常后耳蜗内毛细胞突触的病理改变 共聚焦显微镜观察到突触复合体的数量明显减少,减少数量差异有统计学意义(P<0.01);突触后结构明显减少,突触前结构孤立地存在靠近细胞核的细胞质中,而不是靠近细胞膜处。突触形态上数量的明显减少引起了耳蜗功能的改变(图3)。
暂时性阈移听阈恢复后小鼠的ABR Ⅰ波波幅的改变 2周后实验组小鼠ABR阈值恢复正常,但ABR的Ⅰ波波幅在32 kHz下降明显,下降幅度达40%~50%,Ⅰ波反应的生理解剖部位就是耳蜗传入神经,暂时性阈移的小鼠模型造成了内毛细胞之后的突触复合体数量减少,传入神经的神经兴奋冲动减少。在听觉阈上功能测试结果中,ABR Ⅰ波的波幅出现明显下降,差异有统计学意义(P<0.01),阈上测试结果显示听觉功能的改变与突触区的病理改变相一致(图4)。

图2 小鼠噪声暴露(98 dB SPL,2 h)后ABR和DPOAE阈值的变化Fig 2 Changes of ABR and DPOAE thresholds after acoustic trauma (98 dB SPL,2 h) in mice

A:Presynaptic ribbon of pre-trauma; B:Postsynaptic glutamate receptor of pre-trauma; C:Presynaptic ribbon of post-trauma;D:Postsynaptic glutamate receptor of post-trauma.
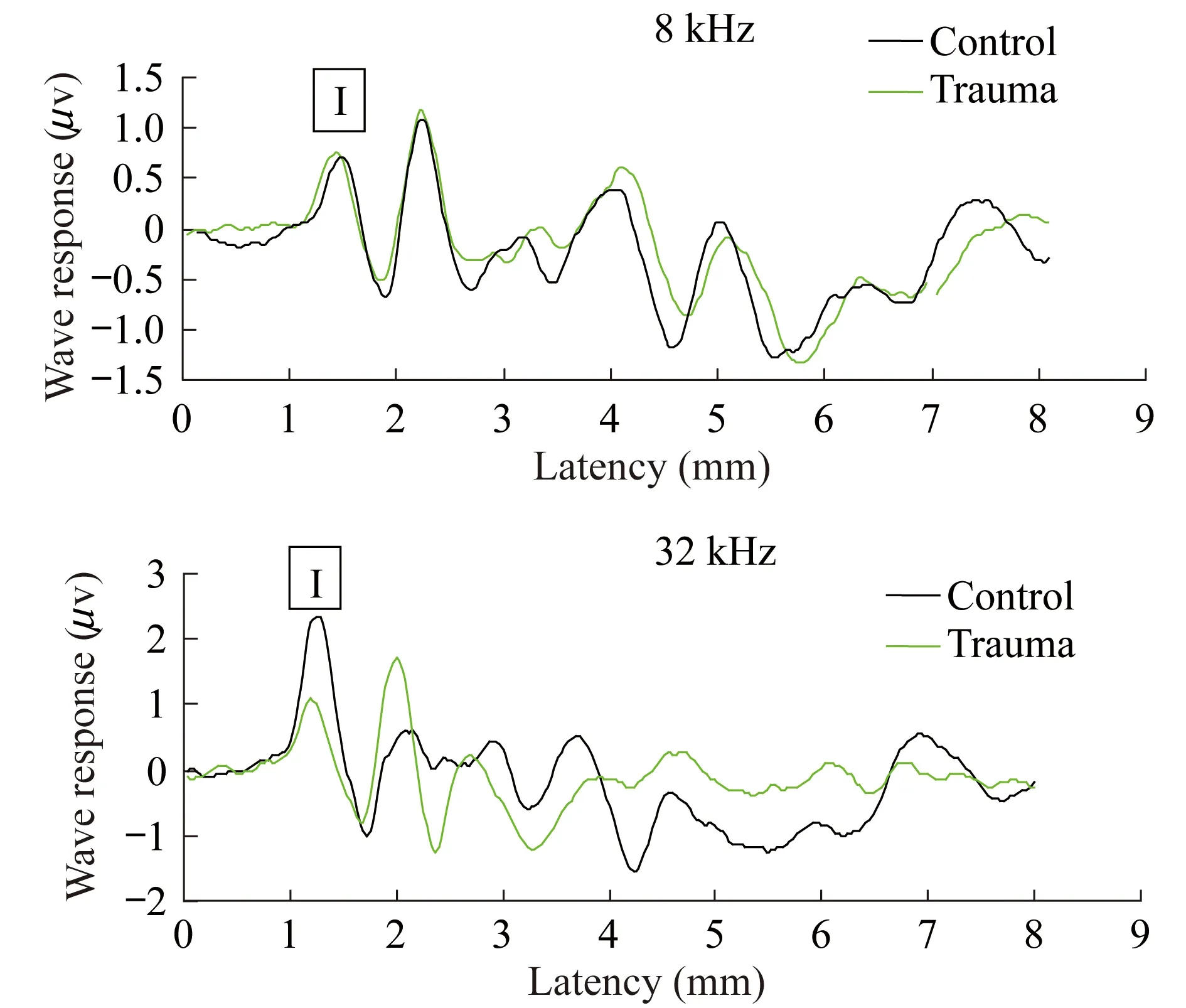
图4 小鼠噪声暴露(98 dB SPL,2 h)后 ABR Ⅰ波波幅的变化Fig 4 Changes of ABR Ⅰ amplitude after acoustic trauma (98 dB SPL,2 h) in mice
暂时性阈移听觉反应阈值恢复正常后内毛细胞和螺旋神经节细胞的计数变化 通过免疫荧光染色可以清晰地观察到小鼠内毛细胞和螺旋神经节细胞的形态和数量,通过计数后发现暴露前后差异无统计学意义(图5、6)。具体计数方法参考文献[3]。

A:Inner hair cells were stained with presynaptic and postsynptic markers and was highlighted by dashed circles and numbered.B:A 3D surface of inner hair cells was created in Amira Imaging inner hair cells were numbered.
讨 论
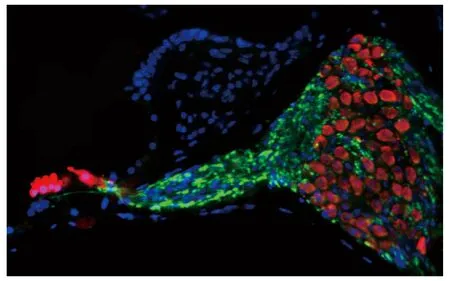
Red:Parvalbumin3 was used as an immunomarker for SGCS and hair cells.Green:Anti-neurofilament was used to label the auditory nerve fibers.
在日常生活和工作中,每个人接触噪声的强度大小和时间长短都不相同,因此所导致的听觉功能异常的程度和症状也不尽相同。临床上进行的听觉功能测试分为阈值功能测试和阈上功能测试,这些测试结果可以显示不同程度和不同性质的听觉功能障碍[4-5]。如爆震性耳聋,通常会伴有内耳耳蜗机械性的损伤,有些可逆,有些则不可逆[6]。在短时间的噪声暴露之后,听觉功能都会有不同程度损伤和恢复。有些听阈可以完全恢复正常(暂时性的阈值移动),有些听阈的升高会一直维持在一定的水平、不能恢复正常(永久性的阈值移动)。永久性阈移的病变部位主要在耳蜗的内毛细胞和外毛细胞,在强声暴露后的数天时间里就可以观察到毛细胞的受损和死亡[7]。然而,螺旋神经元细胞的胞体以及与内毛细胞基底区相连接的神经末梢的病理改变通常会在噪声暴露后的数月或数年的时间后发生。传统观点认为传入神经元发生的病理改变,主要是因为内毛细胞的死亡和丢失后,导致传入神经元失营养造成。由于失去了与内毛细胞的突触连接才最终导致蜗后传入神经元的退行性变化[8]。在暂时性阈移的动物模型中,实验数据显示内毛细胞和螺旋神经节并没有死亡,却仍然可以观察到耳蜗传入神经纤维的末端肿胀病变,这种损伤已经被证实为谷氨酸的兴奋性毒性,这种毒性确实可以造成耳蜗传入神经纤维末端的损伤[9]。有实验表明,谷氨酸拮抗剂可以阻断和缓解声音诱发的兴奋性毒性作用。对噪声性听觉损害有不同程度的保护和防护作用。也有实验数据表明,即使在没有声音诱发的情况下,也可以用人工的谷氨酸激动剂来模拟出来这种兴奋性毒性[10]。
本实验研究的暂时性阈移小鼠模型,电生理和病理结果显示耳蜗内毛细胞的结构没有受损,听觉反应阈值也没有受到影响。但是在内毛细胞基底区的突触复合体区域可以观察到突触前结构和突触后结构发生的不可逆的病理改变。尽管ABR的阈值恢复到了正常,但是ABR阈上功能的测试结果显示耳蜗的听觉功能发生了明显的改变,这些实验结果可以解释部分临床现象,虽然有些患者在安静环境中的听力测试阈值正常,但是在噪声环境下仍然会存在着不同程度的交流障碍。
本实验使用8~16 kHz的窄带噪声98 dB持续暴露2 h。在噪声暴露后的第2天,ABR和DPOAE的阈值升高了30~40 dB,但是在暴露后的2周,ABR和DPOAE的阈值均又恢复到了正常。仔细观察突触复合体的机构后发现,突触复合体丢失集中出现在32 kHz的区域,失去突触后结构以后,突触前结构会发生移动,从靠近细胞膜区域移动到靠近细胞核附近的细胞质中。说明一部分存在的突触前结构已经失去功能,从而失去了和细胞后结构的连接。此时再进行听觉阈上功能测试,发现ABR Ⅰ波的波幅仅恢复到暴露前的40%~50%,提示暂时性阈移的小鼠模型其耳蜗内存在部分神经病理学和阈上功能的改变,但听力测试阈值正常,因此可以想象,若患者耳蜗也存在此种改变,则这些病理改变在临床上很容易被忽视。小鼠耳蜗的这些病理改变并未在ABR和DPOAE的阈值上表现出来,而是在神经反应的幅值上表现了出来。神经反应幅值大小由参与神经反应的神经纤维的数量决定。当外界给予个体阈值强度的声音信号刺激时,仅需要少量的神经纤维参与即可完成对这些阈值强度声音的感知,不需要所有的突触复合体和耳蜗传入神经纤维参与。只有在高强度的声音刺激下,才需要更多的突触复合体和耳蜗传入神经纤维参与,来完成对更高强度刺激声音信号的编码和感知。
因此,ABR和DPOAE的听觉反应阈值测试对毛细胞的损害相对敏感,但对耳蜗突触和传入神经纤维的损伤不敏感,因为耳蜗传入神经纤维具有自发放电的特点,根据这个特点可分为高、低至少两种放电率的神经纤维。高放电率的纤维主要在柱细胞侧,低放电率的神经纤维主要在蜗轴侧。这些不同分组的神经纤维有不同的功能,高放电率的神经纤维处理低强度(阈值强度)声音,低放电率的神经纤维处理高强度(阈上强度)声音。有研究表明,在豚鼠的实验中,暂时性阈移模型造成的耳蜗神经纤维损失的实验数据符合本实验结果,感知高强度的低放电率神经纤维数从正常耳的49%下降到噪声暴露耳的27%[11],然而感知低强度阈值区域的高放电率神经纤维却无明显损失。这些实验数据说明,ABR的阈值未改变是因为没有损伤到感知低强度阈值区域的高放电率神经传入纤维,而ABR Ⅰ波波幅的降低反映了感知高强度声音的低放电率传入神经纤维受到了比较明显的损伤。这些结果可以解释临床上听觉阈值正常,但是在嘈杂的环境下听觉功能下降和言语分辨率降低的隐性听力下降的现象。
随着临床听神经病研究的深入,隐性听力下降的概念渐渐地被研究人员所接受[12]。临床上纯音听阈测试指标对听觉传入神经病变的敏感性很差,毛细胞之后的突触和耳蜗传入神经纤维病变的患者仍然可以表现为纯音听阈正常,但是患者的言语识别率很低,尤其在嘈杂的环境下。此时如果仔细观察ABR Ⅰ波波幅的变化,便可以检测到异常。因为当患者受损伤的部位是耳蜗传入神经纤维中的低放电率纤维,而高放电率神经纤维没有受到损伤时,ABR的阈值并不会发生改变,只是ABR Ⅰ波波幅发生改变。要得到正常的ABR Ⅰ波波幅,就需要更多的甚至所有的耳蜗传入神经纤维参与。只要损伤到了耳蜗传入神经,无论是低放电率、还是高放电率的传入神经纤维,ABR阈上功能的测试都会出现异常。噪声性耳聋和老年性耳聋的患者虽然纯音测试阈值升高不明显,但其言语识别率会出现明显降低,且与纯音听阈的升高不成比例,尤其在嘈杂的环境中听力障碍更加明显。这些患者的病理基础可能与突触病变和耳蜗传入神经元的退行性病有关[13]。
我们的实验提示,听觉阈功能的测试对判断耳蜗突触病变造成的听觉阈值正常的隐性听力下降可能具有指导意义,从而为隐性听力下降的临床患者的研究提供了更多的实验依据。
[1] 迟放鲁.哺乳动物耳蜗毛细胞再生的研究现状[J].中国眼耳鼻喉科杂志,2016,16(1):57-59.
[2] HENRY KR.Lifelong susceptibility to acoustic trauma:changing patterns of cochlear damage over the life span of the mouse[J].Audiology,1983,22(4):372-383.
[3] YUAN Y1,SHI F,YIN Y,etal.Ouabain-induced cochlear nerve degeneration:synaptic loss plasticity in a mouse model of auditory neuropathy[J].JAssocResOtolaryngol,2014,15(1):31-43.
[4] SAUNDERS JC,COHEN YE,SZYMKO YM.The structural and functional consequences of acoustic injury in the cochlea and peripheral auditory system:a five year update[J].JAcoustSocAm,1991,90(1):136-146.
[5] WANG Y,HIROSE K,LIBERMAN MC.Dynamics of noise-induced cellular injury and repair in the mouse cochlea[J].JAssocResOtolaryngol,2002,3(3):248-268.
[6] YOSHIDA N,HEQUEMBOURG SJ,ATENCIO CA,etal.Acoustic injury in mice:129/SvEv is exceptionally resistant to noise-induced hearing loss[J].HearRes,2000,141(1-2):97-106.
[7] LIN HW,FURMAN AC,KUJAWA SG,etal.Primary neural degeneration in the Guinea pig cochlea after reversible noise-induced threshold shift[J].JAssocResOtolaryngol,2011,12(5):605-616.
[8] OHLEMILLER KK,WRIGHT JS,HEIDBREDER AF.Vulnerability to noise-induced hearing loss in “middle-aged” and young adult mice:a dose-response approach in CBA,C57BL,and BALB inbred strains[J].HearRes,2000,149(1-2):239-247.
[9] KUJAWA SG,LIBERMAN MC.Adding insult to injury:cochlear nerve degeneration after “temporary”noise-induced hearing loss[J].JNeurosci,2009,29(45):14077-14085.
[10] LAWNER BE,HARDING GW,BOHNE BA.Time course of nervefiber regeneration in the noise-damaged mammalian cochlea[J].IntJDevNeurosci,1997,15(4-5):601-617.
[11] ADAM CF,SHARON GK,LIBERMAN MC.Noise-induced cochlear neuropathy is selective for fibers with low spontaneous rates[J].JNeurophysiology,2013,110(3):577-586.
[12] WANG Y,HIROSE K,LIBERMAN MC.Dynamics of noise-induced cellular injury and repair in the mouse cochlea[J].JAssocResOtolaryngol,2002,3(3):248-268.
[13] OHLEMILLER KK,GAGNON PM.Apical-to-basal gradients in age-related cochlear degeneration and their relationship to “primary” loss of cochlear neurons[J].JCompNeurol,2004,479(1):103-116.
The pathological change of synapses in cochlear inner hair cell of hidden hearing loss mice
YIN Yan-bo, YUAN Ya-sheng, CHI Fang-lu△
(DepartmentofOtolaryngology,EyeandENTHospital,FudanUniversity,Shanghai200031,China)
Objective To investigate the synaptopathy of hidden hearing loss mice,and to observe the synapses of the cochlear inner hair cell after temporary threshold shift of noise exposure. Methods Mice were divided into normal control group and experiment group,the latter was exposed under noise of 98 dB SPL for 2 h to establish the model of temporary threshold shift.Mice cochleae of the two groups were dissected and prepared with whole mount and immunostaining.Cellular morphology was observed under confocal laser scanning microscope.Cochlear lengths were measured through cochlear frequency map to localize hair cells in different frequency regions.Then,3-D morphometry of synapses was constructed by Amira software to observe pre-synaptic ribbons,post-synaptic receptors and its pathological changes. Results In control group,each cochlear nerve fiber contacted a single inner hair cell by a single synapse,each inner hair cell had 5-30 synapses contacting cochlear nerve fibers.The larger ribbons patched smaller receptors located in the modiolar side,and the smaller ribbons patched larger receptors located in the pillar side.While in experiment group,noise overexposures caused moderate or completely reversible thresholds shift,i.e.,distortion product otoacoustic emission (DPOAE) and auditory brainstem response (ABR) thresholds increased 30-40 dB.Although returned to normal after 2 weeks,ABR wave Ⅰ amplitudes recovered to only 46.1% of pre-exposure amplitudes.There was 41.3% synapses loss of inner hair cell,but there was no loss of inner hair cells and spiral ganglion neurons. Conclusions Threshold test is not sensitive to degeneration and loss of synapse in mice inner hair cells,while super threshold test is sensitive to it.
noise induced hearing loss; temporary threshold shift; hidden hearing loss;synapse; mice
国家自然科学基金面上项目(81271084)
R764.5
A
10.3969/j.issn.1672-8467.2017.02.008
2016-09-02;编辑:张秀峰)
△Corresponding author E-mail:chifanglu@126.com
*This work was supported by the General Program of National Natural Science Foundation of China (81271084).

