无透镜微流控成像流动细胞检测与计数系统*
黄汐威, 程 涛, 丁诚翔, 王 翔, 高海军, 苏江涛
(杭州电子科技大学 射频电路与系统教育部重点实验室,浙江 杭州 310018)
无透镜微流控成像流动细胞检测与计数系统*
黄汐威, 程 涛, 丁诚翔, 王 翔, 高海军, 苏江涛
(杭州电子科技大学 射频电路与系统教育部重点实验室,浙江 杭州 310018)
在未来面向个人化的生物医疗诊断中,实时的细胞检测与计数具有重要需求。现有的细胞检测和计数系统例如流式细胞仪和血细胞计数器不适用于小型化流动细胞实时检测和计数。通过将CMOS图像传感器芯片和微流控芯片结合,提出了一种用于流动细胞检测和计数的无透镜微流控成像系统,与用于计数静态细胞的其它无透镜微流控成像系统不同,该系统可以通过基于时域差分的运动检测算法检测和计数微流体通道中连续流动的细胞样本。测试结果表明:该系统可以对微流控通道中流动的人体骨髓基质细胞实现自动检测和计数,并具有-6.53 %的低统计错误率。该系统提供了面向未来即时应用的细胞检测和计数解决方案。
CMOS图像传感器; 微流控; 无透镜成像; 流动细胞检测和计数
0 引 言
在未来面向个人化的生物医疗诊断中,实时的细胞检测与计数具有重要需求[1~6]。例如:需要检测和计数血红细胞RBC以获得患者健康状况的信息,或通过对血液中的CD4+ T淋巴细胞的检测和计数监测HIV/AIDS的治疗状况[7~9]。传统的用于细胞检测和计数的设备有血细胞计数板和流式细胞仪[10,11]。目前,血细胞计数板采用基于显微镜的手动计数,对于高通量和大规模测试来说并非是实时或自动的。流式细胞仪虽然可以通过激光器和光学检测器精确和高效地计数聚焦流动流中的细胞,然而其体积庞大、操作复杂以及价格昂贵,限制了其在资源有限区域的即时应用。
针对上述问题,小型化的无透镜微流成像系统可以提供有效的解决方案[12~14]。待检测细胞可放置在显微镜载玻片上或微流控通道中,刚好位于CCD/CMOS图像传感器感应阵列上方,并与感应像素阵列保持紧密贴近的距离。当光源投射到细胞上时,细胞的阴影图像可以由其下方的图像传感器直接捕获。图像传感器的像素阵列和细胞的位置之间的距离称为物距。由衍射效应可知,物距是确定成像细胞的直径和对比度的关键参数[15]。与血细胞计数器不同,该系统在高通量下的细胞检测和计数仍以自动化方式进行。而与流式细胞仪相比,该系统没有大体积的光学透镜,其尺寸、重量和成本均得到了优化。
本文介绍了一种实时无透镜微流控成像系统,该系统主要针对高通量自动检测和在连续流动微流管道中细胞或微生物的计数。与仅需要一帧的静态细胞计数不同,流动细胞计数接收一系列帧。因为连续帧中的细胞运动受到微流体流速和传感器帧速率二者的影响,所以,使用一个基于快速时域差分的背景减法来进行运动估计。基于上述原理搭建的无透镜微流控成像系统成功实现了对流动人体骨髓基质细胞的检测和计数,经实验验证,系统的误差率仅为-6.53 %。
1 无透镜微流控成像系统
1.1 系统概述
针对流动细胞检测和计数所提出的无透镜微流控成像系统如图1所示。它包括一个与CMOS图像传感表面贴合的聚二甲基硅氧烷(PDMS)微流体通道。外部的注射泵驱动微流体进入通道并控制其流速,待检测细胞样本在该通道中连续流动。在微流体通道上方设置的光源采用常规白色LED,随着白光从上部投射到下方的细胞,其阴影图像被图像传感器捕获并输出,进而通过图像分析实现细胞的检测与计数。
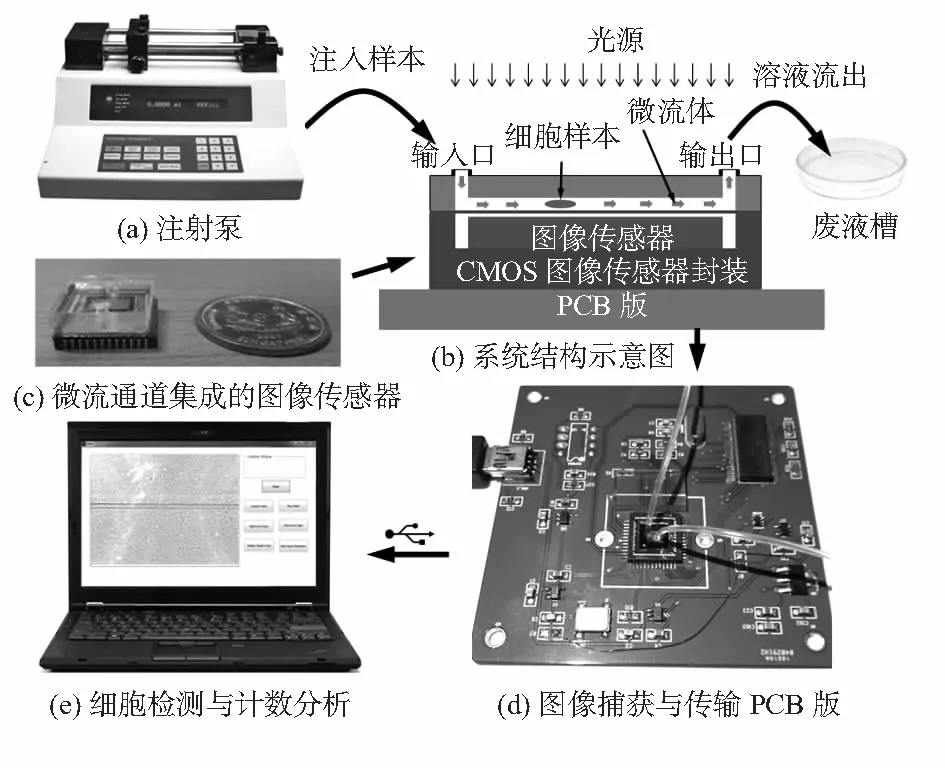
图1 无透镜微流控成像系统
图1(a) 注射泵用于驱动试剂进入微流体通道并控制流速,图(b) 与微流体通道结合并进一步组装在PCB上的CMOS图像传感器的结构示意图,图(c)微流通道集成的芯片照片与硬币对比图,图 (d) 用于CMOS图像传感器读取和与PC通信的PCB,图(e) 外部自主开发的用于细胞检测计数的软件模块。
1.2 微流体流动模型
如图2所示,假设细胞在注射泵的驱动下以RμL/min的流速沿着微流体通道从右向左流动。由于微流通道中的微流体具有稳定的层流特性,其中大多数细胞将以可预测的方式以相近的流速V下通过微流体进行输送。基于矩形微流体通道设计,通道中流体的流速为V=R/W·H,其中,W为通道宽度,H为通道高度。用于系统分析的所有符号和术语汇总如表1。
实时流动细胞检测和计数的主要难点为检测与通道背景相反的物镜差异的运动检测[16]。在无透镜微流控成像系统中,由于细胞通常具有一定的透明度,它们的图像无法显示出与背景的高强度差异,二者的对比度不高,易受背景亮度和暗度变化的影响。本文采用基于时域差分的运动检测[16,17]方法实现一系列帧中的流动细胞检测和计数。利用细胞图像的强度特性,分2个步骤进行:1)对每1帧中的所有单元执行运动检测;2)基于每1帧中的细胞计数执行总细胞计数。下面给出每个步骤的更详细的讨论。

表1 无透镜微流控成像系统符号汇总
1.3 细胞检测
通过利用连续帧的逐像素强度差来检测移动细胞区域。差异主要由通道中的细胞运动或者从传感器视场(field-of-view,FOV)中添加或去除细胞引起。1个完整帧包括对应于传感器FOV的m(H)×n(V)个像素。图2(a)和图2(b)仅显示出通道中单个细胞图的一部分。
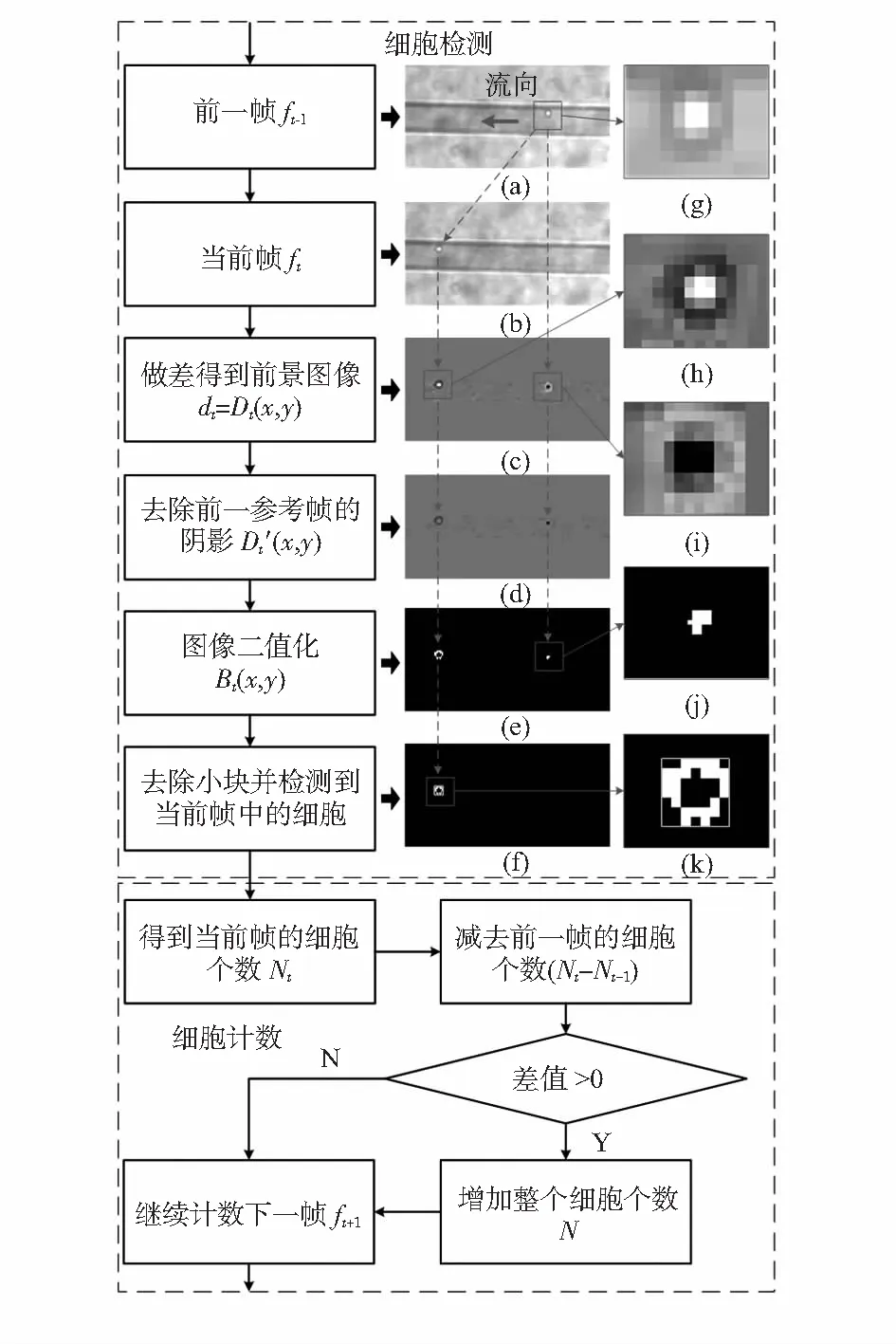
图2 基于时域差分的流动细胞检测和计数的流程和相应的图像
细胞检测程序如图2所示。(a)~(f)对应于细胞检测步骤的细胞图像,(g)~(k)对应于图(a), (c), (e),(f)中的小细胞图像的放大细胞图像。从右到左流动的1个细胞在2个连续帧ft-Δt和ft中的2个不同位置被捕获。其中,ft-Δt为参考帧(或背景帧),ft为当前帧,如图2(a)和图2(b)所示。2个帧ft-Δt和ft之间的时间差是Δt,其由CMOS图像传感器帧速率Fps确定,即Δt=1/Fps。假设系统在某个照明下工作,当前帧可以被定义为
ft=It(x,y)+ΔIB(x,y)|x∈m,y∈n
(1)
式中It(x,y)为由像素坐标(x,y)处的当前帧ft的细胞阴影引起的像素强度的部分,ΔIB(x,y)为由照明确定的背景强度变化以及来自通道或传感器表面的可能污渍。
由于细胞的透明性,由无透镜微流控成像系统捕获的细胞图像显示出中心区域较亮和在细胞边界处黑暗的特性,如图2(g)所示。说明中心像素具有比背景更高的强度水平,相对地,边界处的像素具有比背景更低的强度水平。利用背景减除算法,可以获得时域差分图像dt=ft-ft-Δt,并且其对应的强度矩阵为
Dt(x,y)=[It(x,y)+ΔIB(x,y)]-[It-Δt(x,y)+ΔIB(x,y)]=It(x,y)-It-Δt(x,y)
(2)
式中Dt(x,y)为在相同位置(x,y)处的两个连续帧之间的强度差。在dt中,只有存在于ft-Δt和ft中的两个区域的细胞被清晰地示出来(图2(c)),并且其他的背景区域都被减为零。因此,背景变化效应降低。这两个细胞区域的差别在于,在当前帧ft中的细胞对应的一个细胞区域显示出在中心光亮和在细胞边界处黑暗的特性,如图2(h)所示;而由先前的帧ft-Δt中的细胞引起的区域被反转,其光亮处位于边界,而黑暗处位于中心,如图2(i)所示。这个在图2(i)中的细胞阴影变成在如图2(h)所示的流动细胞后面移动的人工“尾巴”。
为了检测当前帧中的实际细胞,“尾部”需要被去除。人工“尾部”的去除可以通过将Dt(x,y)大于零的部分设置为零来实现
(3)

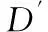
Bt(x,y)=0,else
(4)
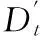
图2(k)中二进制图像中显示白色圆圈的大区域为当前帧ft(x,y)的实际细胞,图2(j)中白色像素块的小区域为前1帧ft-1(x,y)中的“尾部”细胞。所有这类区域均已被标记,因此,可以计数像素个数。将代表白色区域面积的像素计数与预定的去除阈值Tr进行比较,如果像素计数小于Tr,则对应的白色区域可以当做“尾部”细胞区域,故可将该区域去除如图2(f)所示。利用这一计数方法,基于本文实验体系,得到Tr=8。
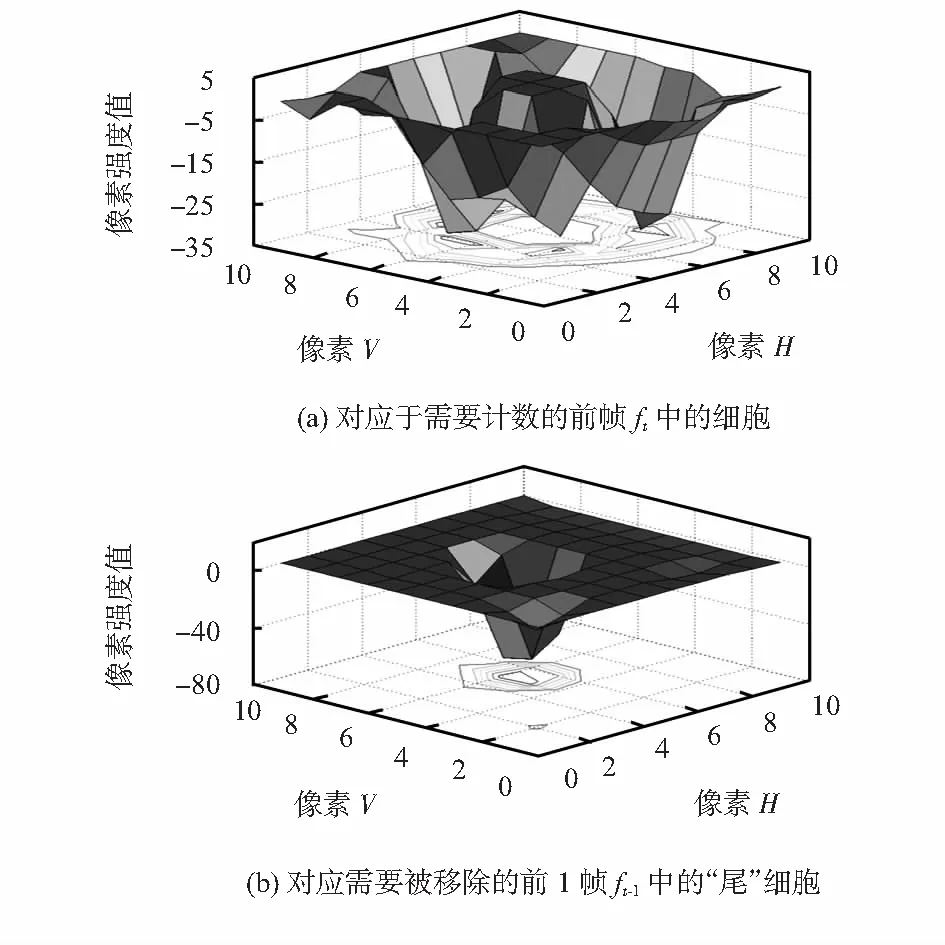
图(x,y)中的2个细胞区域强度分布
1.4 细胞计数
在完成每1帧的细胞检测之后,可以获得细胞的计数Nt和它们的质心坐标Ct,k(x,y),0≤k≤Nt,k为帧ft中的第k个细胞。为了统计由一系列图像(从ft=1至ft=M)拍摄的流过微流体通道的N个细胞的总数,其中M为具有M·Δt持续时间的一个测试图像的总数。N包括了对每1帧中的细胞计数进行的正时间差的和。
为了获得流动细胞的总数,采用时间减法(Nt-Nt-1)以计算在当前帧ft中进入微流体通道的新细胞。与前1帧ft-1相比,当前帧ft中的细胞可以有3种情况:1)新的细胞流入传感器FOV,细胞计数超过Nt-1;2)现有细胞流出传感器FOV,细胞计数减少Nt-1;3)没有新细胞流入或现有细胞不流出。因此,只有正时间细胞计数差能够有效地表示实际总细胞数N。在1次测试中处理每个新帧之后,通过将连续帧中的所有这些正细胞计数差值相加来获得最终总细胞计数N,即
(5)
由上式便可获得在一个测试中由一系列图像拍摄的流经微流体通道的总细胞数N。
1.5 性能分析
无细胞微流控成像的细胞检测和计数的目的是为了获得更高通量。单位时间内检测到的细胞数即细胞吞吐量,定义为P=W·H·L·ρ/t=W·H·ρ·V,其中ρ为检测试剂中的细胞浓度。显见流速V与微流体中的细胞通过量P成正比。由于V具有层流特性,因此1帧时间内细胞的最大流动距离不能超过通道长度L的1/2
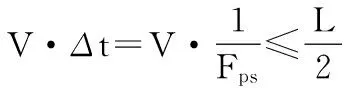
(6)
如果使用高帧速率传感器,可以减轻微流泵流量的限制,同时也将提高最大总吞吐量P=WHLρFps/2。然而,在无透镜微流成像系统中,高流速V可能在时间差方法中引起误差。
在细胞检测的过程中,由于来自CMOS图像传感器的慢快门速度或长曝光时间的限制,高流速V可能引起运动模糊效应并导致细胞成像中的对比度损失。这种情况下,每1帧的细胞检测期间,模糊细胞将被错误地判断为背景区域,进一步导致该帧中的计数误差。为了减少这种误差,需适当地控制流速V并减小传感器曝光时间。
在细胞计数过程中,基于时域差分的计数精度不仅与流速V有关,而且与传感器帧速率Fps有关。若在1帧中捕获现有细胞并且在下1帧中检测到的所有细胞都是新细胞,这种情况下,无论什么减法结果,计数都是错误的,因为这2帧之间没有时间连续性。为了消除这种错误计数,需要适当地控制帧速度V,使得通过至少2个连续帧捕获1个细胞以保证时间连续性。
2 系统搭建
2.1 微流控通道制造
微流控通道通过PDMS软刻蚀图案化制造。为了充分使用有源像素区域,选择微流通道长度为4.5mm,通道宽度设为100μm,确保细胞能够在通道中平稳流动,通道的高度为30μm,恰好高于一般细胞的直径。这一设置保证了细胞流动靠近传感器表面,可以产生更好的投影图像对比度[15]。
为了简化微流控芯片与图像传感器芯片的集成,微流控通道芯片直接贴合在CMOS图像传感器(AptinaMT9V032,SanJose,CA)的保护玻璃的顶部,其像素尺寸为11.5mm(W)×11.5mm(L)×2.3mm(H)。CMOS图像传感器具有4.5mm(H)×2.9mm(V)的光检测面积。传感器在全分辨率下的帧速率为60帧/s。传感器芯片焊接在一个低成本的6cm×6cm的PCB上,该PCB为传感器提供电源和数字控制信号。传感器通过USB接口传输数据到PC,可以确保高速成像和读取数据。读出帧存储在PC中,并且进行基于Matlab的数字图像处理以进行实时地细胞检测和计数。
3 实验结果
为了检查无透镜微流控成像系统的成像和检测效果,采用骨髓基质细胞进行检测与技术验证。图4(a)~(d)分别给出了静止低速(0.003m/s)、中速(0.036m/s)和高速(0.056m/s)状态下的成像结果。作为参考,图4(e)为10倍显微镜下的成像结果。传感器的帧速率为16帧/s。每个实验组拍摄4s的图像。

图4 无透镜微流控成像系统分别在静态和不同流速状态下拍摄的骨髓细胞图像以及在10倍显微镜下的细胞图像
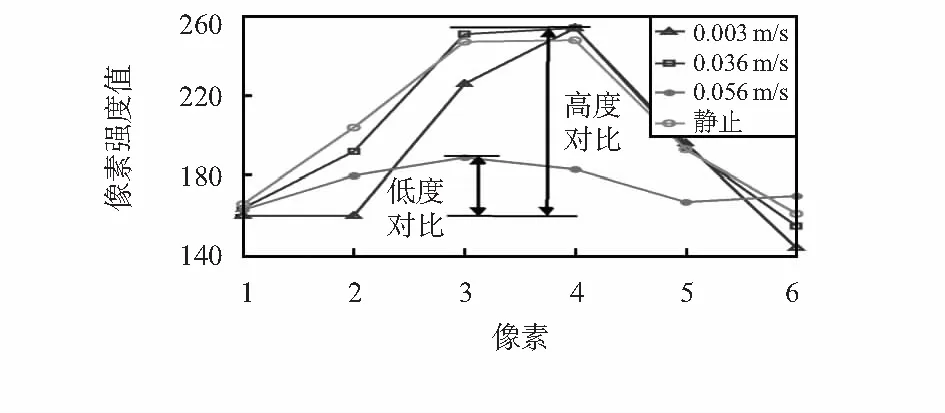
图5 在静态以及不同流速下无透镜细胞图像直径线强度分布
以0.3 μL/min和1.3 μL/min的不同泵流速进行流动的人体骨髓基质细胞的计数实验,以证明系统的计数精确度。每个实验组都包括系统在4 s内捕获的64个无透镜图像。检测期间,捕获到的图像通过USB输出到外部计算机以进行实时处理。由于仅在1帧通道区域进行选择和处理,所以有用数据减少到原始全图像数据的约5 %,因为该通道仅覆盖整个传感器有源FOV图像数据的4 % 。而总的处理时间约为2 s。因此,本文系统可以全自动、实时地面向高通量工作。
如表2所示,与通过人眼观察所捕获的图像的人工计数结果比较,自动计数,在0.3 μL/min的低流速下的平均细胞通过量为6个细胞/s,错误率为-1.6 %;在1.3 μL/min的高流速下,平均细胞吞吐量为12个细胞/s,错误率为-8.9 %。2种精度都在10 %的误差区域内。证明了系统的流动细胞检测和计数的有效性。错误率来自一些具有低对比度或噪声的误检测细胞。每个实验组的细胞吞吐量有限,因为目前的模型仅使用了1个100 μm宽的微流单通道,所以并没有充分利用有源传感器FOV。可以通过使用多个并行通道与更大FOV的传感器进行改进。此外,采用较高的帧速率传感器可以增加系统的最大允许流速,有助于提高吞吐量。
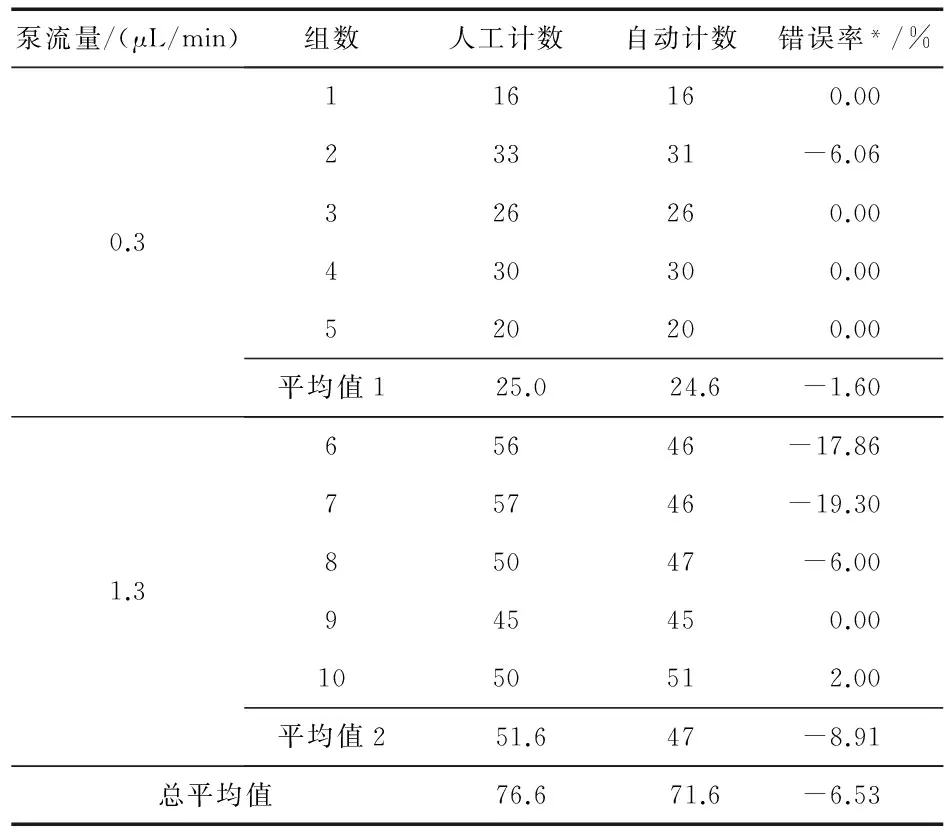
表2 无透镜微流控成像系统计数结果
*错误率=(自动计数-人工计数)/人工计数
4 结束语
将CMOS图像传感器与微流控芯片结合,实时无透镜微流控成像系统可用于自动流动细胞检测和计数。通过采用基于时域差分的运动检测方法,可以有效地检测和计数流动细胞,并具有-6.53 %的低统计错误率。与其它用于计数显微镜载玻片之间静态细胞的无透镜成像系统不同,该系统主要对连续流动环境中的细胞进行检测和计数,能够实现实时、自动化及便携即时的生物医学诊断。下一步工作主要是通过使用多个并行通道和更高帧速率CMOS图像传感器来提高吞吐量。
[1] June W,Han J,Choi J W,et al.Point-of-care testing(POCT)diagnostic systems using microfluidic lab-on-a-chip technologie-s[J].Microelectronic Engineering,2015,132(25):46-57.
[2] Hassan U,Watkins N,Reddy B,et al.Microfluidic differential immunocapture biochip for specific leukocyte counting[J].Nature Protocols,2016,11(4):714-726.
[3] Berry S B,Fernandes S C,Rajaratnam A,et al.Measurement of the hematocrit using paper-based microfluidic devices[J].Lab on a Chip,2016,16(19):3689-3694.
[4] Derda R,Gitaka J,Klapperich C M,et al.Enabling the development and deployment of next generation point-of-care diagnostic-s[J].PLOS Neglected Tropical Diseases,2015,9(5):e0003676.
[5] Wang S,Lifson M A,Inci F,et al.Advances in addressing technical challenges of point-of-care diagnostics in resource-limited settings[J].Expert Review of Molecular Diagnostics,2016,16(4):449-459.
[6] Guo J,Huang X,Ai Y.On-demand lensless single cell imaging activated by differential resistive pulse sensing[J].Analytical Chemistry,2015,87(13):6516-6519.
[7] Mayer K H,Krakower D S.Antiretrovirals for HIV treatment and prevention:The challenges of success[J].Journal of the American Medical Association,2016,316(2):151-153.
[8] Guo J,Liu X,Kang K,et al.A compact optofluidic cytometer for detection and enumeration of tumor cells[J].Journal of Lightwave Technology,2015,33(16):3433-3438.
[9] Huang X,Jiang Y,Liu X,et al.Machine learning based single-frame super-resolution processing for lensless blood cell coun-ting[J].Sensors,16(11):1836.
[10] Chen Y,Nawaz A A,Zhao Y,et al.Standing surface acoustic wave(SSAW)-based microfluidic cytometer[J].Lab on a Chip,2014,14(5):916-923.
[11] 丛玉隆,黄柏兴,霍子凌.《临床检验装备大全》仪器与设备卷[M].北京:科学出版社,2015:74-96.
[12] Huang X,Guo J,Yan M,et al.A contact-imaging based microfluidic cytometer with machine-learning for single-frame super-resolution processing[J].PLOS ONE,2014,9:e104539.
[13] Huang X,Yu H,Liu X,et al.A dual-mode large-arrayed CMOS ISFET sensor for accurate and high-throughput pH sensing in biomedical diagnosis[J].IEEE Transactions on Biomedical Engineering,2015,62:2224-2233.
[14] Aydogan O,Euan M.Lensless imaging and sensing[J].Annual Review of Biomedical Engineering,2016,18:77-102.
[15] Ji H,Sander D,Haas A,et al.Contact imaging: Simulation and experiment[J].IEEE Transactions on Circuits and Systems-I Regular Papers,2007,54:1698-1710.
[16] Lipton A J,Fujiyoshi H,Patil R S.Moving target classification and tracking from real-time video[C]∥Proceedings of the Fourth IEEE Workshop on Applications of Computer Vision,1998:8-14.
[17] Piccardi M.Background subtraction techniques:A review[C]∥Proceedings of IEEE International Conference on Systems,Man and Cybernetics,2004:3099-3104.
Lensless microfluidic imaging based cell detection and counting system*
HUANG Xi-wei, CHENG Tao, DING Cheng-xiang, WANG Xiang, GAO Hai-jun, SU Jiang-tao
(Key Laboratory of RF Circuits and Systems,Ministry of Education,Hangzhou Dianzi University,Hangzhou 310018,China)
The existing cell detection and counting systems such as flow cytometer and haemocytometer are not designed towards real-time for cells in flowing microfluid.Based on the integration of a CMOS image sensor and a microfluidic chip,a lensless microfluidic imaging system for detection and counting of flowing cells is presented.Different from the other lensless microfluidic imaging systems designed for counting static cells,the developed system can detect and count continuously flowing cells in microfluidic channel by temporal-differencing based motion detection algorithms.Measured experiment results show that human bone marrow stromal cells flowing in the microfluidic channel can be automatically detected and counted with low statistical error rate of -6.53 %.The developed system thereby provides cell detection and counting solutions for point-of-care applications.
CMOS image sensor; microfluidics; lensless imaging; cell detection and counting
10.13873/J.1000—9787(2017)05—0094—05
2017—03—28
国家自然科学基金资助项目(61501156,61372021);浙江省公益性技术应用研究计划项目(2017C31064);浙江省自然科学基金资助项目(LQ15F010005,LY17F010016)
TP 30
A
1000—9787(2017)05—0094—05
黄汐威(1987-),男,博士研究生,副研究员,主要研究方向为CMOS传感器与片上实验室系统。
王 翔(1984-),男,通讯作者,博士研究生,讲师,主要研究方向为集成电路设计研究工作,E—mail:wangxiang@hdu.edu.cn。

