1-三硝甲基-3-硝基-1,2,4-三唑的晶体结构及性能预估
殷 欣, 马 卿, 王 军, 王树民
(1. 西南科技大学分析测试中心, 四川 绵阳 621010; 2. 中国工程物理研究院化工材料研究所, 四川 绵阳 621999)
1 引 言
以氮杂环为结构单元的新型含能化合物一直是含能材料领域研究的热点,目前许多有前景的高能量密度含能材料都至少含有一个氮杂环结构单元。由于分子中存在大量的N—N键、C—N键以及环张力,使它们具有高的正生成焓,分子中高氮、低碳含量使它们易达到氧平衡,而且单位质量的产气量高。所以含有氮杂环的化合物通常具有高的密度、高的生成焓、燃烧产物毒性小等优点,在含能材料领域具有良好的应用前景[1-5]。三唑作为含氮量很高的一种氮杂环结构单元,其分子内及分子间易形成氢键,提高了化合物的稳定性; 由于环张力较小,环骨架为平面结构,使得分子的热稳定性增强。在氮杂环结构中引入三硝甲基对化合物的氧平衡和能量性能可以产生重要的影响[6-8]。Kofman等[9-10]合成了一系列以三唑为结构单元的三硝甲基取代的含能化合物,但在合成过程中使用了成本相对较高的有机碱三乙胺和100%硝酸作为反应试剂,并且对于它们的晶体结构及其它理化性能也未曾报道。
本研究以3-硝基-1,2,4-三唑为原料,参考文献[9]方法合成了1-丙酮基-3-硝基-1,2,4-三唑,利用发烟硝酸和浓硫酸体系对其进行硝化,合成出了目标化合物,培养了该化合物的单晶,利用X-射线单晶衍射仪对其晶体结构进行了分析; 采用差示扫描量热-热重(DSC-TG)联用仪分析了其热性质,对其标准生成焓和爆炸性质进行了理论预测,为其进一步研究和应用提供参考。
2 实验部分
2.1 实验仪器与试剂
3-硝基-1,2,4-三唑,分析纯,西亚试剂; 溴丙酮,分析纯,成都科龙试剂有限公司; 浓硫酸、发烟硝酸,分析纯,国药集团化学试剂有限公司。
仪器: 瑞士Bruker公司600 MHz(Bruker AVANCE Ⅲ 600)核磁共振仪,Me4Si为内标; 瑞士Mettler Toledo公司差示扫描量热-热重联用仪(TGA/DSC1); XRD单晶衍射采用Bruker SMART APEX Ⅱ CCD面探X射线单晶衍射仪。
2.2 实验步骤
以3-硝基-1,2,4-三唑为原料,参考文献[9]制备出1-丙酮基-3-硝基-1,2,4-三唑,再通过硝化反应制备出TNMNT,合成路线见Scheme 1。
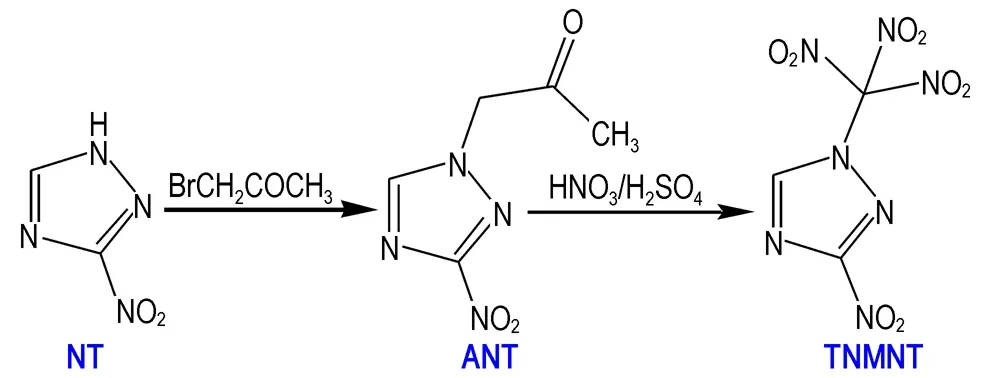
Scheme 1 Synthetic route of TNMNT
在室温条件下,将0.57 g(5 mmol)3-硝基-1,2,4-三唑、0.24 g(6 mmol)NaOH、7 mL水加入反应瓶中,搅拌滴加0.42 mL溴丙酮和12 mL丙酮溶液,滴加完毕后继续搅拌24 h,过滤干燥得1-丙酮基-3-硝基-1,2,4-三唑0.64 g,收率为76%。在-10 ℃条件下,将0.34 g(2 mmol)1-丙酮基-3-硝基-1,2,4-三唑加入到4 mL发烟硝酸和8 mL浓硫酸的混酸中,升至室温,继续搅拌48 h,将反应液倒入冰水中,用CH2Cl2萃取(20 mL×3)后,用蒸馏水洗至中性,旋蒸至干得白色固体 TNMNT 0.286 g,收率为62%。1H NMR(Acetone-d6,600 MHz):δ=9.7(1H);13C NMR(Acetone-d6,150 MHz):δ=29.8, 152.5, 205.0; IR(KBr,ν/cm-1): 798,837,877,939,1057,1237,1276,1302,1348,1377,1441,1524,1574,1621,2922,3151,3435。
3 结果与讨论
3.1 TNMNT的晶体结构
取适量 TNMNT样品,用无水乙醇溶解,过滤后于室温下静置2 d,自然挥发溶剂,析出淡黄色透明长条状晶体,用于单晶衍射分析。X-射线单晶衍射分析结果表明,化合物3-硝基-1-三硝基甲基-1,2,4-三唑属于单斜晶系,空间群P21/c,晶胞参数:a=6.643(3)Å,b=20.494(7)Å,c=6.698(3)Å,β=94.225(9)°,V=909.4(6) Å3,Z=4,Dc=1.922 g·cm-3,μ=0.190 mm-1,F(000)=528.0。最终偏差因子R1=0.0609,wR2=0.1295。单晶结构如图1所示。由图1可看出,分子结构中五元环的组成原子C(1)、N(2)、C(2)、N(3)、N(4)在同一平面上,三唑环的键长都在1.3 Å左右,说明键长趋于平均化,与三唑的芳香性一致; 三唑环的各键角接近108°,说明三唑环上各原子共平面。C(1)位的硝基与三唑环呈122.25°(φN2—C1—N1)和119.41°(φN4—C1—N1),N(3)位的硝仿基团与三唑环呈134.01°(φC2—N3—C3)和116.05°(φN4—N3—C3)。C—N键长为1.297~1.549Å,其中硝仿基团中的C—N键在所有C、N单键和双键中最长,N(5)—C(3)、N(6)—C(3)、N(7)—C(3)分别为1.542 Å、1.523 Å、1.549 Å,因此硝仿基团中的C—N断裂所需的能量也是所有C—N键中最小的。这说明在热分解过程中,硝仿基团中C(3)所连的硝基最先离去,其次为C(1)位所连的硝基,其C(1)—N(1)键长为1.406Å,这也是硝仿基团高能但敏感的原因。由晶胞堆积图可看出,该分子内氢键主要是N和H与邻近的N原子之间的氢键作用,而分子间氢键主要为O和H与邻近的O之间的氢键作用。分子内和分子间的氢键作用降低了因硝仿基团的引入对分子稳定性和安全性的影响。使得此类化合物的晶体密度增大,能量提高,感度降低[11]。
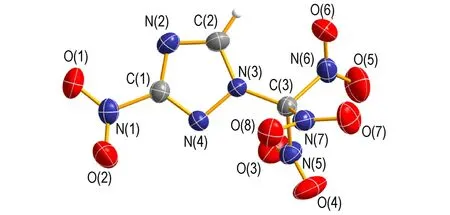
a. crystal stucture of TNMNT
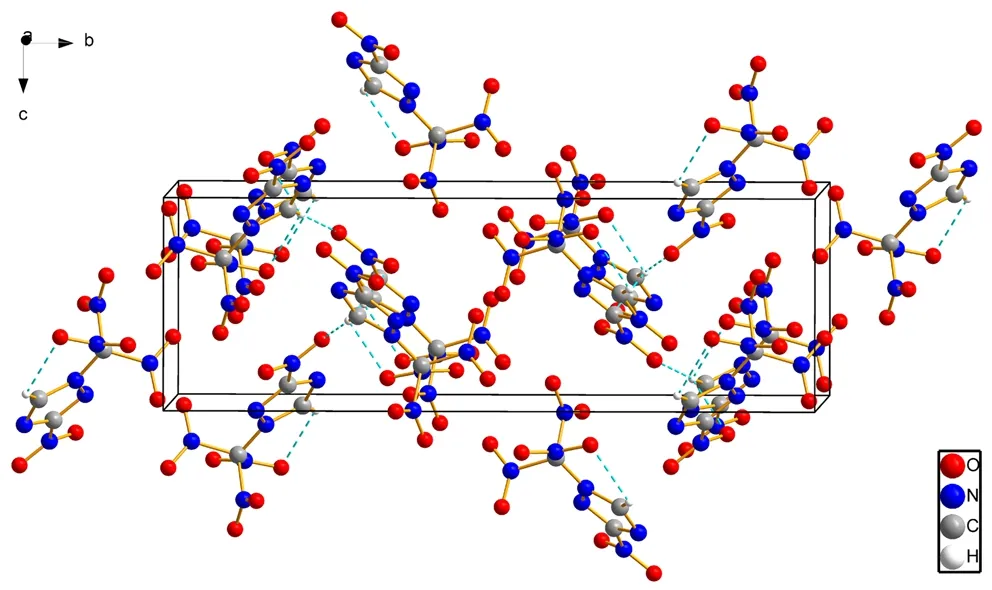
b. hydrogen-bond interaction of TNMNT
图1 TNMNT的晶体结构
Fig.1 Crystal structure of TNMNT
3.2 TNMNT的热稳定性
采用DSC-TG联用仪TNMNT的热稳定性进行了分析,其DSC-TG曲线如图2所示。由图2中的DSC曲线可知,TNMNT在5 ℃·min-1的程序升温过程中呈现一个明显的吸热峰和一个明显的放热峰,第一个吸热峰的峰值102.5 ℃,是TNMNT的熔化峰,峰形尖而窄,说明该熔化过程快速剧烈,其熔点较原料3-硝基-1,2,4-三唑的熔点(210 ℃)明显降低。第二个放热峰是TNMNT的分解峰,分解温度为158.3 ℃,表明该化合物在经过一个熔化过程,在158.3 ℃下发生了放热分解反应。由TG曲线可知,该化合物经过三个质量损失阶段,第一阶段为80~160 ℃,质量损失77.4%,在此阶段中该化合物先熔化吸热,然后分解放热。第二阶段为160~210 ℃,失重16.09%,第三阶段为210 ℃以后,失重6.51%,这两个阶段为分解残余物继续发生缓慢分解。从DSC-TG曲线图可推测,虽然N-硝仿基的能量较高,但其热稳定性比C-硝基弱,反映在初始分解及失重阶段上,首先应为N-硝仿基的分解,其次才是C-硝基和唑类骨架的分解。
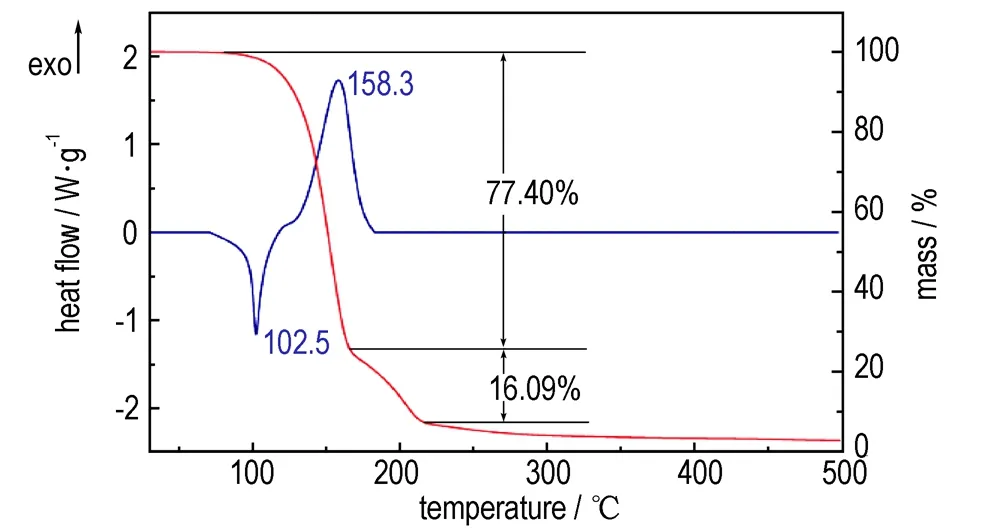
图2 TNMNT的DSC-TG曲线
Fig.2 DSC-TG curve of TNMNT
3.3 TNMNT的爆轰性能
为了研究TNMNT的爆轰性能,在B3LYP/6-31+G**∥MP2/6-311++G**水平下,运用Gaussian 09程序[12],对其标准摩尔生成焓进行了计算,进一步采用EXPLO5程序[13]对其爆轰性能进行了预测,结果见表1。由表1可见,TNMNT的固相生成焓为210.9 kJ·mol-1,高于RDX和FOX-12; 用EXPLO5程序对TNMNT的预估爆速为9023 m·s-1、爆压为35.5 GPa; 高于RDX和FOX-12。
表1 TNMNT和其它炸药的能量特性
Table 1 Energy properties of TNMNT as well as other explosives

compd.ρ/g·cm-3ΔHf,solid/kJ·mol-1D/m·s-1p/GPaTNMNT1.922 210.9902335.5FOX-12[14]1.75 -355.0832326.5RDX[14]1.81 80.0887234.7
4 结 论
(1) 以3-硝基-1,2,4-三唑为原料,通过取代、硝化反应合成出了TNMNT,总收率为62%。
(2) 培养了TNMNT的单晶,293(2) K下的晶体密度为1.922 g·cm-3,属于单斜晶系,空间群P21/c,a=6.643(3)Å,b=20.494(7)Å,c=6.698(3)Å,β=94.225(9)°,V=909.4(6)Å3,Z=4,μ=0.190 mm-1,F(000)=528.0。晶体内存在分子内和分子间氢键作用,提高了分子密度和稳定性。
(3) TNMNT的熔点(102.5 ℃)较3-硝基-1,2,4-三唑(210 ℃)低,标准生成焓(210.9 kJ·mol-1)、爆速(9023 m·s-1)和爆压(35.5 GPa)均明显高于RDX,在低熔点弹药中有应用前景。
参考文献:
[1] Chavez D E, Hiskey M A, Gilardi R D. 3,3-Azobis(6am-ino-1,2,4,5-tetrazine):a novel high-nitrogen energetic material[J].AngewandteChemieInternationalEdition, 2000, 39(10): 1791-1793.
[2] Kerth J, LObbecke S. Synthesis and characterization of 3,3-azobis(6-amino-1,2,4,5-tetrazine)DAAT-a new Promising nitrogen-rich compound[J].Propellants,Explosives,Pyrotechnics, 2002, 27(3): 111-118.
[3] Huynh Dr M H V, Hiskey Dr M A, Hartline E L, et al. Polyazido high-nitrogen compounds: hydrazo-and azo-1,3,5-triazine[J].AngewandteChemieInternationalEdition, 2004, 43(37): 4924-4928.
[4] Zhou G, Zhang J L, Wong N B, et al.Computational studies on a kind of novel energetic materials tetrahedrane and nitro derivatives[J].JournalofMolecularStructureTheochem, 2004, 668(2-3): 189-195.
[5] Neutz J, Grosshardt O, Schaufele S, et al. Synthesis, characterization and thermal behavior of guanidinium-5-aminotetrazolate (GA)-a new nitrogen-rich compound[J].Propellants,Explosives,Pyrotechnics, 2003, 28(4): 181-188.
[6] Thottempudi V, Gao H, Shreeve J M. Trinitromethyl-substituted 5-nitro- or 3-azo-1,2,4-triazoles: synthesis, characterization, and energetic properties[J].JournaloftheAmericanChemicalSociety, 2011, 133: 6464-6471.
[7] Dalinger I L, Vatsadze I A, Shkineva T K, et al. Novel highly energetic pyrazoles:N-trinitromethyl-substituted nitropyrazoles[J].ChemistryanAsianJournal, 2015, 10(9): 1987-1996.
[8] 肖啸, 姚二岗, 刘庆, 等. 5-硝基-3-三硝甲基-1H-1,2,4-三唑和5,5′-双(三硝甲基)-3,3′-偶氮-1H-1,2,4-三唑的合成与理论研究[J]. 含能材料, 2016, 24(1): 45-52.
XIAO Xiao, YAO Er-gang, LIU Qing, et al. Synthesis and theoretical studies of 5-nitro-3-trinitromethyl-1H-1,2,4-triazole and 5,5′-bis(trinitromethyl)-3,3′-azo-1H-1,2,4-triazole[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2016, 24(1): 45-52.
[9] Kofman T P, Kartseva G Y, Glazkova E Y, et al. Nitration of triazolyl-substituted ketones[J].RussianJournalofOrganicChemistry, 2005, 41(5): 753-757.
[10] Kofman T P, Kartseva G Y, Glazkova E Y. 5-substituted 3-nitro-1-trinitromethyl-1,2,4-triazoles[J].RussianJournalofOrganicChemistry, 2008, 44(6): 870-873.
[11] 尹磊, 张至斌, 张建国, 等. 3,4-二硝基吡唑的晶体结构[J]. 含能材料, 2016, 24(10): 965-968.
YIN Lei, ZHANG Zhi-bin, ZHANG Jan-guo, et al. The crystal stucture of 3,4-dinitropyrozloe[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2016, 24(10): 965-968.
[12] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09, Revision D.01, Gaussian [CP/DK]. Inc., Wallingford CT, 2009.
[13] Suceska M. Evaluation of detonation energy from EXPLO5 computer code results[J].Propellants,Explosives,Pyrotechnics, 1999, 24(5): 280-285.
[14] Klapotke T M, Schmid P C, Schnell S, et al. Thermal stabilization of energetic materials by the aromatic nitrogen-rich 4,4′,5,5′-tetraamino-3,30-bi-1,2,4-triazolium cation[J].JMaterChemA, 2015, 3: 2658-2668.

