基于微流控液滴技术的载药缓释微球研究进展
杨兴远,夏曾子露,温维佳†,高兴华††
①上海大学材料基因组工程研究院,上海 200444;②香港科技大学理学院物理学系,香港九龙 清水湾
基于微流控液滴技术的载药缓释微球研究进展
杨兴远①,夏曾子露②,温维佳①②†,高兴华①††
①上海大学材料基因组工程研究院,上海 200444;②香港科技大学理学院物理学系,香港九龙 清水湾
单分散性载药缓释微球作为新型药物释放系统已成为缓释药物制剂研究的热点问题之一,但传统制备方法获得的载药微球大多存在大小不均一、粒径分布宽、载药量低、缓释效果不明显等问题,极大地限制了其应用。微流控液滴技术因其操作简单,可以控制液滴形成的过程,成为近年发展起来的制备单分散性载药微球的新方法,在制备粒径均匀、具有特殊性能等载药微球方面有极大的优势。本文从传统载药微球的制备及存在问题入手,简述微流控技术的基本原理及液滴微流控制备载药微球的基本方法与类型,体现微流控技术相比传统制备技术的优势,即可以制备得到粒径均一、大小组分可控且呈单分散性的药物可控释放微球。
载药缓释微球;微流控液滴技术;微流控芯片
随着生物技术的迅猛发展,各种小分子化合物、多肽类、蛋白质类药物被大规模生产,并以药物制剂的形式用于治疗人类疾病。长久以来,传统的药物制剂已经在医疗保健及国民经济发展中做出了卓越的贡献,但很多药物制剂在临床应用中存在体内药物利用率低、毒副作用明显以及需频繁用药以维持药效等诸多问题[1-3]。传统的注射剂、片剂、胶囊剂、贴片、气雾剂等药物制剂已不能满足临床使用的需求,现今药物制剂的研究开发已逐渐转入对新型药物释放系统的开发探索[4]。
药物释放系统,又称给药系统、药物输送系统,是指将药物或者其他生物活性物质和载体材料结合在一起,使药物通过扩散等方式在一定的时间内以一定的速率释放到环境或者输送到特定靶组织,实现对药物等的控制释放。通常采用人工合成的生物可降解聚合物作为载体材料制备载药微球,该种载体材料具有可降解、可控释、生物相容性好等特性,并已被广泛应用于药物载体的研究,如聚乳酸(PLA)、聚羟基乙酸(PGA)、乳酸-羟基乙酸共聚物(PLGA)、聚己内酯(PCL)等[5-7]。此外,利用物理或化学方法将药物或生物活性物质包封在此类高分子材料中,制备成微米级别粒径(1~500 μm)的微球体,给药后经微球基体的不断降解及药物本身的逐渐扩散,可达到对药物的缓慢控释效果。目前常用的载药微球制备方法有乳化溶剂挥发法、喷雾干燥法等。这些传统方法主要采用机械搅拌或者超声震荡等方法制备微球,存在微球粒径不均一、药物包封率低、不利于药物的控制释放等问题。
微流控液滴技术是近年发展起来的制备单分散微球的新方法。在微流控芯片上通过调节连续相和分散相的流速可制备大小均一的液滴和微球。较之常规的制备方法,基于微流控技术制备的载药微球粒径均一、大小可控、呈单分散性,用于药物载体可以较好地控制药物的释放,对控制体内血药浓度的稳定、降低毒副作用、提高药物利用率有着重要的意义,因而备受关注。本文从传统载药微球的制备及存在问题入手,通过简述微流控技术的基本原理及液滴微流控制备载药微球的基本方法与类型,体现微流控技术相比传统制备技术的优势,即可以制备得到粒径均一、大小组分可控、呈单分散性的药物可控释放微球。
1 传统载药微球的制备方法
乳化溶剂挥发法是近年来人们最常用的微球制备方法,由于操作简易,对设备的要求不高,尤其适合于实验室等研究场所用来制备微球。乳化溶剂挥发法制备微球,是通过将高分子聚合物溶解于合适的、与水不互溶的有机溶剂中,然后将药物溶解(或者分散)于聚合物溶液中,得到的溶液(或者乳液)通过乳化的方式再次分散于水相中,得到分散独立的乳滴,最后通过有机溶剂的扩散挥发,聚合物沉析出来,得到包覆药物的微球颗粒,经由过滤干燥得到微球粉末。乳化溶剂挥发法可简单分为单乳法和复乳法。
喷雾干燥法是较早使用且很实用的一种制备微球的方法。喷雾干燥法是将药物的溶液或者乳浊液(W/O或S/O)通过高压喷嘴喷在热空气中使其雾化,然后在高温环境下迅速使有机溶剂挥发形成微球,相当于利用喷雾干燥器代替了二次乳化,直接将溶液、乳浊液干燥成粉状,较乳化溶剂挥发法省去了数小时的溶剂挥发时间,更为高效。然而,喷雾干燥法也存在诸多的问题,比如高温对药物的损伤、成型微粒难以分散以及微球产率较低等。
上述传统的载药微球在制备时均需要不断的机械搅拌或者超声震荡实现液滴的分散,由于外力的不稳定性,导致得到的液滴粒径分布、内部包裹药物含量等均匀性较差;并且机械搅拌对于微球表面摩擦磨损较大,对生物活性成分影响大,包封率较低;后期纯化微球的步骤较多,对微球的影响也较大,这使得微球批次之间质量差异性较大。因此,需要能够有效弥补传统载药微球缺陷的新方法,而微流控液滴技术因其操作简单,可以灵活控制液滴形成的过程,在制备粒径均匀的单分散载药微球方面有极大的优势,越来越成为当前的研究热点。
2 微流控芯片实验室
微流控技术(microfluidic)是一种以精确操控微尺度流体(10-9~10-18L)为主要手段,并涉及工程学、物理学、化学、材料学和生命科学等领域的系统科学技术。微流控芯片(microfluidic chips)是实现微流控技术的主要平台,其可将生物、化学、医学分析所涉及的基本操作缩微到一块几平方厘米大小的芯片上,以可控流体贯穿整个网络,用以实现常规生物、化学等实验室的各种功能。微流控芯片最大优势是灵活组合、规模集成、整体可控[8-10]。此外,相比于其他分析工具,微流控芯片的显著特征还在于其试剂消耗量极小,极大地降低了使用成本。与此同时,皮升甚至纳升级别的流体容积将会导致极高的分析效率,许多操作可以在数十秒之内自动完成。目前,微流控芯片技术已经广泛应用于生物、化学、材料等基础交叉学科的前沿领域,特别是在材料合成、疾病诊断、组织工程、药物筛选、生物仿生等方面具有重大应用前景[10-12]。
3 微流控液滴技术制备载药微球
3.1 微流控液滴技术简介
液滴技术是一种在微流控芯片上控制操纵微小体积液体行为的技术。这种技术是在微米级别的通道内,利用两种或多种互不相溶的流体间的流体剪切力及表面张力相互作用,从而导致连续流体被切断形成纳升至皮升体积大小的液滴。液滴性质操作十分灵活,按照连续相和分散相溶液的性质,可分为油包水(W/O)、水包油(O/W)、水包油包水(W/O/W)以及油包水包油(O/W/O)等类型。微流控液滴技术的研究领域包括液滴生成、操控、表面处理、应用等[10,13,15-16]。目前,形成微流控液滴的通道类型主要包括T型通道、流动共聚焦通道和共轴流动通道,如图1所示。这几种基础通道通过组合可以形成微流控芯片复合结构通道,以便于形成不同结构的液滴,如核壳结构、多孔结构等。
3.2 核壳结构的载药微球
在微流控管道中,通过多层连续相和分散相这两种互不相溶的溶液,可形成水包油包水(W/O/W)以及油包水包油(O/W/O)或者更加复杂的包覆等液滴结构,经固化后得到相应的核壳结构固体颗粒。核壳结构通常由中心的核以及包覆在外部的壳组成,内核与外壳间通过物理、化学作用相互连接,壳层或内核能够包裹具有生物活性的生物分子、药物及其他配体,能与生物环境体系中的细胞相互结合[17-18]。通常药物的控制释放是以药物为核,以响应性材料(pH、温度敏感性、磁响应)为壳。
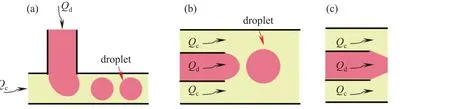
图1 三种液滴微流控通道:(a) T型;(b)共轴流动型;(c)流动共聚焦型
Gong等[19]以阿司匹林溶液为分散相,以含有纳米磁性粒子,即纳米四氧化三铁的壳聚糖溶液为连续相,在具有流动共聚焦结构的PDMS微流控芯片上得到核壳结构的液滴,再经过含有n-丁醇和戊二醛作为交联剂的通道固化,最终得到内核为阿司匹林溶液,外壳为嵌入纳米四氧化三铁的具有磁响应性质的药物缓释系统。研究表明,此种微球的药物释放是由于外加磁场下的壳层收缩-膨胀变形而产生的,并且释放能力受到外加磁场的强度、频率以及施加磁场的作用时间控制。相同条件下,外加磁场的强度越强、频率越大以及施加磁场的作用时间越长,则阿司匹林药物的释放能力越大。
Li等[20]以油溶性药物作为内核,以含有温敏性材料聚N-异丙基丙烯酰胺(PNIPAm)微凝胶以及纳米四氧化三铁的聚乙二醇二丙烯酸酯(PEGDA)作为外壳,在微流控芯片上制备得到具有远程热引发性质的核壳结构液滴,经紫外固化得到相应粒子。在颗粒外界远程施加交变磁场产生的感应热场使得纳米四氧化三铁受热,导致聚合物壳层受热并使具有温敏性的PNIPAm收缩,同时生成微米级空隙或通道,内核中的药物通过空隙或通道而得到释放。更重要的是,此空隙或通道在外界交变磁场产生的热源撤销后,可恢复原状,阻止药物进一步释放。3.3 多孔结构的载药微球
采用微流控技术,同样可以得到多孔结构的载药微球。其基本过程与核壳结构相似,但是在内水相中需要包含一些致孔物质,如碳酸氢铵、过氧化氢等,这些致孔剂分解产生二氧化碳、氨气、氧气等气体,释放后穿过壳层,从而产生具有多孔结构的载药微球。多孔结构微球具有大的比表面积和孔体积,药物可吸附在多孔微球的表面或进入孔道内部,通过孔结构的调整可实现药物释放速度的可控。同时多孔结构致使微球密度低,可通过微球粒径和空隙的调控获得较为理想的空气动力学性质,便于吸入给药。
Ma等[21]将包含碳酸氢铵的水溶液作为内水相W1溶入含有PLGA的油溶液O,超声乳化得到初乳液W1/O,将上述初乳液W1/O作为分散相,聚乙烯醇作为连续相W2,在具有流动共聚焦结构的微流控芯片上制备得到W1/O/W2结构的液滴。随后形成的W1/O/W2液滴油相蒸发,PLGA沉淀,并在W2内表面形成壳层,同时使得W1和W2距离缩短,当接触时,则导致碳酸氢铵分解,产生气体,经干燥后,最终形成具有蜂巢结构的多孔微球。研究表明碳酸氢铵的含量对微球半径以及孔径有明显影响。Ma等分别制备了内水相含1%、5%、10%碳酸氢铵的微球,发现随着碳酸氢铵含量增加,制得的微球平均半径以及内部平均孔径都有着增大趋势,其微球平均半径分别为44.67 μm、61.93 μm、97.61 μm,内部平均孔径分别为2.28 μm、5.79 μm、8.70 μm。Ma等将抗癌药物卡铂封装入微球内部,体外药物释放结果表明:随着时间延长,卡铂释放含量逐渐增大,直至达到平衡,但释放过程中存在含量突变情况,这是由于吸附在微球表面的药物溶解在水相的影响。
Park等[22]以聚己内酯(PCL)和致孔剂莰烯的氯仿混合溶液作为分散相,以聚乙烯醇(PVA)的水溶液作为外部连续相,经流动共聚焦结构的微流控芯片后,固化得到具有多孔结构的PCL微球。进一步研究表明,PCL微球多孔结构的影响因素主要有致孔剂浓度、油相流速、连续相流速以及微球固化条件,如搅拌速率、固化温度。Park等固定致孔剂莰烯浓度为20%、油相流速1 mL/h、搅拌速率300 r/min、固化温度25 °C,研究连续相流速分别为10 mL/h、15 mL/h、20 mL/h、25 mL/h对PCL微球孔径的影响,研究结果表明:随着连续相流速从10 mL/h提高到25 mL/h,PCL微球孔径从607 μm降至384 μm。当控制连续相流速为15 mL/h,其他条件与上述情况相同,转而研究固化温度为4 °C、25 °C、35 °C对PCL微球孔径的影响,结果表明:随着温度升高,PCL微球孔径逐步增大。同等条件下,改变致孔剂莰烯浓度为10%、20%、30%、40%,结果表明:PCL微球平均孔径逐步增大,分别为11.4 μm、39.4 μm、55.7 μm、120.1 μm。此外,PCL多孔微球结构已经表现出具备携带药物以及携带细胞并提供增殖环境的功能,但还需进一步的研究。
3.4 各向异性粒子载药微球
各向异性粒子可以在同一个粒子中表现出多种组成成分、隔段、物理化学性质、极性、功能以及各式各样的形状,因此各向异性粒子可以应用于多种领域,例如生物医用材料、固体表面活性剂、生物传感器以及用于制备结构更复杂的材料等。各向异性粒子主要分为Janus粒子、补丁粒子以及多隔段粒子三类[23]。
Janus粒子是指具有非中心对称结构的微米级或纳米级的粒子,按结构和维数可分成球形、哑铃形、柱形、饼形和丝带形。近年来又出现了环形、雪人形、橡子形等结构的Janus粒子。现如今只要在形态、组成或化学性质上具有非对称结构的粒子都可以称为Janus粒子[24]。制备Janus粒子的方法主要有模板法、乳液法以及自组装法等。传统制备方法如模板法,虽然操作简单,可效率极低且无法大规模制备;乳液法与模板法原理相似,不同的是此过程是在乳液中进行的,可以大规模生产,但制备效率较低。
液滴微流控技术已经成为制备单分散粒子的重要手段,其最大优点是可以制备尺寸均一且形状和结构可控的微米甚至纳米级的单分散粒子。基于微流控技术的Janus粒子制备过程如下:首先将两种或两种以上的分散相通入Y型微通道内流动,在第一个通道交汇处,通过精确地调控两分散相的相对流速使它们以层流的方式合流进入主通道内;然后在下一个通道交汇处,合流的分散相被连续相剪切成具有双面或多面结构的液滴;液滴在主通道的下游经过光聚合或热聚合即可得到Janus粒子。
David Weitz等[25]把聚丙烯酰胺(PAAm)和经铵根离子表面修饰的聚N-异丙基丙烯酰胺(PNIPAm)微凝胶粒子共同溶于水溶液中,加入光引发剂、交联剂以及聚丙烯酸后,作为分散相通入微流控芯片中的毛细管道内;分散相在油相(硅油)的剪切力作用下乳化成小液滴,由于静电作用使得微凝胶粒子初步结合在一起;经过升温至65 ℃时,由于PNIPAm是温度敏感性材料,使得微凝胶粒子体积收缩并发生团聚,产生挤压作用,将PAAm推向液滴另一侧;最后经过紫外固化,形成了一侧为PAAm,另一侧为PNIPAm的Janus粒子。研究结果表明:制备得到的Janus粒子其中PNIPAm一侧表面较为粗糙,而PAAm一侧表面较为光滑;并且由于PNIPAm的温敏性,控制温度可以有效地改变Janus粒子两侧PNIPAm和PAAm的体积比。在PNIPAm相转变温度以下时,微凝胶粒子为亲水性,吸收液滴另一侧水分,使得液滴内部处于动态变化,可以调节两侧体积比。
4 结论与展望
本文综述了基于微流控技术制备载药微球的基本原理以及制备方法,并与传统制备载药微球的方法做了简要的对比。相比传统方法制备的微球粒径分布范围广、内部药物分布不均匀等问题,液滴微流控技术因其操作简单,可以灵活控制液滴形成的过程,因此在制备粒径均匀的载药微球方面有极大优势。
微流控芯片作为药物缓释系统研究平台虽仍处于早期研究开发阶段,但是作为一种新技术新平台,它存在着很大的发展潜力。随着微流控芯片技术向着多元化、自动化、规模化及功能化方向的不断发展,其将很大程度上改革现有的药物缓释系统研究平台,更加广泛地应用到系统生物学和人类疾病的研究中。
(2017年3月10日收稿)■
[1] 刘袖洞, 马小军, 袁权. 药物释放系统[J]. 化工学报, 2005, 6(56): 955-961.
[2] 孟宪军, 王吴. 长效多肽药物研究进展[J]. 中国生物工程杂志, 2003, 23(10): 24-27.
[3] CHEN M C, SONAJE K, CHEN K J, et al. A review of the prospects for polymeric nanoparticle platforms in oral insulin delivery [J]. Biomaterials, 2011, 32(36): 9826-9838.
[4] ALLEN T M, CULLIS P R. Drug delivery systems: entering the mainstream [J]. Science, 2004, 303(5665): 1818-1822.
[5] ANDERSON J M, SHIVE M S. Biodegradation and biocompatibility of PLA and PLGA microspheres [J]. Advanced Drug Delivery Reviews, 2012, 64: 72-82.
[6] LUCKE A, TEßMAR J, SCHNELL E, et al. Biodegradable poly (D, L-lactic acid)-poly (ethylene glycol)-monomethyl ether diblock copolymers: structures and surface properties relevant to their use as biomaterials [J]. Biomaterials, 2000, 21(23): 2361-2370.
[7] BURTON K W, SHAMEEM M, THANOO B C, et al. Extended release peptide delivery systems through the use of PLGA microsphere combinations [J]. Journal of Biomaterials Science, Polymer Edition, 2000, 11(7): 715-729.
[8] 方肇伦. 微流控分析芯片的制作及应用[M]. 北京: 化学工业出版社, 2005.
[9] 方肇伦, 方群. 微流控芯片发展与展望[M]. 现代仪器科学, 2001(4): 3-6.
[10] 林炳承, 秦建华. 微流控芯片实验室[M]. 北京: 科学出版社, 2006.
[11] XU Q, HASHIMOTO M, DANG T T, et al. Preparation of monodisperse biodegradable polymer microparticles using a microfluidic flow-focusing device for controlled drug delivery [J]. Small, 2009, 5(13): 1575-1581.
[12] CHEN Q, UTECH S, CHEN D, et al. Controlled assembly of heterotypic cells in a core–shell scaffold: organ in a droplet [J]. Lab on a Chip, 2016, 16(8): 1346-1349.
[13] 林炳承, 秦建华. 图解微流控芯片实验室[M]. 北京: 科学出版社, 2008.
[14] BILITEWSKI U, GENRICH M, KADOW S, et al. Biochemical analysis with microfluidic systems [J]. Analytical and Bioanalytical Chemistry, 2003, 377(3): 556-569.
[15] SQUIRES T M, QUAKE S R. Microfluidics: fluid physics at the nanoliter scale [J]. Reviews of Modern Physics, 2005, 77(3): 977.
[16] 张凯, 胡坪, 梁琼麟. 微流控芯片中微液滴的操控及其应用[J]. 分析化学, 2008, 36(4): 556-562.
[17] EGGERSDORFER M L, ZHENG W, NAWAR S, et al. Tandem emulsification for high-throughput production of double emulsions [J]. Lab on a Chip, 2017, 5: 936.
[18] DUNCANSON W J, LIN T, ABATE A R, et al. Microfluidic synthesis of advanced microparticles for encapsulation and controlled release [J]. Lab on a Chip, 2012, 12(12): 2135-2145.
[19] GONG X, PENG S, WEN W, et al. Design and fabrication of magnetically functionalized core/shell microspheres for smart drug delivery [J]. Advanced Functional Materials, 2009, 19(2): 292-297.
[20] LI X, IWAI K, PIRMORADI F N, et al. Controlled drug delivery via remotely heated core-shell magnetic microcapsules [J]. IEEE, 2015: 1049-1052.
[21] MA J, HUI Y S, ZHANG M, et al. Facile synthesis of biomimetic honeycomb material with biological functionality [J]. Small, 2013, 9(4): 497-503.
[22] PARK J H, HAN C M, LEE E J, et al. Preparation of highly monodispersed porous-channeled poly (caprolactone) microspheres by a microfluidic system [J]. Materials Letters, 2016, 181: 92-98.
[23] JIANG S, CHEN Q, TRIPATHY M, et al. Janus particle synthesis and assembly [J]. Advanced Materials, 2010, 22(10): 1060-1071.
[24] LV W, LEE K J, LI J, et al. Anisotropic Janus catalysts for spatially controlled chemical reactions [J]. Small, 2012, 8(20): 3116-3122.
[25] SHAH R K, KIM J W, WEITZ D A. Janus supraparticles by induced phase separation of nanoparticles in droplets [J]. Advanced Materials, 2009, 21(19): 1949-1953.
(编辑:段艳芳)
Microfluidic fabrication of drug-loaded microspheres
YANG Xingyuan①, XIA-ZENG Zilu①, WEN Weijia①②, GAO Xinghua①
①Materials Genome Institute, Shanghai University, Shanghai 200444, China; ②Department of Physics, Colledge of Sciences, The Hong Kong University of Science and Technology, Clear Water Bar, Kowloon, Hong Kong, China
Nowadays, monodispersed drug-loaded microspheres have been the focus in the research of stable and controllable releasing from microspheres. Traditional mechanical methods have been used as main techniques for microspheres preparation at present. However, these methods do not give a sufficient control over the microsphere size distribution. Moreover, microspheres prepared by these methods have a low drug-loading efficiency and poor performancefor drug sustained releasing. Microfluidic fabrication has been an ideal approach to prepare monodispersed drug-loading microspheres in recent years, which can control the process of droplet formation by a microfluidic chip with simple operation. Therefore, it has a great advantage in the preparation of drug-loading microspheres. The review aims to firstly discussing the existing problems of preparing microspheres by conventional methods, followed by giving a brief introduction to the principles of microfluidic technology and methods, and types of microfluidic droplet-formation technology for drug-loaded microspheres fabrication. In conclusion, compared with the conventional methods, microfluidic technology for droplet formation can get good tunability on components with controllable and monodispersed drug-loaded microspheres.
drug-loaded microsphere, microfluidic droplet technology, microfluidic chip
10.3969/j.issn.0253-9608.2017.02.005
†海外及港澳青年学者合作研究基金获得者,2014年国家自然科学二等奖获得者,研究方向:软凝聚态物理及软物质智能材料、先进功能材料及智能制造、微纳流芯片技术及控制、光学材料与生物材料技术及应用等
††通信作者,E-mail: gaoxinghua@t.shu.edu.cn

