基于微流控技术的高通量材料合成、表征及测试平台
林银银,巫金波
上海大学材料基因组工程研究院, 上海 200444
基于微流控技术的高通量材料合成、表征及测试平台
林银银,巫金波†
上海大学材料基因组工程研究院, 上海 200444
随着微流控技术的不断发展以及传统实验方法所暴露出的种种弊端,人们迫切希望微流控技术可以将传统实验室中的实验操作过程如样品预处理、混合、反应、萃取、分离、表征和检测等集中在一个芯片上,以微流控芯片代替传统实验室。这种高通量的实验方法将显著提高反应效率,增加产量,从而不但实现高通量材料的合成、表征与检测,也进一步促进了平台的集成化、微型化、自动化和便携化的发展。
微流控技术;合成;表征;测试;高通量
1 前言:微流控技术
微流控技术(microfluidics)是一种利用几十至几百微米通道以精确操控微尺度(10-9~10-18L)流体的技术,涉及到工程学、物理学、化学、微加工和生物工程等领域。微流控芯片(microfluidic chips)是实现其功能的主要平台,可将生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作环节微缩集成到一块几厘米的芯片上,由微通道形成网络,以可控流体贯穿整个系统,用以取代常规化学或生物实验室的各种功能。微流控芯片的基本特征和最大优势是多种单元技术在整体可控的微小平台上灵活组合、规模集成。
1.1 微流控技术的发展
20世纪50年代,美国学者L. T. Skeggs提出了技术间隔式连续流动,将分析化学实验转移到流体管道中进行,打破了传统实验技术,为分析化学的未来指明了发展方向[1]。20世纪70年代,美国科学家提出了流动注射分析的概念,使分析系统更加微型化。1979年,美国斯坦福大学制造出了世界上第一套有关气相色谱空气分析仪的微流控设备[2],为微流控的快速发展开辟了道路。1990年,瑞士的Andreas Manz教授最早提出微流控概念,旨在将微机电系统(micro electromechanic systems,MEMS)与分析化学相结合,做出各种功能集成在一起的微型分析仪器,即微全分析系统(miniaturized total analysis systems,MicroTAS或μ-TAS)。
在一段时期的学术刊物中,μ-TAS往往和微流控芯片混用。事实上,μ-TAS的提法是一个特定阶段人们对微流控芯片认识水平的反映。随着芯片上微混合、微反应技术的发展,特别是细胞培养、分选等技术的引入,细胞研究向芯片转移的速度加快,应用对象大大扩展,致使微流控芯片实验室远远超出了分析的范畴,虽然现阶段微流控芯片应用还主要集中在分析方面。
微流控芯片技术的发展是以芯片毛细管电泳的形式开始的。20世纪90年代初,A. Manz和D. Harrison等人[3-4]开拓性地开展了芯片电泳的研究工作,他们采用微机电加工技术在平板上刻蚀微管道,研制出毛细管电泳微芯片分析装置,开创了微流控芯片技术的先河。之后越来越多的学者对该领域进行了研究,加速了微流控技术的发展。1998年,微流控技术被评为世界十大科技进展之一。2001年,英国皇家化学学会为此专门推出了《芯片实验室》(Lab on Chip)期刊,如今该期刊已经成为了微流控领域的代表性期刊。2002年10月,R. Quake等人[5]以《微流控大规模集成芯片》为题在《Science》上发表文章,并介绍了集成有上千个阀和几百个反应器的芯片,显示了芯片由简单的电泳分离到大规模多功能集成实验室的飞跃。如今微流控芯片已被列为21世纪最为重要的前沿技术之一。2003年10月《福布斯》(Forbes)杂志在纪念其创刊85周年的特刊上列出了影响人类未来的15件最重要的发明,微流控芯片名列其中。2004年9月美国《Business 2.0》杂志的封面文章称,微流控芯片是“改变未来的七种技术”之一。如今微流控已经发展成为前沿的独立科学领域。
1.2 微流控芯片的分类与应用
瑞士的Manz和Widmer等人提出以MEMS技术为基础的“微型全分析系统”之后,人们希望能将实验室的分析功能转移到便携的分析设备中,甚至到很小的芯片上。μ-TAS可分为芯片式和非芯片式两大类。在芯片式μ-TAS中,根据芯片的结构及工作机理又可分为:微阵列芯片和微流控芯片。
微阵列芯片或称生物芯片,主要以生物技术为基础,利用原位合成或点样技术有序地制作在基底材料表面,然后根据碱基互补配对原理与样品进行杂交反应,从而得到样品的相关信息[6]。由于生物芯片的主要应用对象是DNA的分析,所以也被称为DNA芯片。其发展要早于微流控芯片4~5年。如今微阵列芯片也可用作材料的合成[7-9]。图1就是利用微阵列芯片合成不同形貌的贵金属纳米结构,并通过这一高通量的技术快速确定材料合成的最佳实验参数[10]。但是,微阵列芯片所需设备昂贵,分析时间较长,灵敏度不高,多样品平行分析能力不足。微流控芯片则是主要以分析化学为基础,以微机电技术为依托,以微管道为结构特征的另一类芯片,且微流控芯片微米级的通道具有相对较大的比表面积和较短的扩散距离,能够显著加快分析速度、提高检测效率、增强分析性能,并且能够加工大量的平行通道用于多样品分析。图2为微流控管道中形成的液滴,这种液滴可以作为单独的微反应器,用以进行各类的生物化学反应[11-12]。虽然微流控芯片与微阵列芯片的原理、制作、操作以及检测方面均有所不同,但都具有高通量、微型化和自动化的特点,所以目前有许多研究是在微流控芯片上进行微阵列分析,旨在结合两者的优点。

图1 在硅基底上制作反应器阵列:(a)制作步骤;(b)试剂在穿孔的块状PDMS上形成浓度梯度[10]

图2 在微控管道中产生的微液滴中进行的混合反应[11-12]
微流控技术最先应用在分析领域,样品与试剂的低消耗、较高的分辨率和灵敏度、极短的分析时间是其明显的优点[13],而易于阵列化使其能够实现高通量检测、系统集成化、微型化、自动化和便携式。与传统分析手段相比,微流控芯片具有分析快速、消耗低、微型化、自动化等优点。
微流控芯片技术在生物医药领域的应用主要集中在医学检测、药品质量控制、药理研究等方面,如对血液、体液、尿液以及其他排泄物和分泌物的检验分析,对药品的有效成分进行分离和检测及其蛋白质分析、免疫分析、基因分析等方面的应用。在材料定向合成与表征、测试方面,微流控芯片技术也发挥着重要的作用,如高通量合成聚合物颗粒,包括球形、类球形、Janus颗粒,复合颗粒,金属或金属氧化物颗粒,聚合物等。
利用微流控技术进行材料的合成、表征及测试主要是因为微流控芯片所呈现出的独特性质:①微流控芯片中所研究的流体是在微米量级,这种介于宏观尺度和纳米尺度的流体具有特殊的性质,雷诺系数变小,层流特点明显,有助于更好地控制流体;②微管道由于特征尺寸比较小,导致体积力影响较小,表面力的作用相对增强,且由于比表面积随着特征尺度的减少而迅速增大,与表面积相关的力如黏性力、弹性力、表面张力、静电力的作用变得比较明显,从而大大影响了质量、动量、能量在微流体器件中的运输;③微米尺度仍然远大于通常意义上分子的平均自由程,因此,对于其中的流体而言,连续介质定理成立,连续性方程可用,电渗和电泳淌度与尺寸无关。此外,传热、传质效率高,反应参数易精确控制,操作更加安全,反应效率增加,环境危害小等优点也是微流控近年来发展迅猛的主要原因。
一个完整微流控系统需要考虑许多问题,包括引入样品和试剂的方法、在芯片中控制流体流动的方法、如何混合,以及其他的微分析探测系统、产物纯化等。要想使微流控技术得到足够的发展,以芯片实验室彻底取代传统实验室,则需搭建一个基于微流控技术的高通量材料合成、表征及测试集于一体的集成化平台。
2 利用微流控技术进行材料的合成、表征及测试
2.1 材料的合成
液滴微流控是研究生成和操控纳升至飞升级液滴的科学与技术[1]。以液滴微流控为例,浅述微流控技术在微纳米颗粒合成方面的应用。相比于传统的制备颗粒的方法,如溶胶凝胶法、水热法、晶体生长法、微乳液聚合法等,微流控芯片可以提供设计、合成、控制颗粒性质的一体化平台[14-15],用以合成聚合物颗粒、Janus颗粒[16-17]、复合材料[18-19]等。同时,采用微流控技术制备纳米材料具有粒径形态可控、单分散性、绿色环保且能耗低等优势。David Baah等人[19]详细总结了常用的微流控设备(包括聚二甲基硅氧烷(PDMS)和玻璃)用以合成材料。PDMS装置极容易加工,可加工成各种形状用以合成球形颗粒和Janus颗粒,而玻璃毛细管也可用于这类材料的合成,并且可通过改变流动参数和溶剂合成特定结构的颗粒(图3)。
近年来,液滴微流控在控制反应计量比、反应时间、温度等实验条件上所体现出的优势日益明显,使液滴微流控在制备微纳米材料方面引起了人们的广泛关注[10,20-24]。Lee等人[23]利用水凝胶聚合物重组大肠杆菌细胞提取物,以液滴的微流体装置为基础建立人工细胞生物反应器,合成铁、金等多种金属纳米颗粒。Yao等人[10]利用液滴微流控设备精确控制温度和晶体生长时间以制备CdTe量子点。韩国浦项理工大学的Dong-Pyo Kim等人[25]则基于微流控平台合成了一系列金属有机框架化合物纳米晶并扩展到高压水热法合成均苯三酸配合物,最后通过两步微流控集成技术得到了核壳纳米结构。
不仅如此,因为液滴被与之不互溶的另一相间隔,每个液滴皆可作为独立的微反应器,一个液滴完成一个筛选反应,而且短时间内可以生成大量的微反应器,所以液滴微流控适合高通量的化学合成及生化分析,尤其在单细胞培养与分析、单分子检测、液滴数字聚合酶链反应(PCR)、功能性复合微球的应用研究方面备受瞩目。例如:Kyohei Takimoto[26]等人在微通道内形成的油包水液滴(图4),在液滴中水溶性单体与光引发剂进行反相悬浮交联聚合反应形成单分散的亚毫米级的微凝胶。通过油相的流动速率控制微凝胶的尺寸,利用这种方式合成的微凝胶可以用作无生物分子的亲和柱包装材料,在无泵情况下实现蛋白质的分离。Xu Yu等人[27]也利用液滴微流控单步合成单分散性的PLGA(poly(D,L-lactic-co-glycolic acid))功能聚合物微球。PLGA是一种重要的生物可降解聚合物,基于其重要的可降解性和兼容性,使其广泛应用在药物的释放等方面。单步合成PLGA的关键则是利用微流控技术形成稳定的微乳液液滴(W/O/W)。

图3 具有代表性的微流体装置。(a)~(e)为PDMS装置:(a)单入口;(b)多入口;(c)T型通道;(d)共流;(e)流动聚焦。(f)~(h)为毛细管玻璃装置:(f)共流;(g)流动聚焦;(h)共流与流动聚焦结合

图4 油包水液滴的产生以及液滴内发生的反应
液滴或气泡的尺寸可控对合成材料的应用具有重要的意义[28-29],并引起了人们的广泛关注[30-38]。Shelley L. Anna等人[33]利用微流控技术详细解释了液滴的尺寸和分布与流速之间的关系。P. Garstecki等人[39]也详细探究了影响尺寸可控的主要因素,以及在T型微流控设备中,设备的结构、连续相的黏性、界面张力等因素的影响。
因其微米数量级的通道结构、优良的液滴和流型操控性能、较快的传热传质速度等特点,微流控技术已经广泛应用于金属粒子、氧化硅、纳米沸石、量子点、金属有机骨架材料等微纳米材料的高效合成中。该技术方法具有制备时间显著缩短、产品尺度均一性好等优点,同时还能通过耦合多步合成过程制得微纳复合颗粒。这些功能性微球因其优良的物理化学性质而广泛地应用于化学、光学、电子、医学等领域中。
2.1.1 纳米材料的合成
目前基于微流控技术制备的纳米材料种类主要包括:金属纳米材料(如金[40-46]、银[47-49]、钯[50]、铜[51-59]等)、氧化物纳米材料[60-64]、量子点纳米材料[65-67]和复合材料等。以复合材料和金属纳米颗粒的合成为例简述微流控技术在纳米材料合成中的应用。
K. Aketagawa等人[68]首先通过鞘流微型通道产生液滴,通过多层光刻法制备聚二甲基硅氧烷(PDMS)的鞘流微通道,并最终合成致密的填充有TiO2纳米颗粒的藻酸盐-TiO2复合颗粒。将分散相通道与连续相通道连接,分散相在交叉点处膨胀成球形,曲率半径增加的同时导致拉普拉斯压力的急剧下降,有助于液滴的形成,如图5。将包含有TiO2纳米颗粒的藻酸钠水溶液作为分散相,而含有表面活性剂的向日葵油作为连续相,分散相进入连续相时形成单分散的液滴。使用微流体装置,在油相中形成含有低密度TiO2纳米颗粒单分散藻酸钠液滴。这种方法有利于单分散藻酸盐-无机复合颗粒的稳定生产和应用。

图5 具有台阶结构的鞘流PDMS微通道
对于金属纳米颗粒而言,由于其自身优异的光、电、热性能,使其在光电领域、生物成像和高导热流体方面有着广泛的应用前景。M. Thiele等人[47]先是利用微流体反应器,将NaBH4溶解在NaOH中,在聚苯乙烯磺酸钠的存在下还原硝酸银得到了银颗粒。所使用的微流体反应器包含三种不同的微混合器,严格控制每个合成步骤用以实现高度均匀的颗粒溶液,如图6所示。所产生的银颗粒可以用作形成各向异性颗粒的晶种,之后再进行晶粒的生长并最终生成三角形状的银纳米颗粒。
2.1.2 微材料的合成

图6 流动合成银种子颗粒:(a)完整合成图;(b)原理图
微流控技术不仅可以用来合成纳米颗粒,还可以合成微颗粒。利用单相法、两相法以及多相法合成特定功能和形状的微颗粒。Dhananjay Dendukuri等人[16]使用单相法结合显微镜投影光刻和微流控技术合成形貌复杂或具有多功能的颗粒。如图7所示,使用含有光引发剂的低聚物流过图中的微流控设备,通过使用倒置显微镜将流动的低聚物暴露于紫外(UV)光以形成掩模限定形状的颗粒阵列。我们可以通过透明掩膜板上的形状以控制合成颗粒的形状,而流动管道的深度则可以控制合成颗粒的尺寸和横宽比。图8就是利用连续光刻技术高通量合成的不同形状的微颗粒。这种高通量的方法可以更好地控制颗粒的大小、形状以及各向异性。

图7 微材料合成的实验装置图(箭头方向为单体流动方向,右侧插图为聚合物颗粒的侧视图)

图8 颗粒的扫描隧道图,除了(d)使用×40物镜外,其余均使用×20物镜,图中标尺均为10 μm。(a)~(c) 在20 μm高通道中形成的扁平多边形结构;(d))在9.6 μm高通道中形成的胶体长方体;(e)~(f)在38 μm高通道中形成的具有不同横截面的高纵横比结构;(g)~(i)在20 μm的高通道中形成的弯曲颗粒。 图中的插图显示了用于制作相应颗粒的透明度掩模特征
利用流动光刻技术合成微颗粒,除了单相法,使用较多的还有两相法。Doojin Lee等人[28]提出了两步法,先是利用微流控技术合成形状可调的蜡的微颗粒,而后经过液滴的冲击以及固化,使微粒变形产生非球形蜡微粒。如图9(a),在连续相包封熔融蜡液滴之后,在微通道中向下移出,在小孔处释放。如图9(b),由于蜡滴比浴液更轻,所以熔融的蜡滴在通过惯性冲击到液体池底部之后释放而反弹回液体界面。在这个过程中,液滴和周围液体之间发生快速热传递,导致熔融蜡微滴的固化,通过惯性、黏性、界面和热效应之间的竞争来控制微蜡滴的变形。通过改变这些影响因素可控地获得蘑菇状、椭圆形、圆盘状和片状形态。然而,在这项研究中,熔融蜡的分散相首先在微通道中的流动聚焦区破裂成离散的蜡微滴(图9(a)中的红色液滴)。当其向下游行并到达管出口时,滴落的连续相与包封的蜡形成液滴(图9(b)中的灰色液滴),灰色部分用作缓冲层以减少撞击溶液界面时的冲击能量。不仅如此,微流控技术还可以控制材料的形状。利用微流控技术和液滴的冲击合成形状可调的蜡微粒,蜡在熔融状态的黏度与流动相和分散相之间的界面张力决定着微流控通道内蜡液滴的形成。随着微流控技术的不断发展,合成材料的形状可控得以实现。
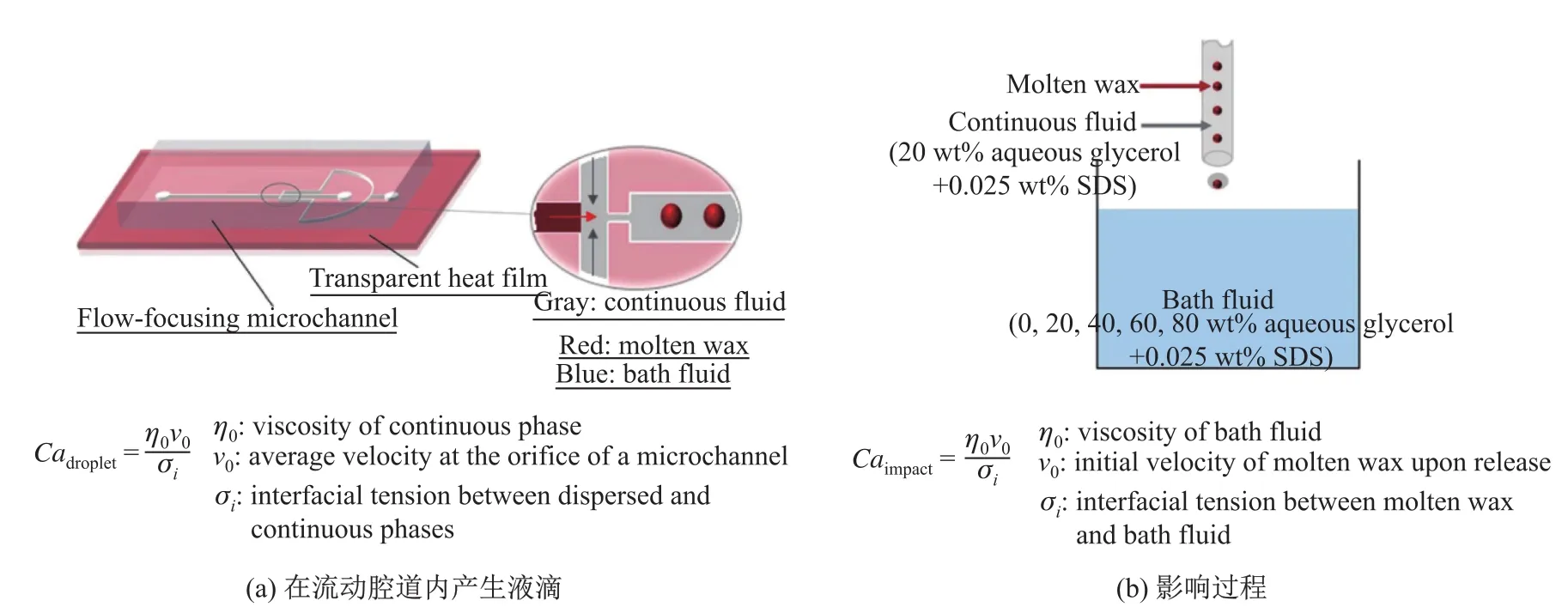
图9 熔融蜡滴撞击冷却水介质的实验设置示意图[28]
在两相法中使用较多的是T型微通道[39]和流动聚焦结构[69],利用两相流体的挤压合成颗粒。流动聚焦(flow focusing)是一种毛细流动现象,其原理为从毛细管流出的流体由另一种高速运动的流体驱动,经小孔聚焦后形成稳定的锥形,在锥的顶端产生一股微射流穿过小孔,射流因不稳定性破碎成单分散性的微滴。
图10就是利用流动聚焦结构合成多糖水凝胶微粒。利用注射泵将含有CaCO3的生物聚合物水溶液和油提供给微通道,在微流体流动聚焦装置中通过内部凝胶化制备生物聚合物水凝胶微粒。连续相(向日葵籽油)扩散到液滴中并触发Ca2+离子的释放,导致多糖链的交联,从而形成生物聚合物网络。利用此装置可以生成Janus微珠和复杂形状的多糖微粒[17]。
除了两相法,还可以利用多相法合成微纳米颗粒。Axel Günther等人[70]总结了关于多相流动特性的代表性研究(图11),并指出多相微流具有较大的界面面积,在两种不混溶流体之间可以提供有效的质量传递,并已被证明在评估短时间的反应机理和合成单分散纳米颗粒方面有极大的应用前景。
由于微芯片反应器合成纳米材料具有耗样少、产率高、操作简单等优异特性,已经被越来越多地应用于材料的合成研究中。基于微流控技术的高通量材料的合成成功地解决了传统批量合成存在的问题,使所合成的材料形态可控、粒径分布窄,几乎达到了单分散性分布,开启了纳米材料合成的新方向[71]。但是,基于微流控技术合成纳米材料还面临着许多挑战与创新。要制备高质量的微纳米材料,除了微芯片的通道结构设计以及对加工工艺的极高要求外,还需精确控制时间、温度、浓度、流速等实验参数。随着科技的发展,微型化、集成化与便携化成为了分析仪器发展的主要方向,实现多维度合成以及实时监测一体的微流控合成体系仍然需要不断的探索研究。

图10 利用流动聚焦结构将两种生物聚合物与在油中乳化的交联剂(CaCO3)混合用于Janus液滴的生成(区域1);乙酸从油相扩散到液滴诱导液滴凝胶化(区域2);预凝胶化的液滴在芯片外的CaCl2溶液中收集(区域3)

图11 I为在多相微流体网络中,它们与运输过程的关系;II为在化学和材料合成中的应用;III为研究包括通过分解成液滴、slugs和气泡(I(a)~I(c))而形成的多相流动模式:液-液(I(d)、I(g)、I(h))、气-液(I(e))和气-液-液(I(f)),并且通过毛细管力与静电(I(i))或压力场(I(j))的组合作用合并多相流。多相传输过程涉及液-液(II(a))和气-液(II(b))中的混合增强,液-液中的传质增强(II(c))以及减少气-液流中的轴向分散 (II(d))。已被证实多相反应(III(f)、III(g))的发生伴随着纳米颗粒和微粒(III(a)~III(e))的结晶、合成和组装。II(c) 流向为从左到右
2.2 材料的表征与测试
通常在合成材料之后,我们还需要对材料进行表征与测试。利用微流控技术进行反应合成之后,我们可以通过荧光或者X射线衍射进行结果分析,而一般合成的纳米材料还需要利用SEM、TEM进行形貌表征。检测则是微流控芯片里相对特殊的一个操作单元,其基本功能是用于捕捉并放大微流控芯片某一部分产生的信号。检测器中最常用的是激光诱导荧光,此外还有紫外、电化学、质谱、化学发光等,各种各样的传感器也被越来越多地用作微流控芯片的检测装置。迄今为止,大多表征和检测单元的体积相对于芯片尺度而言偏大,甚至可以称之为芯片的“外部世界”,影响微流控芯片整体的微型化。将生成物输出至材料表征、测试平台是实现材料合成、表征、测试一体化的关键。因此,利用微流控芯片进行材料表征与测试的研究已经成为微流控芯片领域的一个重点和热点。克服这一障碍大体采取两种途径:一是尽可能采用在体积上可与之匹配的检测装置,诸如电化学检测器或传感器;二是尽可能使现有检测装置小型甚至微型化。
在化学及生物分析的表征、检测方面,微流控技术也有广泛的应用,并已经逐渐成为重要的分析手段。其分析的优越性在细胞、分子水平上的检测得以应用和展现。以细胞研究为例,由于微流道尺度与细胞良好的相容性,可以在体外实现对体内细胞环境的高度模拟,实现单个细胞的实时检测和研究。所以,微流控技术在生命科学中的细胞培养、细胞操纵、试样处理及细胞检测方面有诸多应用[72-74]。
金帆等人[75]通过将分子生物学、微流控技术和多种显微镜手段结合,建立了一整套原位表征方法,并实现了对细菌表面黏附的微观状态和胞外聚合物在细菌和表面间产生的黏附力、摩擦力以及胞外聚合物的微流变性质的定量表征,系统地研究了铜绿假单胞菌胞外多糖Psl以及胞外分泌蛋白CdrA 的性质以及它们在细菌黏附过程中所扮演的角色。
许多微流控芯片研究致力于设计创造多功能微系统整合细胞检测中的分析步骤[73-74]。图12详细介绍了在药物发现的研究过程中所涉及的微流控的方法以及应用,从而在微系统上实现细胞特别是单细胞的生理、病理及药理等方面的研究。基于不同检测原理的众多检测方法都被运用于微流控芯片分析的研究中。微流控芯片检测器一般按照其原理分类,大致可以分为光学检测器、电化学检测器和质谱检测器等。

图12 利用微流控技术进行药物发现的研究[73]
材料的表征和测试也可以集成在同一微流控芯片上(图13)。Bo Ma等人[74]利用集成后的微流控设备同时进行药物代谢的表征以及毒性的测试。与常规的表征和测试方法相比,集成后的装置具有明显的优点:可重复的生物封装反应器;代谢物产生、检测和诱导的细胞毒性测定的原位偶联;类似于发生在人类肝脏的人肝微粒体代谢物的快速细胞毒性测定。此外,通过在微流控芯片上集成高密度微反应器和电池微室可以提高产量。微流体装置在高通量药物代谢和药物相互作用的研究方面起到了重要作用[76-79]。
3 总结与展望
综上所述,微流控技术在材料的合成方面有许多应用,如可以通过控制条件合成不同材料、不同形状、大小可控的颗粒,并且可以实现颗粒的分离与融合。生物医学是当前微流控芯片的主要应用领域,但随着加工技术的提高,微流控已经成功应用在食品和商品检验、环境监测、刑事科学、军事科学及航天科学等领域。微流控芯片的目标是取代常规分析实验室的所有功能,使所有的合成、检测、分析等过程全部在微流控芯片上实现。所以,微流控系统的研究,除了需要广泛的基础理论和应用基础外,还涉及到大量的微加工技术和芯片材料的内容。通过将光源、激发器、分析组件等元件小型化,减小检测的损耗和体积,发展出简易的现场、实时检测分析系统,向着小型化、便携化发展。另外一个趋势就是基于微流控技术的高通量材料合成、表征和检测的一体化平台建设,以扩展微流控芯片的应用范围。这种综合性平台的建设显示了微流控芯片的多样化和集成化,也是发展芯片实验室的必经之路。
(2017年2月15日收稿)■
[1] SKEGGS L T, Jr. An automatic method for colorimetric analysis [J]. American Journal of Clinical Pathology, 1957, 28: 311-322.
[2] TERRY S C, JERMAN J H, ANGELL J B. A gas chromatographic air analyzer fabricated on a silicon wafer [J]. IEEE Transactions on Electron Devices, 1979, ED-26: 1880-1886.
[3] JED HARRISON A M D, MANZ A, FAN Z, et al. Capillary electrophoresis and sample injection systems integrated on a planar glass chip [J]. Analytical Chemistry, 1992, 64: 1926-1932.
[4] MANZ A, FETTINGER J C, VERPOORTE E, et al. Micromachining of monocrystalline silicon and glass for chemical analysis systems—A look into next century’s technology or just a fashionable craze?[J]. Trends in Analytical Chemistry, 1991, 10: 144-149.
[5] THORSEN T, MAERKL S J, QUAKE S R. Microfluidic large-scaleintegration [J]. Science, 2002, 298: 580-584.
[6] 瞿祥猛, 林荣生, 陈宏. 基于微流控芯片的微阵列分析 [J]. 化学进展, 2011, 23(1): 221-230.
[7] DUNCANSON W J, LIN T, ABATE A R, et al. Microfluidic synthesis of advanced microparticles for encapsulation and controlled release [J]. Lab on a Chip, 2012, 12: 2135-2145.
[8] PREGIBON D C, TONER M, DOYLE P S. Multifunctional encoded particles for high-throughput biomolecule analysis [J]. Science, 2007, 315: 1393-1396.
[9] YAO S, SHU Y, YANG Y J, et al. Picoliter droplets developed as microreactors for ultrafast synthesis of multi-color water-soluble CdTe quantum dots [J]. Chemical Communications, 2013, 49: 7114-7116.
[10] ZHOU J, ZENG J, GRANT J, et al. On-chip screening of experimental conditions for the synthesis of noble-metal nanostructures with different morphologies [J]. Small, 2011, 7: 3308-3316.
[11] SONG H, CHEN D L, ISMAGILOV R F. Reactions in droplets in microflulidic channels [J]. Angewandte Chemie-International Edition, 2006, 45: 7336-7356.
[12] SONG H, TICE J D, ISMAGILOV R F. A microfluidic system for controlling reaction [J]. Angew Chem, 2003, 115: 792-796.
[13] MANZ A, HARRISON D J, VERPOORTE E M J, et al. Planar chips technology for miniaturization and integration of separation techniques into monitoring systems: Capillary electrophoresis on a chip [J]. Journal of Chromatography A, 1992, 593: 253-258.
[14] CEDERQUIST K B, DEAN S L, KEATING C D. Encoded anisotropic particles for multiplexed bioanalysis [J]. Wiley Interdisciplinary Reviews-Nanomedicine and Nanobiotechnology, 2010, 2: 578-600.
[15] CHUNG C K, SHIH T R, CHANG C K, et al. Design and experiments of a short-mixing-length baffled microreactor and its application to microfluidic synthesis of nanoparticles [J]. Chemical Engineering Journal, 2011, 168: 790-798.
[16] DENDUKURI D, PREGIBON D C, COLLINS J, et al. Continuousflow lithography for high-throughput microparticle synthesis [J]. Nature Materials, 2006, 5: 365-369.
[17] MARQUIS M, DAVY J, CATHALA B, et al. Microfluidics assisted generation of innovative polysaccharide hydrogel microparticles [J]. Carbohydrate Polymers, 2015, 116: 189-199.
[18] AKETAGAWA K, HIRAMA H, MORIGUCHI H, et al. Hyperminiaturization of monodisperse alginate-TiO2composite particles with densely packed TiO2nanoparticles [J]. Microfluidics and Nanofluidics, 2014, 17: 217-224.
[19] BAAH D, FLOYD-SMITH T. Microfluidics for particle synthesis from photocrosslinkable materials [J]. Microfluidics and Nanofluidics, 2014, 17: 431-455.
[20] FENG X, YI Y, YU X, et al. Generation of water-ionic liquid droplet pairs in soybean oil on microfluidic chip [J]. Lab on a Chip, 2010, 10: 313-319.
[21] DATTA S S, ABBASPOURRAD A, AMSTAD E, et al. 25th anniversary article: Double emulsion templated solid microcapsules: mechanics and controlled release [J]. Advanced Materials, 2014, 26: 2205-2218.
[22] HUNG L H, TEH S Y, JESTER J, et al. PLGA micro/nanosphere synthesis by droplet microfluidic solvent evaporation and extraction approaches [J]. Lab on a Chip, 2010, 10: 1820-1825.
[23] LEE K G, HONG J, WANG K W, et al. In Vitro Biosynthesis of Metal Nanoparticles in Microdroplets [J]. Acs Nano, 2012, 6: 6998-7008.
[24] NURUMBETOV G, BALLARD N, BON S A F. A simple microfluidic device for fabrication of double emulsion droplets and polymer microcapsules [J]. Polymer Chemistry, 2012, 3: 1043-1047.
[25] FAUSTINI M, KIM J, JEONG G Y, et al. Microfluidic approach toward continuous and ultrafast synthesis of metal-organic framework crystals and hetero structures in confined microdroplets [J]. Journal of the American Chemical Society, 2013, 135: 14619-14626.
[26] TAKIMOTO K, TAKANO E, KITAYAMA Y, et al. Synthesis of monodispersed submillimeter-sized molecularly imprinted particles selective for human serum albumin using inverse suspension polymerization in water-in-oil emulsion prepared using microfluidics [J]. Langmuir, 2015, 31: 4981-4987.
[27] YU X, CHENG G, ZHOU M D, et al. On-demand one-step synthesis of monodisperse functional polymeric microspheres with droplet microfluidics [J]. Langmuir, 2015, 31: 3982-3992.
[28] LEE D, BEESABATHUNI S N, SHEN A Q. Shape-tunable wax microparticle synthesis via microfluidics and droplet impact [J]. Biomicrofluidics, 2015, 9: 064114.
[29] DE FILPO G, LANZO J, NICOLETTA F P, et al. Monomer-liquid crystal emulsions for switchable films [J]. Journal of Applied Physics, 1998, 84: 3581-3585.
[30] KOBAYASHI I, LOU X F, MUKATAKA S, et al. Preparation of monodisperse water-in-oil-in-water emulsions using microfluidization and straight-through microchannel emulsification [J]. Journal of the American Oil Chemists Society, 2005, 82: 65-71.
[31] KOBAYASHI I, LOU X, MUKATAKA S, et al. Preparation of monodisperse water-in-oil-in-water emulsions using microfluidization and straight-through microchannel emulsification [J]. Journal of the American Oil Chemists Society, 2005, 82(1): 65-71.
[32] HOSOKAWA K, FUJII T, ENDO I. Handling of picoliter liquid samples in a poly(dimethylsiloxane)-based microfluidic device [J]. Analytical Chemistry, 1999, 71: 4781-4785.
[33] ANNA S L, BONTOUX N, STONE H A. Formation of dispersions using “flow focusing” in microchannels [J]. Applied Physics Letters, 2003, 82: 364-366.
[34] LIU H J, NAKAJIMA M, KIMURA T. Production of monodispersed water-in-oil emulsions using polymer microchannels [J]. Journal of the American Oil Chemists Society, 2004, 81: 705-711.
[35] OKUSHIMA S, NISISAKO T, TORII T, et al. Controlled production of monodisperse double emulsions by two-step droplet breakup in microfluidic devices [J]. Langmuir, 2004, 20: 9905-9908.
[36] GARSTECKI P, GITLIN I, DILUZIO W, et al. Formation of monodisperse bubbles in a microfluidic flow-focusing device [J]. Applied Physics Letters, 2004, 85: 2649-2651.
[37] GARSTECKI P, STONE H A, WHITESIDES G M. Mechanism for flow-rate controlled breakup in confined geometries: a route to monodisperse emulsions [J]. Physical Review Letters, 2005, 94 (16): 164501.
[38] GORDILLO J M, CHENG Z D, GANAN-CALVO A M, et al. A new device for the generation of microbubbles [J]. Physics of Fluids, 2004, 16: 2828-2834.
[39] GARSTECKI P, FUERSTMAN M J, STONE H A, et al. Formation of droplets and bubbles in a microfluidic T-junction - scaling and mechanism of break-up [J]. Lab on a Chip, 2006, 6: 437-446.
[40] WAGNER J, KIRNER T, MAYER G, et al. Generation of metal nanoparticles in a microchannel reactor [J]. Chemical Engineering Journal, 2004, 101: 251-260.
[41] WAGNER J, KOHLER J M. Continuous synthesis of gold nanoparticles in a microreactor [J]. Nano Letters, 2005, 5: 685-691.
[42] KOHLER J M, WAGNER J, ALBERT J. Formation of isolated and clustered Au nanoparticles in the presence of polyelectrolyte molecules using a flow-through Si chip reactor [J]. Journal of Materials Chemistry, 2005, 15: 1924-1930.
[43] BOLEININGER J, KURZ A, REUSS V, et al. Microfluidic continuous flow synthesis of rod-shaped gold and silver nanocrystals [J]. Physical Chemistry Chemical Physics, 2006, 8: 3824-3827.
[44] LAZARUS L L, RICHE C T, MARIN B C, et al. Two-phase microfluidic droplet flows of ionic liquids for the synthesis of gold and silver nanoparticles [J]. Acs Applied Materials & Interfaces, 2012, 4: 3077-3083.
[45] NAVIN C V, KRISHNA K S, THEEGALA C S, et al. Lab-on-a-chip devices for gold nanoparticle synthesis and their role as a catalyst support for continuous flow catalysis [J]. Nanotechnology Reviews, 2014, 3: 39-63.
[46] SADABADI H, BADILESCU S, PACKIRISAMY M, et al. Integration of gold nanoparticles in PDMS microfluidics for lab-ona-chip plasmonic biosensing of growth hormones [J]. Biosensors & Bioelectronics, 2013, 44: 77-84.
[47] THIELE M, KNAUER A, CSAKI A, et al. High-throughput synthesis of uniform silver seed particles by a continuous microfluidic synthesis platform [J]. Chemical Engineering & Technology, 2015, 38: 1131-1137.
[48] LIU H Y, HUANG J L, SUN D H, et al. Microfluidic biosynthesis of silver nanoparticles: effect of process parameters on size distribution [J]. Chemical Engineering Journal, 2012, 209: 568-576.
[49] XU L, PENG J H, YAN M, et al. Droplet synthesis of silver nanoparticles by a microfluidic device [J]. Chemical Engineering and Processing, 2016, 102: 186-193.
[50] SONG Y, KUMAR C S S R, HORMES J. Synthesis of palladium nanoparticles using a continuous flow polymeric micro reactor [J]. Journal of Nanoscience and Nanotechnology, 2004, 4: 788-793.
[51] SONG Y J, DOOMES E E, PRINDLE J, et al. Investigations into sulfobetaine-stabilized Cu nanoparticle formation: toward development of a microfluidic synthesis [J]. Journal of Physical Chemistry B, 2005, 109: 9330-9338.
[52] CHOI C S, JO Y H, KIM M G, et al. Control of chemical kinetics for sub-10 nm Cu nanoparticles to fabricate highly conductive ink below 150 degrees C [J]. Nanotechnology, 2012, 23(6): 065601.
[53] LI G, LI X H, ZHANG Z J. Preparation methods of copper nanomaterials [J]. Progress in Chemistry, 2011, 23: 1644-1656.
[54] RUFUS S N A, PHILIP D. Microwave-assisted rapid synthesis of copper nanoparticles with exceptional stability and their multifaceted applications [J]. Journal of Molecular Liquids, 2016, 221: 1008-1021.
[55] SONG Y J, LI R S, SUN Q Q, et al. Controlled growth of Cu nanoparticles by a tubular microfluidic reactor [J]. Chemical Engineering Journal, 2011,168: 477-484.
[56] WEN Y L, HUANG W, WANG B, et al. Synthesis of Cu nanoparticles for large-scale preparation [J]. Materials Science and Engineering B-Advanced Functional Solid-State Materials, 2012, 177: 619-624.
[57] XU L, PENG J H, SRINIVASAKANNAN C, et al. Synthesis of copper nanocolloids using a continuous flow based microreactor [J]. Applied Surface Science, 2015, 355: 1-6.
[58] XU L, PENG J H, SRINIVASAKANNAN C, et al. Synthesis of copper nanoparticles by a T-shaped microfluidic device [J]. RSC Advances, 2014, 4: 25155-25159.
[59] YOKOYAMA S, TAKAHASHI H, ITOH T, et al. Surface modification of Cu metal particles by the chemical reaction between the surface oxide layer and a halogen surfactant [J]. Journal of Physics and Chemistry of Solids, 2014, 75: 68-73.
[60] CABRERA F C, MELO A, DE SOUZA J C P, et al. A flexible lab-ona-chip for the synthesis and magnetic separation of magnetite decorated with gold nanoparticles [J]. Lab on a Chip, 2015, 15: 1835-1841.
[61] COTTAM B F, KRISHNADASAN S, DEMELLO A J, et al. Accelerated synthesis of titanium oxide nanostructures using microfluidic chips [J]. Lab on a Chip, 2007, 7: 167-169.
[62] SHIBA K, OGAWA M. Microfluidic syntheses of well-defined sub-micron nanoporous titania spherical particles [J]. Chemical Communications, 2009: 6851-6853. doi: 10.1039/b914322j.
[63] SHIBA K, OGAWA M. Syntheses of zirconium-containing titania particles with spherical morphology and uniform size by microfluidic reactions [J]. Journal of the Ceramic Society of Japan, 2011, 119: 507-512.
[64] ZHOU J H, JIANG H, XU J, et al. Ultrafast synthesis of LTA nanozeolite using a two-phase segmented fluidic microreactor [J]. Journal of Nanoscience and Nanotechnology, 2013, 13: 5736-5743.
[65] EDEL J B, FORTT R, DEMELLO J C, et al. Microfluidic routes to the controlled production of nanoparticles [J]. Chemical Communications, 2002: 1136-1137. doi: 10.1039/b202998g.
[66] DAI J, YANG X Y, HAMON M, et al. Particle size controlled synthesis of CdS nanoparticles on a microfluidic chip [J]. Chemical Engineering Journal, 2015, 280: 385-390.
[67] SHU Y, JIANG P, PANG D W, et al. Droplet-based microreactor for synthesis of water-soluble Ag2S quantum dots [J]. Nanotechnology, 2015, 26: 275701.
[68] AKETAGAWA K, HIRAMA H, MORIGUCHI H, et al. Hyperminiaturization of monodisperse alginate–TiO2composite particles with densely packed TiO2nanoparticles [J]. Microfluidics and Nanofluidics, 2013, 17: 217-224.
[69] NISISAKO T, TORII T, HIGUCHI T. Droplet formation in a microchannel network [J]. Lab Chip, 2002, 2: 24-26.
[70] GUNTHER A, JENSEN K F. Multiphase microfluidics: from flow characteristics to chemical and materials synthesis [J]. Lab on a Chip, 2006, 6: 1487-1503.
[71] 郭梦园, 李风华, 包宇, 等. 微流控技术在纳米合成中的应用[J]. 应用化学, 2016, 33(10): 1115-1125.
[72] TAN H Y, LOKE W K, TAN Y T, et al. A lab-on-a-chip for detection of nerve agent sarin in blood [J]. Lab on a Chip, 2008, 8: 885-891.
[73] DITTRICH P S, MANZ A. Lab-on-a-chip: microfluidics in drug discovery [J]. Nature Reviews Drug Discovery, 2006, 5: 210-218.
[74] MA B, ZHANG G, QIN J, et al. Characterization of drug metabolites and cytotoxicity assay simultaneously using an integrated microfluidic device [J]. Lab on a Chip, 2009, 9: 232-238.
[75] 金帆, 张荣荣, 夏爱国. 胞外聚合物性质与功能的原位表征[C]//2015年全国高分子学术论文报告会. 江苏苏州, 2015: DI-07.
[76] ZGURIS J C, ITLE L J, HAYES D, et al. Microreactor microfluidic systems with human microsomes and hepatocytes for use in metabolite studies [J]. Biomedical Microdevices, 2005, 7: 117-125.
[77] YOO S K, LEE J H, YUN S S, et al. Fabrication of a bio-MEMS based cell-chip for toxicity monitoring [J]. Biosensors & Bioelectronics, 2007, 22: 1586-1592.
[78] LEE P J, HUNG P J, LEE L P. An artificial liver sinusoid with a microfluidic endothelial-like barrier for primary hepatocyte culture [J]. Biotechnology and Bioengineering, 2007, 97: 1340-1346.
[79] BAUDOIN R, CORLU A, GRISCOM L, et al. Trends in the development of microfluidic cell biochips for in vitro hepatotoxicity [J]. Toxicology in Vitro, 2007, 21: 535-544.
(编辑:沈美芳)
High-throughput microfluidic platform for material synthesis, characterization and testing
LIN Yinyin, WU Jinbo
Materials Genome Institute, Shanghai University, Shanghai 200444
With the development of microfluidic technology and the limitations of traditional experimental methods, it is urgent that microfluidic technology can replace traditional bench-top processes including mixing, reaction extraction, isolation, characterization, detection and so on. We hope that all of these processes can be miniaturized into one chip. Microfluidic experimental method significantly improves the reaction efficiency and increase the yield. Furthermore, it not only realizes the high-throughput materials synthesis, characterization and testing, but also facilitates the development of the integrated, miniaturized, automated and portable platforms.
microfluidics, synthesis, characterization, testing, high-throughput
10.3969/j.issn.0253-9608.2017.02.004
†通信作者,E-mail: jinbowu@t.shu.edu.cn

