水飞蓟果托总黄酮的纯化工艺及其对油脂的抗氧化研究
任明婧,查恩辉,孙 晶
(锦州医科大学食品科学与工程学院,辽宁 锦州 121001)
水飞蓟果托总黄酮的纯化工艺及其对油脂的抗氧化研究
任明婧,查恩辉,孙 晶
(锦州医科大学食品科学与工程学院,辽宁 锦州 121001)
通过大孔树脂吸附率与解吸率的测定,筛选适合对水飞蓟果托总黄酮进行纯化的最佳树脂类型;通过研究不同因素对树脂吸附和解析效果的影响,确定水飞蓟果托总黄酮的纯化工艺,并研究其对油脂的抗氧化作用。研究结果表明,AB-8型大孔树脂最适合水飞蓟果托中总黄酮的纯化,吸附平衡时间为4 h,解析平衡时间为3 h;在水飞蓟果托总黄酮质量浓度3.98 mg/ml,pH5.5,吸附温度50℃,解吸温度60℃,用体积分数70%的乙醇进行解析时,果托总黄酮的纯化效果较好。在上述条件下制得的果托总黄酮产品为黄色粉末,回收率为82.04%,纯度为68.07%。油脂抗氧化试验结果表明,添加2 mg水飞蓟果托总黄酮比添加2 mg维生素C抗氧化效果明显。
水飞蓟果托;黄酮;纯化;抗氧化
水飞蓟是一种菊科药用植物,原产于北非,上世纪七十年代引入我国后被广泛推广种植[1]。水飞蓟果实中的水飞蓟素,属于黄酮类物质,具有抗肝中毒、抗肿瘤、降血脂等活性,以水飞蓟素为主要成分的药剂已在临床用于治疗肝炎和胆囊炎等疾病[2-4]。德国首先开发出水飞蓟素提取物作为治疗肝炎的药物(Legalon),近年我国也已开发出相关药物,其中水飞蓟素制剂——益肝灵片已在临床上广泛使用[5-6]。水飞蓟果实还可用于生产水飞蓟油和水飞蓟蛋白等产品,而果托作为主要的副产物,其利用情况目前鲜有报道。水飞蓟果托的研究与利用,可使其变废为宝,增加水飞蓟及相关产品的附加值。
目前国内外对于水飞蓟种子中水飞蓟素等活性物质的利用方面的研究较多[7-8],有关水飞蓟植株中活性物质的研究仅国外有少量报道,并且主要是对根、茎、叶等部位的研究[9-12]。课题组前期研究结果表明,水飞蓟果托中总黄酮含量高于根、茎、叶等部位[13]。本试验在前期研究的基础上,对水飞蓟果托总黄酮的纯化工艺及其对油脂的抗氧化活性进行研究,国内外均未见报道。
以水飞蓟果托为原料,首先确定果托总黄酮纯化的最佳树脂,然后通过分析各因素对吸附和解吸效果的影响,确定总黄酮纯化工艺条件,最后对其油脂抗氧化活性进行研究,以期为水飞蓟果托总黄酮的利用及活性研究奠定基础。
1 材料与方法
1.1 材料与试剂
水飞蓟果托,盘锦天源药业集团提供,采收于2015-07,26~28℃条件下阴干,于密闭塑料袋中-17℃冷藏保存;大豆油和猪油均为市售。
亚硝酸钠、硫代硫酸钠、无水乙醇、硝酸铝、氢氧化钠等试剂,均为分析纯。
1.2 仪器
DHG-9140型电热恒温鼓风干燥箱,高速万能粉碎机,KQ-3200B型超声波清洗器,UV-6300型紫外分光光度计,循环水式真空泵,R-501型旋转蒸发仪,SHA-BA型数显恒温水浴振荡器。
1.3 水飞蓟果托中总黄酮提取液的制备
将干燥的水飞蓟果托打碎成粉末,过60目筛,称取一定量的水飞蓟果托粉末于锥形瓶中,在温度55℃、液料比30∶1、乙醇体积分数60%、提取时间100 min后抽滤,浓缩到无乙醇味道,置于50℃真空箱内进行干燥,并将干燥品按要求稀释成一定浓度的样液,待用[13]。
1.4 树脂的预处理
首先将7种大孔树脂分别用无水乙醇浸泡24 h,使其充分溶胀,然后用无水乙醇进行淋洗,直至洗出液加水不产生白色浑浊现象,再用去离子水洗去残留乙醇,最后吸干树脂中的水分残留[14]。
1.5 指标测定与方法
1.5.1 水飞蓟果托总黄酮含量的测定
水飞蓟果托总黄酮含量的测定采用NaNO2-Al(NO3)3-NaOH比色法。以吸光度(y)为纵坐标,质量浓度(x)为横坐标,绘制标准曲线,得线性回归方程y=8.748 6x+0.006 1,R2=0.999 1。根据回归方程计算样品中总黄酮浓度[13]。
1.5.2 树脂的吸附率和解吸率的测定
精确称取预处理后大孔树脂2 g,置于锥形瓶中,加入浓度为1.17 mg/ml的果托总黄酮溶液,置于振荡器中振荡24 h(30℃,110 r/min),测定黄酮溶液的浓度;洗去饱和树脂表面残留黄酮,吸干水分,加入体积分数60%的乙醇溶液,振荡24 h(30℃,110 r/min),使之充分解吸后过滤,测定滤液总黄酮浓度,通过下式计算吸附率和解析率[14]。




式中,α为吸附率,%;C0为黄酮溶液初始浓度,mg/ml;C1为吸附平衡后黄酮溶液浓度,mg/ml;Qa为吸附量,mg/g;Va为黄酮溶液体积,ml;W为树脂质量,g;Qd为解析量,mg/g;Cd为解析液浓度,mg/ml;Vd为解析液体积,ml;β为解析率,%。
1.5.3 水飞蓟果托总黄酮在大孔树脂上吸附平衡时间测定
称取预处理后的大孔树脂2g,置于锥形瓶中,加入60ml果托总黄酮溶液,将锥形瓶放入振荡器中(30℃,110r/min),每隔0.5h测定一次吸附量。
1.5.4 水飞蓟果托总黄酮在大孔树脂上解吸平衡时间测定
称取吸附水飞蓟果托总黄酮溶液的饱和树脂2g,置于锥形瓶中,加入25ml体积分数60%的乙醇溶液,将锥形瓶放入振荡器中(30℃,110r/min),每隔0.5h测定一次解吸率。
1.5.5 水飞蓟果托总黄酮回收率和纯度测定
将一定浓度的水飞蓟果托总黄酮溶液按照得到的纯化工艺条件进行吸附和解吸处理,收集洗脱液并测量其总黄酮浓度,然后将洗脱液浓缩干燥后称重,通过下述公式计算后可得果托总黄酮纯度与回收率[14]。
纯度=(X×V)/G×100%,

1.6 各因素对大孔树脂吸附或解析的影响
1.6.1 水飞蓟果托总黄酮浓度对大孔树脂吸附效果的影响
精确称取预处理后的大孔树脂若干份,每份2 g,置于锥形瓶中,加入pH5.5的果托总黄酮溶液各60 ml,浓度分别为1.14、2.05、3.98、6.17、8.45、10.43 mg/ml,将锥形瓶放入振荡器中(30℃,110 r/min,4 h),待吸附平衡后测定浓度,计算吸附率和吸附量。
1.6.2 水飞蓟果托总黄酮溶液pH值对大孔树脂吸附效果的影响
将浓度为3.98 mg/ml的果托总黄酮用缓冲溶液配置成pH值依次为4.5、5、5.5、6、6.5和7的六种溶液,取60 ml配置后的黄酮溶液放入盛有2 g树脂的锥形瓶中,振荡(30℃,110 r/min,4 h),计算吸附率。
1.6.3 乙醇浓度对大孔树脂解吸量的影响
取吸附水飞蓟果托总黄酮粗提液的饱和树脂2 g若干份,分别加入25 ml体积分数为50%、60%、70%、80%、90%的乙醇溶液,将锥形瓶放入振荡器中(30℃,110 r/min,1.5 h),测定洗脱液中果托总黄酮浓度,计算解吸量。
1.6.4 温度对大孔树脂吸附和解吸效果的影响
配制浓度为3.98 mg/ml,pH5.5的果托总黄酮粗提液,取60 ml放入锥形瓶中,加入预处理后的树脂2 g,不同温度条件下振荡(110 r/min,4 h),计算总黄酮吸附量;分别称取吸附果托总黄酮的饱和树脂2 g,加入25 ml体积分数60%的乙醇溶液,不同温度条件振荡(110 r/min,1.5 h),计算解吸量。
1.7 果托总黄酮对油脂的抗氧化试验
分别称取纯化后的果托总黄酮粉末1.0、1.5、2.0 mg,并称取2 mg维生素C作为阳性对照,用1 ml无水乙醇溶解后放入盛有50 ml大豆油或30 g猪油的三角瓶中,摇匀;另取一个三角瓶,只加入50 ml大豆油或30 g猪油作为空白对照。将所有试样放入振荡器中,60℃条件下恒温振荡,每隔一定时间取样测定其过氧化值[15]。
2 结果与分析
2.1 大孔树脂对水飞蓟果托总黄酮吸附和解吸特性比较
从表1可知,弱极性的AB-8、D-130以及极性的S-8对水飞蓟果托总黄酮的吸附量较大,极性的NKA-9因比表面积过小,吸附量较小,因为树脂比表面积的大小,预示着吸附量的大小。X-5和HPD-100虽然是非极性树脂,但由于比表面积大,具有一定的吸附能力,同时解析率也大,其中,S-8的解析率处于最低。
因此,通过对不同类型的树脂性能进行比较,初步选择AB-8,D-130,X-5,HPD-100进行静态吸附和解析动力学研究。
2.2 水飞蓟果托总黄酮在大孔树脂上的静态吸附动力学曲线
由图1可知,0~4 h内,AB-8大孔树脂的吸附量随着吸附时间的延长而急剧增加,5 h后吸附接近饱和;HPD-100在前3 h的吸附量均低于其他三种,3 h后与X-5和D-130吸附量相接近,但都低于AB-8大孔树脂。

表1 不同大孔树脂对水飞蓟果托总黄酮的 静态吸附率和解吸率的比较

图1 水飞蓟果托总黄酮在大孔树脂上
静态吸附动力学曲线图
2.3 水飞蓟果托总黄酮在大孔树脂上的静态解吸动力学曲线
由图2可知,在静态解吸过程中的前2 h内,AB-8树脂的解吸率急剧上升,在2~3 h解吸率增长缓慢,解吸3 h达到峰值,之后基本保持不变。AB-8的解吸率可达到76%,且一直保持最大,而D-130,X-5的解吸率较小。

图2 水飞蓟果托总黄酮在大孔树脂上的 静态解吸动力学曲线图
综合考虑大孔树脂对总黄酮的吸附量和解析率的影响,上述四种树脂中,AB-8型大孔树脂是最适合分离纯化水飞蓟果托总黄酮类物质的树脂。
2.4 水飞蓟果托总黄酮浓度对AB-8大孔树脂吸附的影响
水飞蓟果托总黄酮浓度对AB-8大孔树脂吸附效果的影响如图3所示。随着浓度的增大,AB-8大孔树脂对水飞蓟果托中总黄酮的吸附率降低,而吸附量的变化与之相反。当溶液浓度大于8.45 mg/ml时,吸附量基本不再变化,说明当溶液浓度为8.45 mg/ml时,总黄酮吸附量已接近饱和。当溶液浓度为3.98 mg/ml时,总黄酮吸附率较高,吸附量增加率最大,从节约总黄酮溶液和树脂两方面考虑,选择总黄酮最适吸附浓度为3.98 mg/ml。

图3 水飞蓟果托总黄酮浓度对AB-8大孔树脂 吸附效果的影响
2.5 水飞蓟果托黄酮溶液的pH值对AB-8大孔树脂吸附效果的影响
如图4所示,AB-8型树脂对水飞蓟果托粗提液总黄酮的吸附能力受pH值的影响较大。在弱酸条件下,黄酮类化合物以分子状态存在,可通过范德华力吸附在树脂上,因此吸附率较高[14]。当pH值在4.5~7内时,AB-8型树脂对水飞蓟果托粗提液总黄酮的吸附率呈先上升后下降的趋势,当pH值为5.5时,吸附率最大,所以确定5.5为上样液合适的pH值。
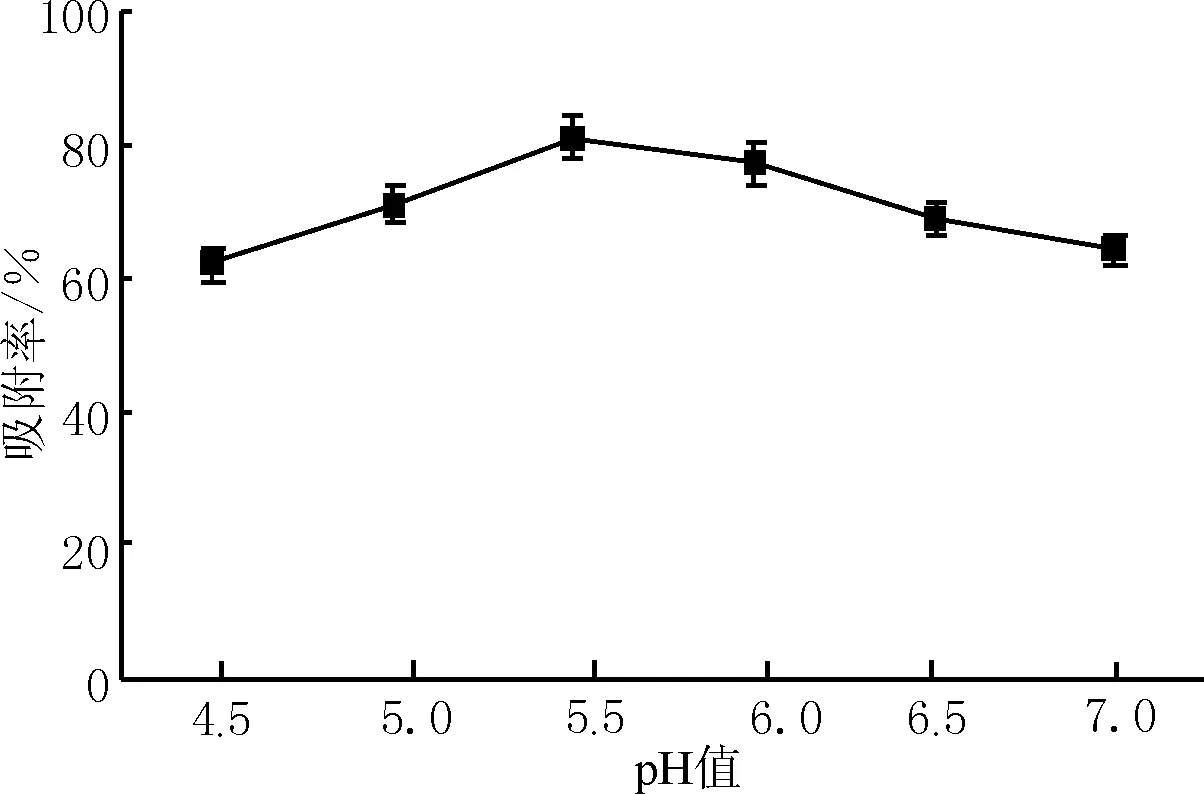
图4 上样液pH值对AB-8大孔树脂吸附效果的影响
2.6 乙醇体积分数对AB-8大孔树脂解吸效果的影响
如图5所示,在50%~70%内,随着乙醇浓度的增加,总黄酮解吸率逐渐增大;当乙醇体积分数达到70%时,解吸率最大;当乙醇体积分数超过70%后,解吸率略有下降。所以确定体积分数70%的乙醇溶液浓度为最佳的洗脱浓度。
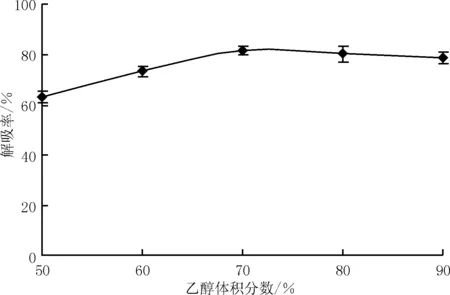
图5 乙醇体积分数对AB-8型树脂解吸效果的影响
2.7 温度对AB-8大孔树脂吸附和解吸的影响
从图6可以看出,在30~50℃内,果托总黄酮吸附量随温度升高而增加,当大于50℃时,随温度升高,果托总黄酮吸附量明显下降,因此,选择吸附温度为50℃。
在30~60℃内,随着温度的升高,果托总黄酮解吸量增加,60℃时到达峰值。当温度高于60℃时,解吸量开始下降,分析原因可能是温度较高时部分黄酮类物质发生分解,因此,选择解吸温度为60℃。
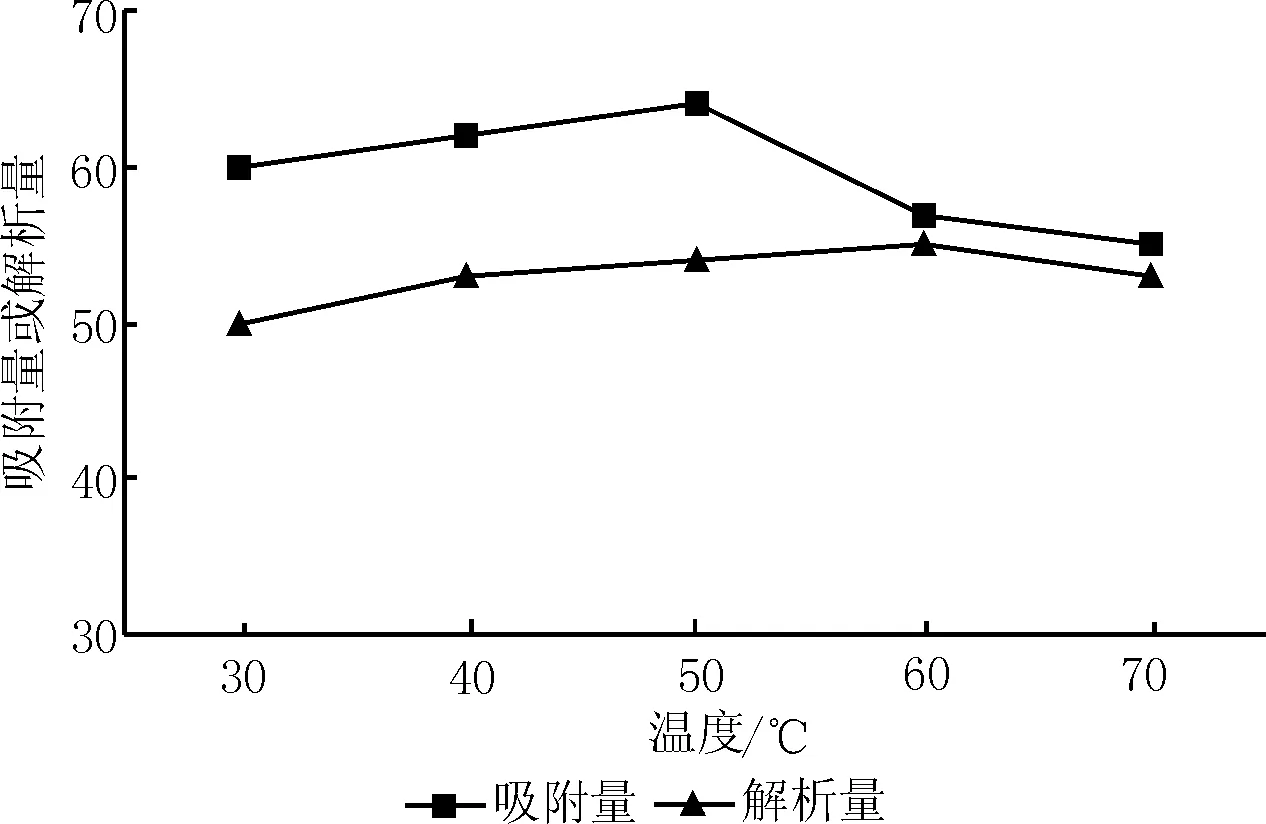
图6 温度对树脂吸附或解析的影响
2.8 水飞蓟果托总黄酮回收率和纯度的测定
在水飞蓟果托总黄酮浓度为3.98 mg/ml、pH5.5、乙醇体积分数70%、吸附温度50℃、解析温度60℃的条件对水飞蓟果托总黄酮进行纯化,纯化后的果托总黄酮为黄色粉末,经测定,果托总黄酮纯度为(68.07±1.40)%,回收率为(82.04±1.85)%。
2.9 水飞蓟果托总黄酮对油脂的抗氧化活性
2.9.1 水飞蓟果托总黄酮对大豆油的抗氧化活性
不同添加量的果托总黄酮与维生素C对大豆油的抗氧化效果比较结果如表2所示。
由表2可知,空白对照组POV值高于所有添加果托总黄酮试验组,说明果托总黄酮对大豆油具有一定的抗氧化效果。随着果托总黄酮添加量的增加,其对大豆油的抗氧化作用逐渐增大,而且大豆油保藏时间越长,抗氧化效果越明显。当果托总黄酮的添加量为2 mg时,其抗氧化效果比添加2 mg维生素C好,这说明水飞蓟果托总黄酮对大豆油具有明显的抗氧化作用。
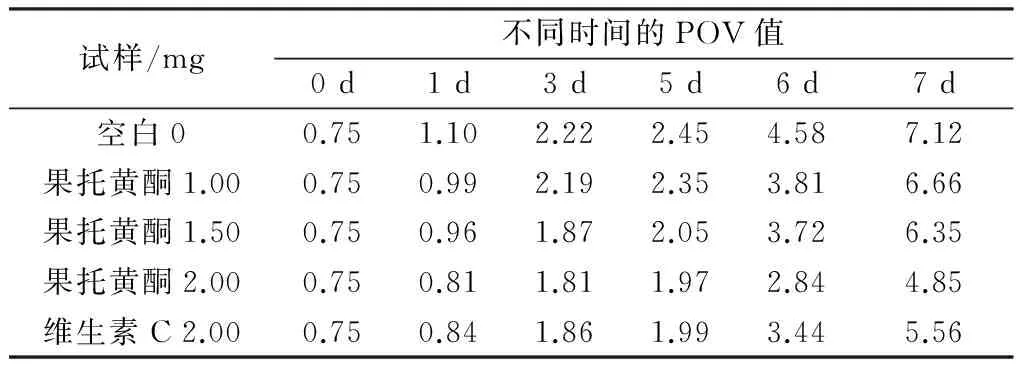
表2 不同添加量果托总黄酮与维生素C 对大豆油的抗氧化效果
2.9.2 水飞蓟果托总黄酮对猪油的抗氧化活性
不同添加量的果托总黄酮和维生素C对猪油的抗氧化效果比较见表3。
由表3可知,空白对照组POV值高于所有添加果托总黄酮试验组,在试验添加剂量范围内,果托总黄酮添加量与其对猪油的抗氧化效果成正比关系。当果托总黄酮添加量为2 mg时,比2 mg维生素C组对猪油的抗氧化效果好,说明果托总黄酮对猪油的抗氧化作用明显。
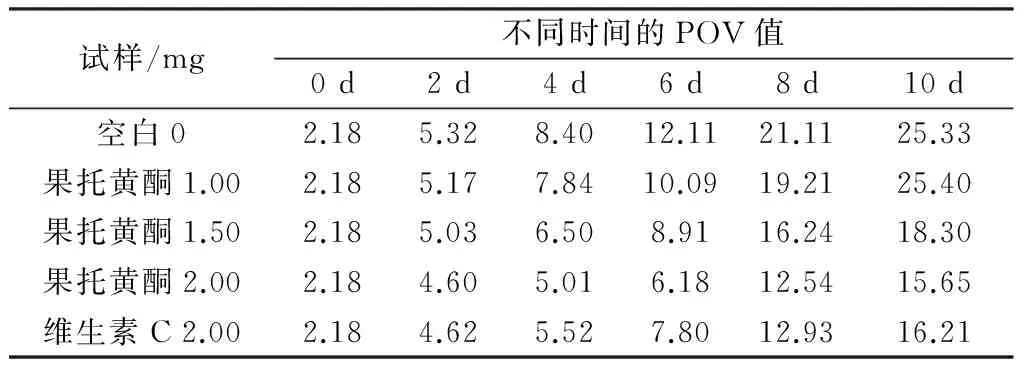
表3 不同添加量果托总黄酮与维生素C 对猪油的抗氧化效果
3 结论
静态吸附和解吸试验结果表明,在7种试验树脂中,AB-8大孔树脂吸附率大,解吸率高,对水飞蓟果托总黄酮的吸附平衡时间为4 h,解吸平衡时间为3 h,是适合对水飞蓟果托总黄酮进行纯化的理想树脂。
当水飞蓟果托总黄酮浓度为3.98 mg/ml,pH5.5,吸附温度为50℃时,AB-8大孔树脂对水飞蓟果托总黄酮的吸附效果较好。
用体积分数70%的乙醇溶液作为解吸液,解吸温度为60℃时,水飞蓟果托总黄酮的解析效果较好。
经纯化后得到的水飞蓟果托总黄酮为黄色粉末,回收率为(82.04±1.85)%,纯度为(68.07±1.40)%。
油脂抗氧化试验结果表明,水飞蓟果托总黄酮对大豆油和猪油均具有较好的抗氧化效果,添加2 mg水飞蓟果托总黄酮比添加2 mg维生素C对油脂的抗氧化效果明显。
[1] 余传隆,黄泰康,丁志遵,等.中药辞海(第一卷)[M]. 北京:中国医药科技出社,1993:963-964.
[2] 李 谈,杜 勇,张小茜. 水飞蓟质量标准的研究[J]. 中国中药杂志, 2006,31(2):165-167.
[3] 闰玉峰,于健东. 水飞蓟的化学成分及药理研究进展[J]. 中国药事, 2000, 14(5):335-337.
[4] 朱 铱,郑哲沫,崔京浩.水飞蓟素及其制剂的研究进展[J].中国野生植物资源, 2002 (3):47-49.
[5] 常国彬,李季平.水飞蓟及其药用有效成分研究[J].辽宁师专学报,2004,6(1):24-25.
[6] 杨 晋,刘雅敏,刘延泽.水飞蓟素药学研究进展[J].人然产物研究与开发,2004,16(2):185-187.
[7] 郑巨约.水飞蓟中有效成分的分离制备及其抗氧化活性[D] .杭州:浙江工商大学,2009.
[8] 刘 宏.水飞蓟种子活性成分的提取、分离及初步活性研究[D] .北京:北京化工大学,2009.
[9] OMAR A A, HADAD G M, BADR J M. First detailed quantification of silymarin components in the leaves ofSilybummarianumL. cultivated in Egypt during different growth stages[J].Acta Chromatographica, 2012,24 (3):463-474.
[10] AHMAD N, FAZAL H, ABBASI B H.Evaluation of antioxidant activity and its association with plant development inSilybummarianumL. [J]. Industrial Crops and Products, 2013 (49):164-168.
[11] AHMAD N, FAZAL H, ABBASI B H, et al. DPPH free radical scavenging activity and phenotypic difference in hepatoprotective plant(SilybummarianumL.) [J]. Toxicology and Industrial Health, 2012,29 (5):460-467.
[12] BANNA H, RAMADAN S, SHALABY M, et al. Hepatoprotective and antioxidant effects of silybum marianum plant in rats[J]. International Journal for Agro Veterinary and Medical Sciences, 2011,5(6): 541-547.
[13] 孙 晶,狄 蕊,尚美秀. 超声波辅助提取水飞蓟全草中总黄酮的工艺优化[J].食品工业科技,2014, 24:239-242.
[14] 李颖畅, 孟宪军, 李小红.大孔树脂纯化蓝莓叶总黄酮的工艺研究[J]. 食品与发酵工业, 2008, 34(1):133-137.
[15] 尹学琼,陈俊华,刘 芳,等.柠檬香茅精油的提取及抗氧化活性[J]. 精细化工,2012,29(6):568-571.
(责任编辑:赵琳琳)
Purification process of total flavonoids from milk thistle fruit receptacles and its lipid-antioxidant activity
REN Ming-jing,CHA En-hui,SUN Jing
(College of Food Science and Enginering,Jinzhou Medical Univesity,Jinzhou 121001, China)
The best resin for purification of total flavonoids from milk thistle fruit receptacles were confirmed by determing adsorption rate and desorption rate of resin. The purification process of total flavonoids from milk thistle fruit receptacles were also studied by testing the influence of different factors on resin adsorption and desorption effects. AB-8 macroporous resin was confirmed to be suitable resin. The result indicated that appropriate purification parameters of flavonoids from milk thistle fruit receptacles with AB-8 macroporous resin were adsorption equilibrium time of 4 h, resolution equilibrium time of 3 h, total flavonoids mass concentration of 3.98 mg/ml, pH5.5, 70%(v/v) ethanol solution, adsorption temperature 30℃, desorption temperature 60℃. The total flavonoids produced by this proeess was yellow powder, reovery rate was 82.04%, the purity of flavonoids was 68.07%.The oil oxidation resistance test showed that the antioxidant activity of 2 mg flavonoids from milk thistle fruit receptacles was higher than that of vitamin C of 2 mg.
milk thistle fruit receptacles; flavonoids; purification;antioxidant activity
2016-10-20;
2017-03-20
辽宁省农业领域青年科技创新人才培养计划(项目编号:2014037);辽宁省大学生创新创业训练计划(项目编号:201510160000056)。
任明婧(1996-),女,本科,专业为食品科学与工程。
孙 晶(1982-),女,硕士,讲师,专业为食品科学。
10.7633/j.issn.1003-6202.2017.04.008
TS202.3;S567.9
A
1003-6202(2017)04-0030-05

