几种发酵饲料对高纤维日粮后备牛的生长性能、抗氧化功能和免疫状态的影响
乔国华,李桂杰,肖志刚,徐彩红,解铁民
(沈阳师范大学粮食学院,辽宁 沈阳 110034)
几种发酵饲料对高纤维日粮后备牛的生长性能、抗氧化功能和免疫状态的影响
乔国华,李桂杰,肖志刚,徐彩红,解铁民
(沈阳师范大学粮食学院,辽宁 沈阳 110034)
使用2个试验研究了几种发酵饲料,耐盐短杆菌、啤酒酵母和白腐真菌对高纤维日粮营养物质消化率、后备牛生长性能、血液抗氧化功能和免疫状态的影响。试验分为4个处理组,即对照组、白腐真菌发酵饲料组、啤酒酵母发酵饲料组和耐盐短杆菌发酵饲料组。每头牛每天饲喂50 g发酵饲料,每种发酵饲料均含有活菌1×109CFU/g。试验1的结果表明,这3种发酵饲料对后备牛的干物质采食量没有显著影响,耐盐短杆菌发酵饲料提高了后备牛的平均日增重、末体重和饲料效率(P<0.05),基础日粮中添加耐盐短杆菌提高了日粮干物质和有机物质的消化率(P<0.05)。试验2的结果表明,耐盐短杆菌发酵饲料改善了后备牛血液抗氧化功能,超氧化物歧化酶浓度高于其它处理组(P<0.05),丙二醛浓度低于其它处理组(P<0.05)。同时,耐盐短杆菌发酵饲料降低了前列腺素浓度和细胞干扰素的浓度(P<0.05)。3种发酵饲料对后备牛白细胞介素-2、白细胞介素-4、白细胞介素-6和白细胞介素-10均没有影响(P>0.05),对后备牛免疫球蛋白M、免疫球蛋白A和免疫球蛋白G也没有影响(P>0.05)。
发酵饲料;生长性能;抗氧化功能;免疫;后备牛
饲养后备牛的一个重要目标是使用高纤维日粮在初次配种或者产犊时获得较高的体重。在试验生产中曾经使用抗生素(莫能菌素等)或者注射牛生长激素(bST),虽然这些方法在生产实践中获得了成功,但是,处于食品安全的考虑,这些添加剂并不受到广大群众的认可。目前,欧盟和中国已经禁止了通过使用抗生素来提高反刍动物生产性能的方法。广大的动物营养学者开始尝试使用绿色安全的制剂来替代抗生素和牛生长激素,如植物次级代谢产物[1-5]。这些制剂的使用主要是通过调节瘤胃发酵模式(改变乙酸和丙酸比例等)、提高瘤胃整体发酵能力、降低瘤胃液氨态氮的浓度和改善动物免疫状态的作用路径来起作用的。但是,这些制剂相对较为昂贵,在生产实践中很少得到应用推广。发酵饲料的制作成本低,绿色安全,很多学者也展开了关于发酵饲料对反刍动物影响的试验[6,7],但是主要集中在对瘤胃发酵、生产性能的影响上,对反刍动物抗氧化性能和免疫性能的影响研究较少,尤其是在后备牛上的研究。本试验旨在对几种发酵饲料在高纤维日粮条件下后备牛的消化、抗氧化、饲料效率和免疫状态进行较为系统的研究,为生产实践提供必要的理论基础和数据参考。
1 材料与方法
试验分为2个部分,试验1研究发酵饲料对后备牛生长性能的影响,试验2研究研究发酵饲料对后备牛高纤维日粮营养物质消化率和血液指标的影响。
1.1 试验1的试验设计、后备牛的饲养管理
试验采用单因素随机区组试验设计(RCBD)。共32头后备牛(平均体重为231.33 kg,标准差为16.44 kg;日龄为254.55 d,标准差为18.99 d)。体重和日龄相近的后备牛分为1组,成为1个区组,每个区组8头牛,共分4个组。在每个区组中随机选取2头牛重新构成1个处理组,接受1个处理。4个处理分别为对照组、白腐真菌发酵饲料组、啤酒酵母发酵饲料组和耐盐短杆菌发酵饲料组。每头牛每天饲喂50 g发酵饲料。后备牛自由采食,每天饲喂2次,分别在06:00时和17:30时,自由饮水。后备牛舍为栓系式围栏设计,每头牛1个栏位,每天饲喂后自由运动1 h。所有的后备牛在试验前15 d进行驱虫。共28周的试验周期。试验的前2周为预饲期,后26周为试验期。在试验开始时(第3周)和结束时(第28周)称量后备牛的体重,分别视为初始体重和末体重。试验期的每一天准确记录每头牛的采食量。每一周对每头牛的日粮取样1次,-20℃冻存,最后混合在一起。置于65℃烘箱中72 h。干物质含量采用AOAC中的方法测定[8]。
饲料配方设计见表1,其中的总可消化养分(TDN)和代谢能(ME)是根据NRC(2001)中的计算公式计算得到,其余的指标均为试验室测定值。玉米秸秆(无籽实)和精饲料饲喂前进行充分混合。
每种发酵饲料中含有活菌数为1×109CFU/g。每头牛每天饲喂50 g发酵饲料。发酵饲料在饲料投喂时加入到饲料中,确保全部采食。
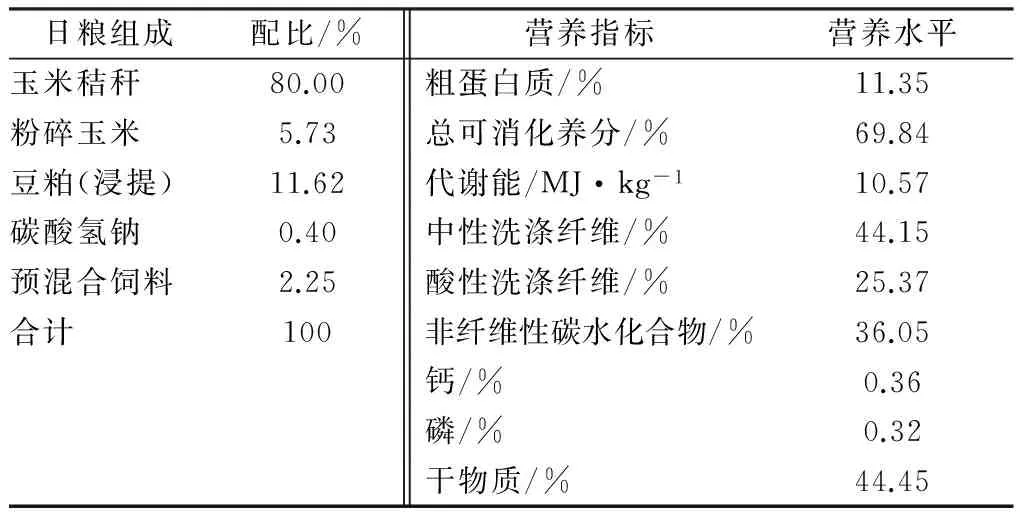
表1 日粮配方和化学组分
注:预混合饲料中含有7%VE,5.8%VA,25%VD3,14.1%盐,33.5%石粉,5.8%微量元素预混料和3%硒预混剂。
1.2 试验2中营养物质消化率的测定和血液样本采集
试验2在试验1结束时开始。饲养管理与试验1相同,但是取消了饲喂后的运动时间。消化率试验期为15 d。采用Cr2O3为外源性指示剂,首先将指示剂与少量精饲料进行混合,确保每头牛完全采食。每天饲喂250 g Cr2O3(含有10 g Cr),连续饲喂15 d。在试验期的第11 d开始收集粪样和饲料样品。200 g粪样在每一天的08:00时和18:00时分别从直肠取得。粪样使用6 mol/L的HCl进行喷雾处理,用来固定其中的氨态氮,置于-20℃冰柜中保存。所有的粪样和饲料样品置于65℃烘箱中烘干48 h。分析其中的干物质、有机物质、总氮、酸性洗涤纤维和Cr的含量[8]。中性洗涤纤维的含量采用Van Soest等[9]的方法进行测定,其中添加了热稳定性淀粉酶。Cr的含量分析采用原子吸收(Contra 300)。表观营养物质消化率,其中包括有机物质(OM),干物质(DM),中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)和总氮(N)消化率均采用如下公式进行计算:

式中,m为5 d内的总干物质采食量。
在试验期的第13~15 d采集血液样品,使用真空采血管(内壁涂有肝素钠)在颈静脉每天采集10 ml血样,样品首先在室温条件下静置2 h,之后置于4℃冰箱中3 h,进行分离血清。最后血液样品在4℃离心机3 000g,离心15 min。取上清液,置于-40℃冰柜中保存。
1.3 血清抗体的测定
血清抗体,包括免疫球蛋白A(IgA),免疫球蛋白G(IgG)和免疫球蛋白M(IgM)使用酶联免疫试剂盒进行测定,严格按照说明书中的方法进行。前列腺素(PGE2)采用同正生物公司生产的酶联免疫试剂盒进行测定。
1.4 细胞因子和抗氧化指标的测定
血清中的白细胞介素-2(IL-2),白细胞介素-4(IL-4),白细胞介素-6(IL-6)和白细胞介素-10(IL-10),细胞干扰素-γ(IFN-γ)的测定使用牛特异性免疫酶联试剂盒进行分析。抗氧化指标,其中包括谷胱甘肽过氧化物酶(GSH),超氧化物歧化酶(SOD)和丙二醛(MDA)的测定使用同正生物公司生产的试剂盒,严格按照试剂盒的操作说明进行测定。
1.5 统计分析
统计分析过程采用SAS8.1进行,统计模型为:
Yijk=μ+αi+βj+eijk,
其中μ为平均数,αi为发酵饲料的固定效应,βj为区组效应,eijk为随机效应。使用ANOVA进行方差分析和Duncan过程进行多重比较。“P<0.05”视为差异显著。
2 结 果
2.1 饲料效率和生长性能
几种发酵饲料对后备牛生长性能、饲料效率和平均日增重的影响见表2。

表2 几种发酵饲料对后备牛生长性能、饲料效率和平均日增重的影响
注:*表示P< 0.05;WRF表示白腐真菌发酵饲料,SC表示啤酒酵母发酵饲料,BB表示耐盐短杆菌发酵饲料。
由表2可见,添加白腐真菌发酵饲料、啤酒酵母发酵饲料和耐盐短杆菌发酵饲料对后备牛的干物质采食量均没有影响(P>0.05)。和对照组相比,日粮添加耐盐短杆菌发酵饲料显著提高了后备牛的末重、总增重和平均日增重及饲料效率(P<0.05)。白腐真菌发酵饲料显著的降低了体增重和平均日增重(P>0.05)。
2.2 干物质采食量和营养物质消化率
几种发酵饲料对后备牛干物质采食量和营养物质消化率的影响见表3。

表3 几种发酵饲料对后备牛干物质采食量和营养物质消化率的影响
注:*表示P< 0.05;WRF表示白腐真菌发酵饲料,SC表示啤酒酵母发酵饲料,BB表示耐盐短杆菌发酵饲料。
由表3可见,添加3种发酵饲料对中性洗涤纤维,酸性洗涤纤维和总氮的消化率没有显著影响(P>0.05)。然而,耐盐短杆菌发酵饲料显著的提高了日粮干物质和有机物质的消化率(P<0.05)。
2.3 抗氧化功能和免疫状态
几种发酵饲料对后备牛抗氧化功能和免疫状态的影响见表4。
由表4可见,日粮添加白腐真菌发酵饲料、啤酒酵母发酵饲料和耐盐短杆菌发酵饲料对血清IgA,IgG和IgM浓度没有显著影响(P>0.05)。耐盐短杆菌发酵饲料显著降低了血清IFN-γ的浓度(P<0.05)。四个处理组间的IL-2,IL-4,IL-6和IL-10浓度没有显著差异(P>0.05)。耐盐短杆菌发酵饲料显著降低了血清PGE2的浓度(P<0.05)。耐盐短杆菌发酵饲料分别显著的提高了血清SOD的浓度和降低了MDA的浓度(P<0.05)。3种发酵饲料的添加均对GSH的浓度没有影响(P>0.05)。
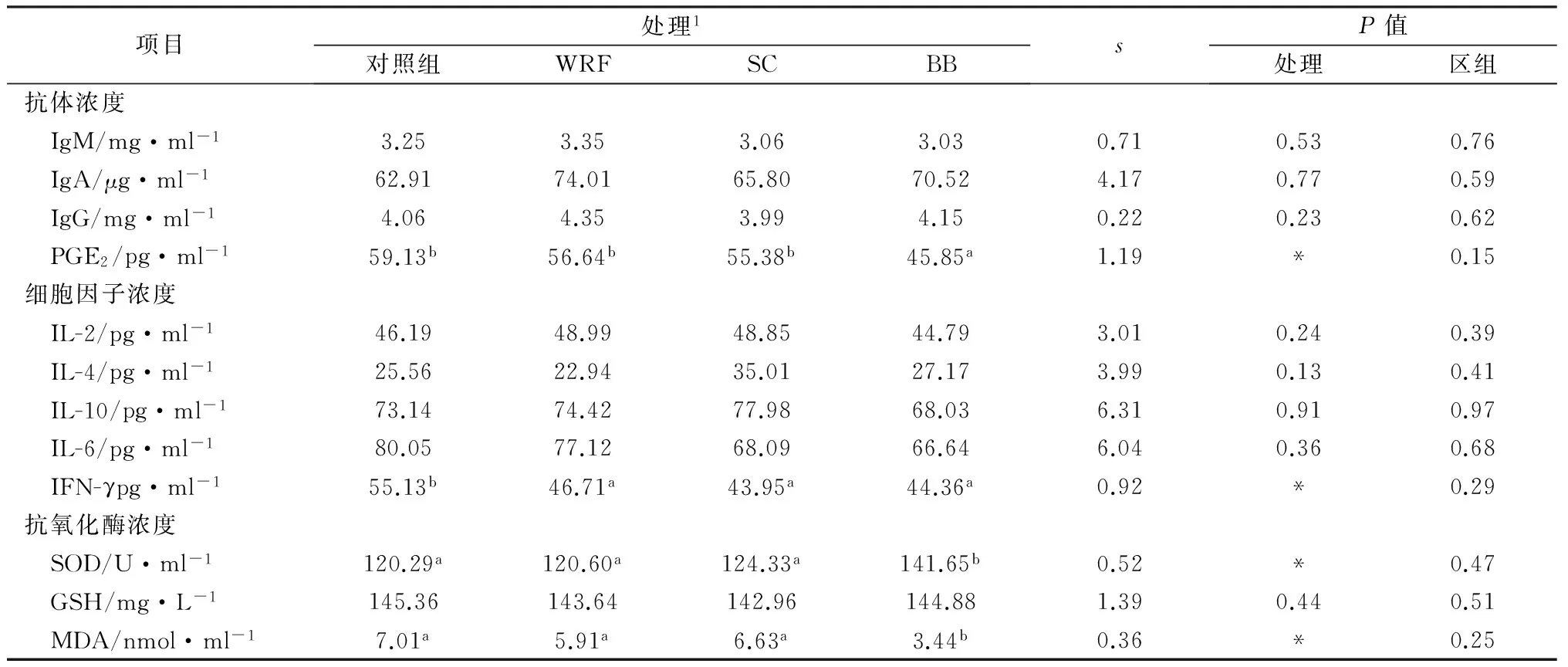
表4 几种发酵饲料对后备牛抗氧化功能和免疫状态的影响
注:*表示P< 0.05;WRF表示白腐真菌发酵饲料,SC表示啤酒酵母发酵饲料,BB表示耐盐短杆菌发酵饲料。
3 讨论
3.1 干物质采食量、营养物质消化率和生长性能
3种发酵饲料对后备牛干物质采食量没有显著影响,说明它们对日粮的适口性没有影响。这个结果与很多学者在泌乳牛中的研究较为一致[6-7]。据Jiang等[10]报道,发酵饲料可以改变牛瘤胃微生物的区系和比例构成。如,啤酒酵母发酵饲料可以提高瘤胃主要的纤维降解菌(溶纤维丁酸弧菌、产琥珀酸丝状杆菌、白色瘤胃球菌和黄化瘤胃球菌)的数量。这些菌数量的提高势必会提高日粮纤维的消化率。但是,本试验中啤酒酵母并没有提高日粮中性洗涤纤维和酸性洗涤纤维的消化率。可能的解释是,本试验中采用的是粗饲料占80%的高纤维日粮,而发酵饲料的作用受到日粮精粗比例的影响很大,以往的试验研究多数都基于精粗比例为50∶50的日粮条件下的。本试验采用每头牛添加50 g的发酵饲料,如果加大发酵饲料的饲喂量,可能会提高纤维物质的消化率,这需要进一步的研究。白腐真菌发酵饲料一直被用来帮助反刍动物分解纤维物质,从而使动物获得很多的能量。但是,一般常用在对粗饲料的预处理上,如黄贮和微贮。本试验目的是将白腐真菌接种在后备牛的瘤胃中,以期帮助后备牛消化高纤维日粮,但是,结果表明其并没有效果,说明白腐真菌在瘤胃中并不能很好的存活,或者其在瘤胃中的活力很低。耐盐短杆菌发酵饲料成功的提高了日粮有机物质的消化率,但是纤维物质,如NDF或者ADF的消化率也没有提高,说明耐盐短杆菌主要的作用是提高非纤维性碳水化合物(单糖、淀粉等)的消化率。耐盐短杆菌可能对瘤胃中降解淀粉的细菌(瘤胃短杆菌、反刍兽新月形单胞菌等)有很好的刺激作用,这需要进一步使用分子水平的试验进行定量研究。耐盐短杆菌发酵饲料提高了后备牛的生产性能的主要原因可能是其提高了日粮的干物质和有机物质的消化率。
3.2 抗氧化功能
普遍认为血液SOD和GSH的浓度与动物的抗氧化功能是正相关的,而丙二醛(MDA)的浓度(细胞膜脂质氧化的终产物)与动物的抗氧化功能是负相关的。据文献报道,当动物处于比较差的抗氧化状态下,血液中的SOD和GSH浓度降低,MDA的浓度升高[11-12]。这时动物的生产性能也是下降的,因为细胞膜中的不饱和脂肪酸受到氧化,膜失去了完整性,继而失去了部分功能。我们目前的试验结果与这个论断一致。添加耐盐短杆菌发酵饲料提高了血液中的SOD和GSH的浓度,降低了MDA的浓度。这使得后备牛处于一个较好的抗氧化状态下,从而这个处理组的牛表现出了较好的生产性能。
3.3 免疫状态
近些年关于免疫与营养的关系研究较多,其中包括家禽[12-14]、猪[15-16]和奶牛[17-19]。以上这些研究表明当动物处于较好的免疫状态时,它们的生产性能是相对较高的。一些在人的临床治疗上的研究表明,一些菌剂也确实能够改善免疫状态。我们目前的研究结果表明,耐盐短杆菌发酵饲料有提高后备牛免疫状态的作用,这个结果与以上研究结果相一致。试验中发现耐盐短杆菌发酵饲料与其他处理组相比,后备牛血清中含有较低浓度的PGE2和IFN-γ。从发表的文献中可以得出结论,PGE2在调控免疫细胞合成细胞因子方面起到非常重要的作用。据报道,当动物处于急性或者慢性炎症生理状态时,PGE2和IFN-γ的浓度是较高的[20-22]。试验后备牛血液中较低浓度的PGE2和IFN-γ说明了后备牛处于一种较好的免疫状态。
4个处理组之间的IL-2,IL-4,IL-6和IL-10的浓度几乎没有差异,这个研究结果与Sun 等[17]的报道不一致,其研究中采用十二指肠灌注营养的方式研究了枯草芽孢杆菌对泌乳牛免疫状态的影响,结果显示其能够升高IL-2的浓度。本试验中的耐盐短杆菌与枯草芽孢菌在种属特异性上较为接近,但是没有提高后备牛IL-2的浓度,其中潜在的机制需要进一步研究。IFN-γ是Th 1淋巴细胞分泌的一种可以介导免疫反应的细胞因子。据Blok等[23]报道,当机体暴露在病原微生物或者炎症条件下,T细胞受到抑制,继而T细胞源性细胞因子的产量将降低,血液中的IFN-γ的浓度上升。本试验中饲喂耐盐短杆菌后备牛较低的IFNγ浓度表明,耐盐短杆菌可以有效的降低IFN-γ,使后备牛处于较好的免疫和生理状态。
4 结论
在高粗饲料日粮条件下,饲喂后备牛50 g/d耐盐短杆菌发酵饲料可以提高日粮干物质和有机物质总胃肠道表观消化率,提高平均日增重和饲料效率。耐盐短杆菌发酵饲料可以改善后备牛的抗氧化功能和免疫状态。饲喂耐盐短杆菌发酵饲料的后备牛生长性能提高可能是由于营养物质消化率提高了,也可能是由于抗氧化功能提高了,也有可能是免疫状态改善了,或者以上原因都存在。
[1] BENCHAAR C,MCALLISTER T A,CHOUINARD P Y.Digestion,ruminal fermentation,ciliate protozoal populations,and milk production from dairy cows fed cinnamaldehyde,quebracho condensed tannin,oryuccaschidigerasaponin extracts[J].J Dairy Sci,2008,91:4 765-4 777.
[2] BENCHAAR C,PETIT H V,BERTHIAUME R,et al.Effects of dietary addition of essential oils and monensin premix on digestion,ruminal fermentation characteristics milk production,and milk composition in dairy cows[J].J Dairy Sci,2006,89:4 352-4 364.
[3] BUSQUET M,CALSAMIGLIA S,FERRET A,et al.Plant extracts affect in vitro rumen microbial fermentation[J].J Dairy Sci,2006,89:761-771.
[4] BEAUCHEMIN K A,MCGINN S M,MARTINEZ T F,et al.Use of condensed tannin extract from quebracho trees to reduce methane emissions from cattle[J].J Anim Sci,2007,85:1 990-1 996.
[5] LILA Z A,MOHAMMED N,KANDA S,et al.Effect of sarsaponin on ruminal fermentation with particular reference to methane production in vitro[J].J Dairy Sci,2003,86:3 330-3 336.
[6] Qiao G H,Shan A S,Ma N,et al.Effect of supplemental Bacilluscultures on rumen fermentation and milk yield in Chinese Holstein cows[J].J Anim Physio Anim N,2010,94:429-436.
[7] BEAUCHEMIN K A,KREUZER M,O’MARA F,et al.Nutritional management for enteric methane abatement:Areview[J].Aust J Exp Agric,2008,48:21-27.
[8] Association of Official Analytical Chemists.Official Methods of Analysis,15thed[M].USA:Arlington,1990.
[9] VAN SOEST P J,Robertson J B,Lewis B A.Methods for dietary fiber,neutral detergent fiber and nonstarch polysaccharides in relation to animal nutrition[J].J Dairy Sci,1991,74:3 583-3 597.
[10] JIANG Y,OGUNADE I M,QI S,et al.Effects of the dose and viability of Saccharomyces cerevisiae.1.Diversity of ruminal microbes as analyzed by IlluminaMiSeq sequencing and quantitative PCR[J].J Dairy Sci,2016,100:325-342.
[11] MA D Y,SHAN A S,CHEN Z H.Influence of Ligustrumlucidum,SchisandraChinensis,Sijunzitang andDaidzein on antioxidant status of layinghens under heat stress[J].ActaZoonutrimentaSinica,2005(2):23-27.
[12] MA D Y,SHAN A S,LI Q D.Effect ofChinese medical herbs on chickensgrowth and immunization[J].ActaZoonutrimentaSinica,2004(2):36-40.
[13] CHEN H L,LI D F,CHANG B Y,et al.Effects of Chineseherbal polysaccharides on the immunityand growth performance of young broilers[J].Poultry Sci,2003,82:364-370.
[14] YI G F,ALLEE G L,KNIGHT C D,et al.Impact of glutamine and Oasishatchling supplement on growth performance,small intestinal morphology,andimmune response of broilers vaccinatedand challenged with Eimeria maxima[J].Poultry Sci,2005,84:283-293.
[15] LIU Y L,LI D F,GONG L M,et al.Effects of fish oilsupplementation on the performance andthe immunological,adrenal,and somatotropicresponses of weaned pigs after an Escherichia coli lipopolysaccharide challenge[J].J Anim Sci,2003,81:2 758-2 765.
[16] YI G F,CARROLL J A,ALLEE G L,et al.Effect of glutamine and spray dried plasma on growth performance,small intestinal morphology,and immune responses of escherichia coli K88+ challenged weaned pigs[J].J Anim Sci,2005,83:634-643.
[17] SUN P,WANG J Q,YANG G,LIU Q S.Effects of different doses of free alinolenicacid infused to the duodenum onthe immune function of lactating dairycows[J].Arch Anim Nutr,2010,64:504-513.
[18] ZHANG Q R,LI J G,LI X M,et al.Effect of Chinese herbs additives onimmune function and milk yield in Chinese Holstein cows[J].Journal of Heilongjiang Animal and VeterinarianMedicine,2004(10):22-24.
[19] ZHANG Q R,LI J G,LI X M,et al.Effect of Chinese herbs additives onendocrine function in Chinese Holsteincows[J].Journal of Heilongjiang Animal andVeterinarian Medicine,2005(4):54-55.
[20] CARTER L L,DUTTON R W.Type 1 and Type2:a fundamental dichotomy for all T-cellsubsets.Curr[J].Opin Immunol,1996(8):336-342.
[21] KINSELLA J E,LOKESH B,BROUGHTON S,et al.Dietary polyunsaturatedfatty acids and eicosanoids:Potentialeffects on the modulation of inflammatoryand immune cells:An overview[J].J Nutr,1990(6):24-44.
[22] DESMEDT M,ROTTIERS P,DOOMS H,et al.Macrophages induce cellularimmunity by activating Th1 cellresponses and suppressing Th2 cellresponses[J].J Immunol,1998,160:5 300-5 308.
[23] BLOK W L,KATAN M B,VAN DER MEER J W M.Modulation of inflammation and cytokine production by dietary (n-3) fatty acids[J].J Nutr,1996,126:1 515-1 533.
(责任编辑:梅 竹)
Effect of several fermented feeds on growth performance,blood antioxidant function and immune in Chinese Holstein dairy heifer fed high fiber diet
QIAO Guo-hua,LI Gui-jie,XIAO Zhi-gang,XU Cai-hong,XIE Tie-min
(College of Grain Science and Technology,Shenyang Normal University,Shenyang 110034,China)
Two experiments were carried out to investigate the effects of supplemental several fermented feeds,Whiterotfungi(WRF),Saccharomycescerevisiae(SC) andBrevibacterium(BB) on growth performance,blood antioxidant function and immune in Holstein dairy heifers fed high fiber diet.Experiment 1 indicated that the addition of three fermented feeds(1×109CFU/g,50 g per head per day) had no effect on dry matter intake.BB supplementation increased heifers' average daily gain (ADG) and final body weight,feed efficiency,and the digestibility of dry matter and organic matter (P<0.05).Experiment 2 indicated that BB supplementation improved the blood antioxidant function with higher concentration of superoxide dismutase (SOD) and lower concentration of malondialdehyde (MDA)(P<0.05),and improved immune with lower concentrations of prostaglandin E2(PGE2) and immunoreactive fibronectin (IFN-γ)(P<0.05).All the three fermented feeds had no effect on blood interleukin-2,interleukin-4,interleukin-6 and interleukin-10,respectively (P>0.05),and had no effect on blood immunoglobulin A (IgA),immunoglobulin M (IgM) and immunoglobulin G(IgG),respectively (P>0.05).
fermented feed;growth performance;blood antioxidant function;immune;Holstein dairy heifer
2017-01-16;
2017-03-19
辽宁省科技厅农业攻关项目(2015211003);辽宁省自然基金项目(201602675)。
乔国华(1980-),男,高级畜牧师,主修动物营养与饲料科学。
李桂杰(1959-),女,教授,主要研究方向为粮食加工利用与储藏工程。
10.7633/j.issn.1003-6202.2017.04.014
S816.32
A
1003-6202(2017)04-0053-06

