二氧化硅和高岭土杂质对硫铁矿分解磷石膏的影响
王戬,杨秀山,杨林,王辛龙,张志业
四川大学化工学院,四川成都 610065
二氧化硅和高岭土杂质对硫铁矿分解磷石膏的影响
王戬,杨秀山*,杨林,王辛龙,张志业
四川大学化工学院,四川成都 610065
针对磷石膏资源化利用存在问题,提出了一种用硫铁矿分解磷石膏的方法.为了实现该工艺的工业化利用,探究了磷石膏内二氧化硅和高岭土杂质对分解过程的影响.利用Factsage7.0热力学软件,计算了FeS-CaSO4体系在加入二氧化硅或高岭土后的平衡相图,探讨了加入杂质后可能发生的副反应.进行了杂质对分解过程影响的实验,并对产品进行SO3分析及XRD表征.研究结果表明,SiO2或高岭土的加入使得FeS和CaSO4在低温区就能发生反应,提高了反应体系的脱硫率,促进了硫酸钙的分解,并且杂质含量越高,硫酸钙分解率越高.该研究结果有利于硫铁矿还原分解磷石膏制备硫酸工艺的推广应用.
杂质;二氧化硅;高岭土;硫铁矿;磷石膏
磷石膏是工业湿法磷酸生产的副产物,主要成分是硫酸钙,每生产1 t的湿法磷酸产生5 t~7 t的磷石膏,pH值约为1.5~4.5,呈酸性,含水量较高,粘性较强,堆积密度达1 000 kg/m3[1-2].近年来,我国磷肥工业迅猛发展,磷石膏的产生量也迅速增加.2006年,我国磷石膏产量为4 000万吨;而2013年,磷石膏的年产量已达7 000万吨[3-4];产量年平均增长率为8%.目前,我国磷石膏堆积量已超过2.5亿吨[5].当前我国巨量堆积的磷石膏不仅占用大量土地,同时由于其含有可溶磷、可溶氟、重金属等杂质,污染地下水,对环境造成严重影响[6].因此,亟需对磷石膏进行大规模资源化利用.
根据磷石膏的特性,世界上对于磷石膏的利用主要有三种途径:一是作建筑原材料;二是用于土壤改良剂;三是作为硫钙资源生产化工产品[7-9].如果利用磷石膏生产建筑原材料,其工艺预处理成本高,杂质难以彻底除去,容易产生二次污染,还不能获得消费者普遍认可,且其物流成本限制了其市场销售范围[10-11].若用作土壤改良剂,虽可改善粘土的渗透性能以及降低土壤的碱度,但磷石膏中含有的氟、砷和镉、铅、锌等重金属元素在土壤中富集会使农作物中该类有害元素提高,最终对人类健康构成威胁[12-13].因此,上述两种途径皆不能真正实现磷石膏大规模可持续利用,而将磷石膏作为硫钙资源生产化工产品,使磷石膏在化工行业实现循环利用,是一种不仅可大规模消纳磷石膏,而且具备显著循环经济效益的途径.
基于磷石膏作为硫钙资源生产化工产品的思路,王俊哲,邓少刚,杨林等[14-16]提出了一种用硫铁矿还原分解磷石膏工艺.该工艺以低价值的硫铁矿为还原剂分解磷石膏,制备氧化钙和钢铁造渣剂铁酸钙,得到的高浓度SO2可用于制备硫酸.该工艺核心反应为:
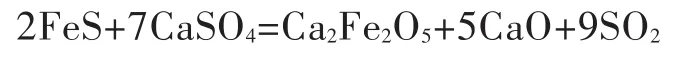
而已有研究没有充分考虑到硫铁矿与磷石膏中的杂质对该反应的影响.本文在已有研究基础上,通过添加二氧化硅和高岭土这两种磷石膏中最主要的杂质进行工艺实验,并结合热力学计算模拟,探究了这两种杂质对该核心反应的影响.
1 实验部分
1.1 原料
硫化亚铁,来自天津市科密欧试剂厂,黑褐色块状固体,质地坚硬,敲碎后用球磨器粉碎为粉末状,放入密封试剂瓶内,干燥保存备用,通过碳硫仪测定其中FeS有效含量为77%.分析纯级无水硫酸钙,来自成都科龙化工试剂厂,其质量分数大于99%.分析纯级二氧化硅,来自成都市东方化工厂,SiO2质量分数在99%以上.化学纯级高岭土,来自上海市奉贤奉城试剂厂,高温下灼烧失重少于15%.N2(质量分数为99.5%)来自成都市东风工业气体有限公司.
1.2 装置和方法
本实验采用有配气系统的管式炉反应系统,在氮气气氛下,探究杂质对FeS还原分解CaSO4过程的影响.具体实验装置详见图1.将预先配好的混合反应物料置于管式炉恒温段,控制氮气流量在200 mL/min,然后使管式炉按设置好的程序升温.

图1 实验装置Fig.1Experiment equipment
1.3 分析表征方法
利用Factsage7.0热力学软件计算了含杂质的反应体系的热力学平衡变化,并通过X射线衍射表征(XRD)分析了实际产物中的物相组成.
反应物料中磷石膏分解率η通过采用硫酸钡重量法测定反应前后样品中CaSO4含量来计算:
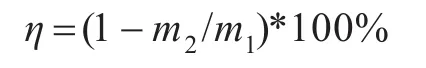
式中:m1为反应前混合物料中CaSO4质量(g),m2为反应后产物中CaSO4质量(g).
2 结果与讨论
2.1 SiO2杂质的影响
如图2为利用热力学软件Factsage7.0计算的FeS-CaSO4-SiO2体系相图,横坐标表示为FeS的质量分数,纵坐标为反应温度,杂质SiO2在固相中的比例为10%.由计算结果可知,最理想的体系反应结果在图中蓝色圆点标记区域,因为只有在该相区内,固相中无反应物FeS及CaSO4存在,固相仅为CaS、Ca2Fe2O5、Ca2SiO4.

图2 FeS-CaSO4-SiO2体系相图Fig.2Phase diagram of FeS-CaSO4-SiO2system
图3为通过Factsage7.0热力学软件计算的FeS-CaSO4-SiO2体系的平衡组成随温度变化结果.计算条件为n(FeS)∶n(CaSO4)=2∶7,w(SiO2)= 10%.该图计算结果可以反映出FeS-CaSO4-SiO2体系的反应随温度变化的平衡变化情况.

图3 FeS-CaSO4-SiO2体系平衡组成变化图Fig.3Equilibrium composition variation of FeS-CaSO4-SiO2system
结合图2及图3发现,在FeS-CaSO4-SiO2反应体系中,从700℃开始,FeS、CaSO4、SiO2质量急剧减少,同时Ca3Fe2Si3O12、CaSiO3、SO2生成并且质量快速增加,说明SiO2参与了体系反应.720℃至870℃范围内,各物质质量保持不变,说明在此温度区间内没有新反应发生.从870℃至880℃范围,CaSiO3、CaSO4、FeS质量继续减少,Ca3Fe2Si3O12、Ca3Si2O7、SO2质量继续增加,此阶段发生新反应.从920℃到940℃范围内,CaSO4、Ca3Fe2Si3O12、FeS平衡组成同时减少,Ca3Si2O7、Fe2O3、SO2同时增加,说明此温度范围内,又有新反应发生.而从980℃开始,工艺目标产物Ca2Fe2O5才开始产生,说明工艺核心反应才开始发生.
因此,由以上理论分析可知,加入SiO2后,体系发生的副反应有:

但以上副反应皆为低温分解CaSO4脱出SO2,因此从热力学理论来看SiO2可促进硫酸钙分解.
在以氮气为环境气氛,反应温度1 000℃,反应时间为40 min,反应物FeS与CaSO4摩尔比为2∶7条件下,从具体实验上考察SiO2杂质对磷石膏分解率的影响.实验结果如图4.
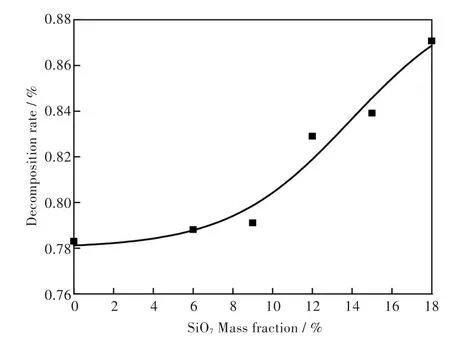
图4 二氧化硅杂质对分解率的影响Fig.4Effect of silicon dioxide on decomposition rate
图中横坐标SiO2含量为0点表示为空白实验组,无SiO2添加.从实验结果可以看出,随着反应物料中添加的SiO2含量从6%增加至18%,混合物料中硫酸钙的分解率不断提高.当添加的SiO2含量增加至18%时,硫酸钙的分解率从空白组的78%提升到了87%,表明杂质二氧化硅能够促进硫酸钙的分解.
而从图4中的添加SiO2后FeS-CaSO4反应体系产物的XRD表征结果图5可以发现,在FeS-CaSO4反应体系中,随着SiO2添加量从6%增加至18%,产物XRD图中CaSO4主峰强度减弱,这也说明了SiO2的添加能促进CaSO4的分解.由图中XRD表征结果可知,产物中有Ca2SiO4、Ca2Fe2O5、CaS生成,说明确实是SiO2参与反应,并且产物组成也同Factsage7.0计算下相图结果相吻合.

图5 FeS-CaSO4体系添加SiO2后产物XRD图Fig.5XRD patterns of product with adding silicon dioxide into FeS-CaSO4system
2.2 高岭土杂质的影响
利用热力学软件Factsage计算出FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2体系下的平衡相图如图6所示,横坐标表示的是FeS占反应物中的质量比例,纵坐标表示的是计算的反应温度区间.计算条件为,n(FeS)∶n(CaSO4)=2∶7,高岭土杂质占反应物质量分数为4%.图中圆点处表示的相区为理想反应条件区域,该相区内反应物FeS与CaSO4皆反应完全.

图6 FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2体系相图Fig.6Phase diagram of FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2system
图7为通过Factsage7.0热力学软件计算的FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2体系的平衡组成随温度变化结果,计算条件为n(FeS)∶n(CaSO4)= 2∶7,w(Kaolin)=4%.

图7 FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2体系平衡组成变化图Fig.7Equilibrium composition variation of FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2system
结合图7与图8分析可知,FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2反应体系下反应机理比较复杂,由于杂质高岭土的引入,反应体系初始反应温度为600℃左右,高岭土热分解为氧化铝和二氧化硅,同时与FeS和CaSO4反应生成CaAl2Si2O8和Fe2O3,气相有SO2生成,体系开始脱硫.随温度升高,体系中固体产物逐渐生成Ca2Al2SiO7和Ca3Si2O7,CaSO4与FeS质量随之减少.从960℃开始,体系内有目标产物Ca2Fe2O5生成并且质量逐渐增加,随着其他杂质如Ca2SiO4、CaAl2O4、Ca3Al2O6生成,当温度升至1 140℃左右时,CaO开始出现并持续增加.从图8中可以发现,加入高岭土后,以上全部副反应都伴随着SO2的脱出,因而这一系列反应都利于CaSO4的分解.因此,从热力学角度来看,高岭土的引入也能促进硫酸钙分解.

图8 高岭土对分解率的影响Fig.8Effect of Kaolin on decomposition rate
同样,以相同的空白条件,考察高岭土对FeS-CaSO4反应体系的影响.由实验结果图8可知,随着高岭土添加量增加,CaSO4分解率不断提高,当高岭土添加量为8%时,CaSO4分解率从空白组78%提升至了83%.
从图9中FeS-CaSO4体系添加高岭土后产物XRD表征图来看,产物中检测出来的固相物质有Ca2Al2SiO7、Ca2Fe2O5、CaS,产物组成同样与前文Factsage7.0计算结果吻合.而且随着高岭土含量增加,硫酸钙的特征峰强度随之降低,这也说明高岭土加入能促进硫酸钙分解.由于高岭土的加入,体系中生成了一系列的中间产物,在低温阶段体系便开始有磷石膏分解,体系脱硫.

图9 FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2体系产品XRD图Fig.9XRD patterns of product with adding kaolin into FeS-CaSO4-(Al2O3)(SiO2)2(H2O)2system
3 结语
1)SiO2和高岭土加入均会促进硫酸钙的分解,杂质对硫酸钙分解的促进作用主要是杂质与原料反应消耗一部分硫酸钙,在低温副反应部分进行脱硫反应,产生SO2,从而促进硫酸钙的分解率.
2)SiO2和高岭土含量越高,CaSO4分解率也越高.该结果与热力学计算趋势相一致.
3)磷石膏中这两种含量较高的杂质有利于硫铁矿还原分解磷石膏制备硫酸,磷石膏不需净化处理就能利用,该工艺具备较好的应用前景.
[1]杨兆娟,向兰.磷石膏综合利用现状评述[J].无机盐工业,2007,39(1):8-10.
YANGZ J,XIANGL.Review of comprehensive utilization of phosphogypsum[J].Inorganic Chemicals Industry,2007,39(1):8-10.
[2]周智武,金苏闵.我国磷石膏综合利用技术进展[J].硫酸工业,2013(2):5-7.
ZHOUZW,JINSM.Technicalprogressin comprehensive utilization of phosphogypsum in China[J].Sulphuric Acid Industry,2013(2):5-7.
[3]叶学东.磷石膏的综合利用现状及分析[C]∥第四届全国磷复肥、磷化工技术创新(湛江)论坛论文集.郑州:《磷肥与复肥》编辑部,2013:208-214.
[4]叶学东.磷石膏综合利用现状及加快发展的建议[J].磷肥与复肥,2014,29(6):1-3.
YE X D.Current situation and development suggestion for comprehensive utilization of phosphogypsum[J]. Phosphate&Compound Fertilizer,2014,29(6):1-3.
[5]郑大龙,王荣谋,马丽萍,等.不同气氛条件下磷石膏分解过程变迁模拟研究[J].计算机与应用化学,2016,33(11):1177-1181.
ZENG D L,WANG R M,MA L P,et al.Simulation studyonthevarieddecompositionprocessof phosphogypsum under different atmosphere conditions[J].Computers and Applied Chemistry,2016,33(11):1177-1181.
[6]官洪霞,谭建红,袁鹏,等.对磷石膏中各危害组分环境污染本质的分析[J].广州化工,2013,41(22):135-136.
GUAN H X,TAN J H,YUAN P,et al.The harm of phosphogypsum component analysis of the nature of environmentalpollution[J].GuangzhouChemical Industry,2013,41(22):135-136.
[7]李飞.磷石膏综合利用现状及“十二五”发展建议[J].磷肥与复肥,2012,27(6):69-72.
LI F.Phosphogypsum comprehensive utilization and development suggestion in the 12thFive-year Plan[J]. Phosphate&Compound Fertilizer,2012,27(6):69-72.
[8]孔祥琴.浅述利用磷石膏制硫酸铵生产工艺及发展前景[J].贵州化工,2013,38(1):15-16.
KONGXQ.Ammoniumsulfateproductionfrom phosphogypsum production technology and development prospect of utilization[J].Guizhou Chemical Industry,2013,38(1):15-16.
[9]龚家竹.论磷石膏的资源利用与经济效益分析[J].硫酸工业,2014(1):52-56.
GONG J Z.Resource utilization of phosphogypsum and economic benefit analysis[J].Sulphuric Acid Industry,2014(1):52-56.
[10]徐威,董兵海,宋成杰,等.磷石膏的改性及其在新型建材中的应用[J].粉煤灰综合利用,2016(2):49-53.
XUW,DONGBH,SONGCJ,etal.The modification of phosphogypsum and its applications in new building materials[J].Fly Ash Comprehensive Utilization,2016(2):49-53.
[11]王怀利,高璐阳,陈宏坤,等.我国磷石膏综合利用现状分析与展望[J].磷肥与复肥,2016,31(4):32-34.
WANG H L,GAO L Y,CHEN H K,et al.Analysis andprospectofphosphogypsumcomprehensive utilization in China[J].Phosphate&Compound Fertilizer,2016,31(4):32-34.
[12]舒艺周.我国磷石膏现有资源化利用方式[J].磷肥与复肥,2013,28(1):73-75.
SHU Y Z.Existing resource utilization patterns of phosphogypsum in China[J].Phosphate&Compound Fertilizer,2013,28(1):73-75.
[13]王成宝,崔云玲,郭天文.磷石膏在作物生产中的利用[J].甘肃农业科技,2008(5):40-42.
WANG C B,CUI Y L,GUO T W.The utilization of phosphogypsumoncropproduction[J].Gansu Agricultrual Scienceand Technology,2008(5):40-42.
[14]王俊哲,邓少刚,张志业,等.硫铁矿和磷石膏反应过程的熔融特性研究[J].磷肥与复肥,2015,30(3):11-13.
WANG J Z,DENG S G,ZHANG Z Y,et al.Research onmeltingcharacteristicsofpyriteand phosphogypsum reaction process[J].Phosphate& Compound Fertilizer,2015,30(3):11-13.
[15]邓少刚,王俊哲,黄鹏辉,等.FeS还原CaSO4的热分解动力学研究[J].磷肥与复肥,2015,30(3):5-10.
DENG S G,WANG J Z,HUANG P H,et al.Study on thermal decomposition kinetics of CaSO4reduced with FeS[J].Phosphate&Compound Fertilizer,2015,30(3):5-10.
[16]杨林,杨秀山,张志业,等.一种硫铁矿还原分解石膏制硫酸的方法:102530889A[P].2012-02-23.
本文编辑:张瑞
Effect of SiO2and Kaolin Impurities on Decomposition of Phosphogypsum by Iron Pyrite
WANG Jian,YANG Xiushan*,YANG Lin,WANG Xinlong,ZHANG Zhiye
Schoolof Chemical Engineering,Sichuan University,Chengdu 610065,China
A new method of decomposing phosphogypsum(PG)with pyrite was proposed for solving the problem of PG resource utilization.And with the purpose of realizing the industrialization of the method,the effect of SiO2and Kaolin impurities on the decomposition process of PG was explored.Equilibrium phase diagram of FeS-CaSO4system was calculated with adding silicon dioxide or Kaolin by using thermodynamic calculation software of Factsage7.0.The possible existing side reactions were discussed considering the influence of impurities on the reaction system.Then experiments of influence of impurities on the decomposition process were conducted.And the analysis of SO3and X-ray Diffraction of products were carried out.The results show that CaSO4can react with FeS in lower temperature region through adding SiO2or Kaolin as impurities.The desulfurization rate of reaction system is improved,and the decomposition rate of CaSO4also increases with impurities contents increasing.Thus,the study results are contributed to the application of the sulfuric acid production process of PG decomposition by iron pyrite.
impurities;silicon dioxide;kaolin;iron pyrite;PG
TQ111.1
A
10.3969/j.issn.1674-2869.2017.02.005
1674-2869(2017)02-0127-07
2016-12-30
国家高技术研究发展计划(863计划)(2011AA06A106)
王戬,硕士研究生.E-mail:15208188847@163.com
*通讯作者:杨秀山,博士,副教授.E-mail:yangxs@scu.edu.cn
王戬,杨秀山,杨林,等.二氧化硅和高岭土杂质对硫铁矿分解磷石膏的影响[J].武汉工程大学学报,2017,39(2):127-133.
WANG J,YANG X S,YANG L,et al.Effect of SiO2and Kaolin impurities on decomposition of phosphogypsum by iron pyrite[J].Journal of Wuhan Institute of Technology,2017,39(2):127-133.

