微波辅助磁性固体酸催化纤维素水解的研究∗
李学琴 李翔宇 时君友 段喜鑫 雷廷宙
我国丰富的生物质资源由于成本低、可再生、可循环等诸多优点,被用作制备许多高价值化学品的原材料。在过去的几十年里,纤维素的水解研究己成为有效利用木质纤维素生物质的一大热点研究方向[1]。纤维素传统的水解方法有很多,如:稀酸水解[2]、浓酸水解[3]、碱水解[4]等,但在水解过程中都存在着对设备的腐蚀性大、酸碱回收困难、水解条件苛刻、安全性不高等诸多问题。因此,各种新型的方法如固体酸催化水解[5,6]、酶催化水解[7]以及模拟酶催化水解[8]和超临界水水解[9]等正在逐步走向主体地位;酶催化水解是最有前途的水解技术之一[10],但其分离过程十分复杂;超临界水解停留时间较短,纤维素水解不完全[11];固体酸催化是多相催化水解,在催化水解过程中固体酸和水不溶性纤维素之间的传质阻力会降低水解效率。为了解决上述一系列问题,许多学者研究了离子液体水解纤维素[12],但其较高的黏度和昂贵的成本给纤维素水解的研究带来了更多困难。此外,环境和能耗问题也制约着许多技术方法的具体应用。因此在温和条件下,尤其是在低温和中性溶液条件下高效和高选择性的纤维素水解绿色化技术和方法成为重要的研究方向。微波是一种频率在300 MHz至300 GHz频段的电磁波[13]。近年来,微波辅助作为一种环境友好过程促进有机反应的使用已经越来越引起各界学者的关注[14]。基于以上问题,笔者以生物质基磁性固体酸作为催化剂,利用微波辅助相结合的方法对纤维素进行水解,通过调节水解时间、水解温度、纤维素与催化剂量的比例和微波功率优化纤维素水解的工艺条件。这不仅解决了催化剂在水解反应之后,分离回收困难的问题,而且微波辅助加热促进了纤维素溶解,避免了温度和压力过高造成的不安全性问题;同时,促进纤维素完全水解能起到节约资源的作用。
1 试验
1.1 材料与设备
生物质,吉林省木质材料科学与工程重点实验室;微晶纤维素,天津市瑞金特化学品有限公司;浓硫酸,烟台市双双化工有限公司;苯酚,天津市大茂化学试剂厂;葡萄糖,天津市瑞金特化学品有限公司;均为分析纯。FeSO4·7H2O,沈阳市华东试剂厂;Fe2(SO4)3·9H2O,天津市永大化学试剂有限公司。800型离心机,上海手术器械工厂;AB204-N型电子分析天平,常熟市双杰测试仪器厂;721型可见光分光光度计,上海精密科学仪器有限公司;COOLPEX-E灵动型微波化学反应仪,上海屹尧仪器科技发展有限公司;EQUINOX55型红外光谱,德国Bruker公司。
1.2 试验方法
1.2.1 生物质基磁性固体酸催化剂制备
生物质基磁性固体酸催化剂的制备分为三大块:生物质基前驱体的制备、磁性Fe3O4颗粒的制备以及磁性Fe3O4颗粒与生物质基前驱体的负载。具体流程如下:以生物质为原料在N2保护条件下于549 ℃的恒温管式炉中碳化13 h,将碳化之后的黑色固体产物置于121 ℃的恒温油浴锅内磺化6 h,制得生物质基前驱体;将FeSO4·7H2O和Fe2(SO4)3·9H2O按7∶11 的比例混合均匀,利用永磁铁进行沉降后水洗干燥,制得磁性Fe3O4颗粒;然后按照1∶2的质量比将生物质前驱体和磁性Fe3O4颗粒混合,置于1 mol/L的H2SO4溶液中浸泡24 h,抽滤,烘干,在500 ℃下于马弗炉中高温煅烧3 h,得到生物质基磁性固体酸催化剂; 其制备的具体试验流程及催化剂特性[15]如图1所示。
1.2.2 微波辅助纤维素水解
在微波反应三口烧瓶中加入生物质基磁性固体酸催化剂、纤维素及一定比例的蒸馏水,通过调整水解时间、水解温度、微波功率以及催化剂的量,直至充分反应;反应结束后,取出三口烧瓶,冷却,倒出反应液并量取反应液的体积,定容,然后用苯酚-硫酸法测滤液中还原糖得率;根据文献[16],苯酚-硫酸法测定还原糖试验过程如下:

然后,再用比色法测定还原糖得率,其原理如图2,水解反应装置及纤维素水解机理如图3所示。
1.2.3 单因素试验设计
以还原糖得率为指标,分别考察水解时间(5、10、20、30、40 min及50 min),水解温度(50、60、70、80 ℃及90 ℃),催化剂与纤维素的质量比(0.5∶1、1∶1、2∶1、3∶1、4∶1)以及微波功率(300、400、500、600 W及700 W)4个因素对纤维素水解的影响。
1.2.4 正交试验的设计
在单因素试验的基础上,利用水解时间、水解温度、纤维素与催化剂的质量比、微波功率4个因素设计L9(34)正交试验,因素水平表见表1,通过还原糖得率考察纤维素水解的最佳工艺条件;同时比较微波辅助下生物质基磁性固体酸催化纤维素水解与传统加热方式下纤维素水解的性能。
1.2.5 红外光谱分析(FT-IR)
将样品与填充物KBr以1∶100的比例进行混合,用研钵粉碎,压片,压强为10 MPa,约3min左右,压好后的压片应呈完整透明状;利用德国Bruker公司的EQUINOX55型红外光谱(FT-IR)在波数为400~5 000 cm-1内进行扫描,采集数据。

图1 生物质基磁性固体酸催化剂的制备及特性Fig. 1 Preparation and characteristics of biomass based magnetic solid acid catalyst

图2 苯酚-硫酸法测定还原糖原理Fig.2 Determination principle of reducing sugar by phenol-sulfuric acid method
2 结果与讨论
2.1 单因素试验
2.1.1 有无催化剂对纤维素水解性能的影响

图3 纤维素水解机理图及微波反应装置Fig. 3 Cellulose hydrolysis mechanism and microwave reaction device
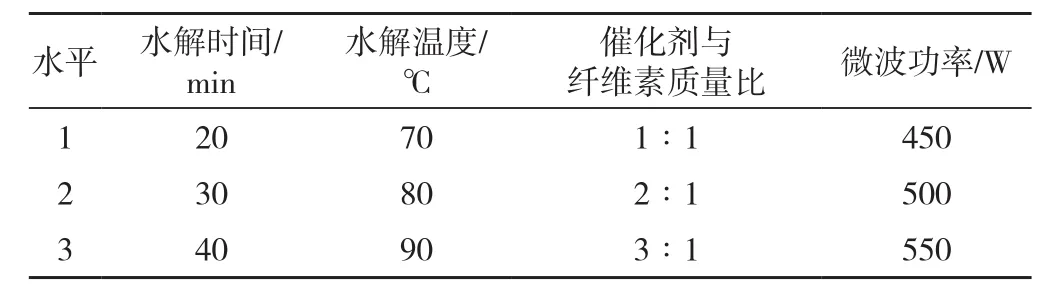
表1 因素水平表Tab.1 Factor levels table
在水解温度60 ℃,水解时间30 min ,微波功率300 W的条件下,对纤维素进行水解反应,考察催化剂对纤维素水解反应的影响。由图4可知,在没有生物质基磁性固体酸催化剂存在的条件下,纤维素水解所得还原糖得率基本在10%~12%之间;当加入催化剂与纤维素的比例为2∶1时,还原糖得率明显增加了大约3倍左右,说明生物质基磁性固体酸催化剂在纤维素水解中起到了很重要的作用。

图4 有无催化剂对纤维素水解的影响Fig. 4 Effect of catalyst on the cellulose hydrolysis
2.1.2 催化剂的量对纤维素水解性能的影响
在水解温度60 ℃,水解时间30 min ,微波功率300 W条件下,考察催化剂与纤维素加入量的比例(0.5∶1、1∶1、2∶1、3∶1、4∶1)对纤维素水解反应的影响,通过测定水解液中还原糖得率考察催化剂量的影响。由图5可知,随着催化剂量的增加,还原糖得率逐渐增大,直到纤维素与催化剂量的比例为2∶1左右,还原糖得率开始有微小幅度的下降,紧接着逐渐平稳直至不变,说明在此处纤维素已经基本水解完全。所以,选择在催化剂与纤维素的比例为1∶1~3∶1时进行正交试验。
2.1.3 水解时间对纤维素水解性能的影响
在水解温度60 ℃,微波功率300 W,催化剂与纤维素的比例为2∶1,分别水解5、10、20、30、40 min及50 min,通过测定水解液中还原糖得率考察水解时间对纤维素水解性能的影响。由图6可知,随着水解时间的增加,还原糖得率呈大幅度的增加趋势;当水解增大到20 min时还原糖得率为35.8%,继续延长水解时间还原糖得率增加的趋势开始变小,直至水解时间为30 min时,还原糖得率达到最大为37.8%,主要是因为随着反应的进行,反应物纤维素浓度的降低和还原糖得率的增加使物质之间产生了抑制作用,导致还原糖得率增加缓慢;继续延长水解时间,还原糖得率开始下降,这说明在水解时间为20~30 min内纤维素基本水解完全,而过长的水解时间使反应系统中发生了二次反应,导致还原糖得率下降。所以,选择水解时间20~40 min进行正交设计。
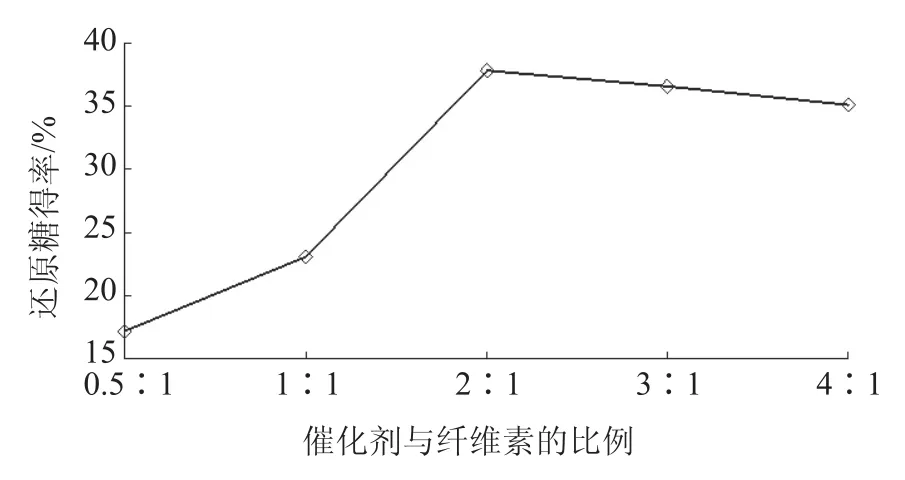
图5 催化剂量的影响Fig. 5 Effect of catalyst amount
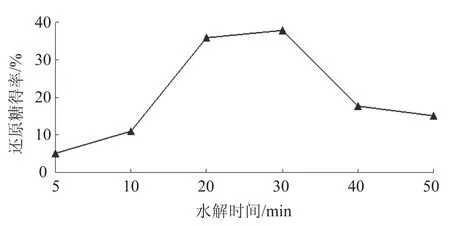
图6 水解时间的影响Fig. 6 Effect of hydrolysis time
2.1.4 水解温度对纤维素水解性能的影响
选择催化剂与纤维素的比例为2∶1,反应时间为30min,微波功率300 W,分别在不同水解温度下(50、60、70、80℃及90℃)水解纤维素,以水解纤维素所得还原糖得率为指标,考察水解温度对纤维素水解性能的影响。由图7可知,当水解温度在50~70 ℃时,随着温度的逐渐上升,还原糖得率上升缓慢,说明此温度范围对纤维素水解性能的影响并不重要;在70 ℃之后,随着温度的上升,还原糖得率有了明显的增大,但是当水解温度达到80 ℃(此时,还原糖得率为50.95%)之后,随着水解温度的继续上升,还原糖得率开始下降;这主要是因为当开始温度很低时,纤维素分子键没有被断开;随着温度的继续升高,纤维素逐渐被完全分解;当继续升高温度时,过高的温度使得糖苷键被破坏断裂,导致还原糖得率开始下降。所以选择在70~90 ℃进行正交设计。
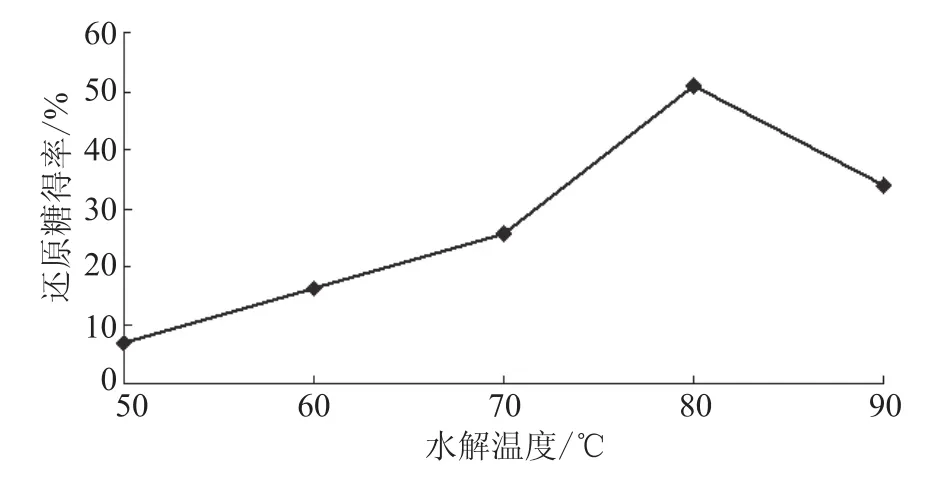
图7 水解温度的影响Fig. 7 Influence of hydrolysis temperature
2.1.5 微波功率对纤维素水解性能的影响
选择催化剂与纤维素的比例为2∶1,水解温度80 ℃,分别在不同微波功率300 、400 、500 、600 、700 W下水解30 min,通过测定水解液中还原糖得率考察微波功率对纤维素水解的影响。由图8可知随着微波功率的上升,还原糖得率呈大幅度的上升趋势,当微波功率达到500 W左右时,还原糖得率达到最大为45.9%;继续增大微波功率,还原糖得率开始逐渐下降,这主要是因为过高的微波功率容易使纤维素在水解过程中的中间产物直接降解,同时还使还原糖降解导致还原糖得率下降。所以,选择450~550 W进行正交试验。

图8 微波功率的影响Fig. 8 The influence of microwave power
2.2 正交试验结果及分析
由表2可知,微波功率R=7.02,催化剂量R=6.03,水解时间R=3.54,水解温度R=2.62;所以在纤维素水解过程中,各因素对微波辅助纤维素水解的影响主次顺序为:微波功率>催化剂量>水解时间>水解温度;微波辅助生物质基磁性固体酸催化纤维素水解的最佳工艺条件为:水解时间(A)为30 min,水解温度(B)为80 ℃,催化剂与纤维素量的比例(C)为2∶1,微波功率(D)为450 W,最佳组合为A2B2C2D1。在最佳条件下催化纤维素水解,得到还原糖得率为57.4%。通过试验研究,与传统加热方式下纤维素水解相比[17],微波辅助生物质基磁性固体酸催化纤维素水解,不仅解决了纤维素在水中的难溶性问题,而且有效地提高了纤维素水解效果,节约了资源,得到了高收率的还原糖;同时,与在高压反应釜催化纤维素水解相比[18],经选择性加热后纤维素能水解完全,避免了因温度、压力过高造成的不安全性问题。

表2 极差分析结果Tab. 2 Result of orthogonal test
2.3 FT-IR红外光谱分析
为表征微波辅助生物质基磁性固体酸催化纤维素是否水解完全,对微晶纤维素和微晶纤维素水解后的残渣进行红外光谱分析,其结果如图9。在3 700~3 300 cm-1处的吸收峰属于O—H键的伸缩振动,1 500~1 300 cm-1处的吸收峰属于C—H键的弯曲振动,1 200~1 000 cm-1处的吸收峰属于C=C 伸缩振动。经过分析,生物质基磁性固体酸催化微晶纤维素水解后的残渣基本结构与微晶纤维素相比发生了很大的改变,3 700~3 300 cm-1、1 500~1 300 cm-1、1 200~1 000 cm-1处的特征吸收峰[19]明显减弱甚至消失,并在1500~1300 cm-1处C=C伸缩振动峰强度明显减弱,表明C=C在残渣中的比例明显下降,说明微晶纤维素通过微波辅助生物质基磁性固体酸催化水解完全,为纤维素水解提供了新的方法和依据。

图9 原料及水解残渣的红外光谱图Fig. 9 Infrared spectra of raw materials and hydrolysis residue
3 结论
笔者利用实验室自制的生物质基磁性固体酸作为催化剂,通过单因素试验和正交试验优化微波辅助生物质基磁性固体酸催化纤维素的最佳工艺条件:水解时间为30 min,水解温度80 ℃,微波功率450 W,催化剂与纤维素的比例为2∶1,在该条件下催化纤维素水解所得到的还原糖得率为57.4%;4个因素对纤维素水解影响的主次顺序为:微波功率>催化剂量>水解时间>水解温度;通过红外光谱分析表明,微波辅助生物质基磁性固体酸催化剂使纤维素水解完全,不仅解决了纤维素在水中的难溶性问题,而且有效地提高了纤维素水解效果,节约了资源,得到了高收率的还原糖;由于微波加热具有选择性,经选择性加热后纤维素能水解完全,避免了因温度、压力过高造成的不安全性问题;同时,由于所用催化剂具有磁性特性,反应后易于水解残渣分离。微波辅助生物质基磁性固体酸催化纤维素水解的机理将是下一步研究的重点。
[1]Cantero D A, Bermejo M D, Cocero M J. High glucose selectivity in pressurized water hydrolysis of cellulose using ultra-fast reactors[J].Bioresource Technology, 2012, 135(3):697-703.
[2]Jalak J, Kurašin M, Teugjas H, et al. Endo-exo synergism in cellulose hydrolysis revisited[J]. Journal of Biological Chemistry, 2012, 287(34):28802-28815.
[3]Kontturi E, Vuorinen T. Indirect evidence of supramolecular changes within cellulose microfibrils of chemical pulp fibers upon drying[J].Cellulose, 2009, 16(1):65-74.
[4]Gunarathne D S, Mueller A, Fleck S, et al. Gasification Characteristics of Hydrothermal Carbonized Biomass in an Updraft Pilot-Scale Gasifier[J]. Energy & Fuels, 2014, 89(24):11814-11817.
[5]Suganuma S, Nakajima K, Kitano M, et al. Hydrolysis of cellulose by amorphous carbon bearing SO3H, COOH, and OH groups[J]. Journal of the American Chemical Society, 2008, 130(38):12787-12793.
[6]Onda A, Ochi T, Yanagisawa K. Selective hydrolysis of cellulose into glucose over solid acid catalysts[J]. Green Chemistry, 2008, 10(10):1033-1037.
[7]Mellmer M A, Sener C, Gallo J M R, et al. Solvent Effects in Acid-Catalyzed Biomass Conversion Reactions[J]. Angewandte Chemie, 2014,53(44):11872-11875.
[8]Zastrow M L, Peacock A F A, Stuckey J A, et al. Hydrolytic catalysis and structural stabilization in a designed metalloprotein[J]. Nature Chemistry, 2011, 4(2):118-123.
[9]Kulasinski K, Keten S, Churakov S V, et al. A comparative molecular dynamics study of crystalline, paracrystalline and amorphous states of cellulose[J]. Cellulose, 2014, 21(3):1103-1116.
[10]Singh L K, Chaudhary G, Majumder C B, et al. Explore the perennial Kans grass biomass for releasing reducing sugars and its optimization[J]. Der Chemica Sinica, 2011, 232(3): 273-285.
[11]冯冲, 陈伟, 杜风光, 等. 木质素降解酶对纤维素酶水解糖化的抑制作用[J]. 河南农业大学学报, 2011, 45(5):577-580.
[12] 廖崇静, 罗珊珊, 方涛, 等. 超临界CO2中磷钨酸催化稻秆纤维素水解[J].湖北农业科学, 2015(8):1950-1953.
[13]王晶晶. 离子液体中纤维素催化水解制备5-羟甲基糠醛[D]. 天津:天津大学, 2010.
[14]Banik S, Bandyopadhyay S, Ganguly S. Bioeffects of microwave-a brief review[J]. Bioresource Technology, 2003, 87(2):155-159.
[15]Li X Q, Li X Y, Wei Q, et al. Preparation of magnetic biomass-based solid acid catalyst and effective catalytic conversion of cellulose into high yields of reducing sugar[J]. Bioresources, 2015, 10(4):6720-6729.
[16]孟艳. 小麦秸秆源平菇多糖的制备及其生物学作用的研究[D]. 扬州:扬州大学, 2011.
[17]Chu C Y, Wu S Y, Tsai C Y, et al. Kinetics of cotton cellulose hydrolysis using concentrated acid and fermentative hydrogen production from hydrolysate[J].International Journal of Hydrogen Energy, 2011, 36(36):8743-8750.
[18] 王琼, 庄新姝, 余强, 等. 超低浓度马来酸催化水解纤维素的机理研究[J].可再生能源, 2011, 29(2):49-54.
[19]Prando D, Patuzzi F, Baggio P, et al. CHP Gasification Systems Fed by Torrefied Biomass: Assessment of the Energy Performance[J]. Waste &Biomass Valorization, 2014, 5(2):147-155.

