仙草多糖提取工艺条件优化研究
林慧霞++肖玉娟++黄华斌++傅奇++何少贵
摘 要 采用水提法浸提仙草,以仙草多糖的提取率为指标,研究料液比、浸提温度、浸提时间及浸提次数4个因素对其提取率的影響,并从中挑取合适的因素水平进行正交试验及SPSS分析。结果表明:在这4个因素中,对提取率影响最大的因素是浸提温度,然后是浸提时间,再次是料液比,最后是浸提次数;在料液比1:60、温度100 ℃、浸提时间3 h的最优条件下,仙草多糖的提取率高达17.89 %,此时仙草多糖的含量为44.13 %。
关键词 仙草多糖 ;水提法 ;正交试验 ;SPSS分析
中图分类号 S31
Abstract In this paper, using water extracted the Mesona Blume. That were considered the influence of Mesona Blume polysaccharide extraction rate on the four factors for material/liquid ratio, extraction temperature, extraction time and extraction times as index of Mesona Blume polysaccharide extraction rate. Picked and chose the appropriate level factors orthogonal test on SPSS analysis. The experimental results showed that: In these four factors, the largest factor affecting polysaccharide extraction rate was extraction temperature, followed by extraction time and material/liquid ratio, and finally was the extraction times. When the conditions were the material/liquid ratio for 1: 60, the extraction temperature for 100 ℃, the extraction time for 3 h, the yield of Mesona Blume polysaccharides was as high as 17.89%, and Mesona Blume polysaccharide content was 44.13%.
Key words polysaccharides of Mesona Blumes ; water extraction ; orthogonal test ; SPSS analysis
仙草(Mesona Blume)也称仙人草、薪草等,具有医食同源之效[1]。目前中国有3种,大部分生于中国的华南、华东及西南地区,其中江西、福建、广东、广西等地盛产,其次在印度尼西亚、印度和马来西亚等地也有生长[1]。
仙草中含有丰富的仙草多糖,仙草多糖是一种具有一定黏性的可溶性碳水化合物,主要存在于叶、根、茎中,具有很好的抗氧化、抑菌作用和特殊的凝胶性质[2-5]。在医药的其他方面也有广泛的应用[6]。关于仙草多糖的常规提取方法主要有:溶剂浸提法、微波法、超声波法、酶提取法、超高压法等[7]。于辉等[8]、蒋文明等[9]、冯翠兰等[10]分别采用不同的方式对仙草多糖的提取进行了研究。不同的提取方式[7]对结果的影响不同,如碱提法会比较严重的影响多糖的风味;酶辅助提取法不会使仙草胶产生不良风味,但提取间较长。本实验采用水提法提取福建省武夷山特色植物仙草中的仙草多糖,再采用单因素及正交试验来确定最优的提取条件,旨在为仙草后续研究及其相关应用提供一定的理论参考价值,也为福建省仙草行业的发展奠定一定的理论基础。
1 材料与方法
1.1 材料
原料:仙草取自福建省武夷山梅下古民居。
仪器:分光度计(721型)、超低温冰箱(ULT-1386-3-V)、旋转蒸发仪(EYELA型)、真空冷冻干燥机(18N-80)、水浴锅(华普达HH-2)。
试剂:苯酚(AR)、浓硫酸(AR)、葡萄糖(AR)。
1.2 方法
1.2.1 仙草粗多糖的提取
称取已粉碎好的仙草粉末5 g,加100 mL蒸馏水,沸水浴加热搅拌回流提取2 h,离心过滤,旋转蒸发仪旋转浓缩溶液醇沉,而后冷冻干燥24 h,获得仙草粗多糖粉末。
1.2.2 仙草多糖含量的测定
(1)多糖含量的测定:移取待测试样1 mL于试管中,接着移3 %的苯酚0.5 mL, 再移4.0 mL的浓H2SO4,并且用纯水做空白对照实验,30 min后在490 nm(经过全波长扫描发现在此波长处具有最大的吸光度)处测定吸光度,采用标准曲线法计算含量。
(2)标准曲线的测定:称取恒重的葡萄糖对照品,配制一系列梯度标准溶液,采用苯酚-浓硫酸法[11-12]测定吸光度,制作标准曲线。
1.2.3 单因素试验
以仙草多糖提取率为指标,研究料液比、浸提温度、浸提时间、浸提次数4个因素的影响,每个参数选5个数据水平,每个水平做3个平行样,取平均值。
1.2.4 正交试验
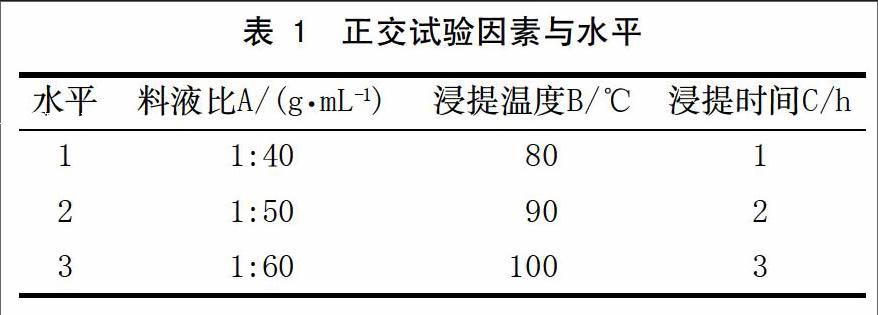
从单因素参数的分析结果看,选择3个主要因素,每个因素中选择3个比较适当的实验数据进行L9(34)正交试验(表1)。
2 结果与分析
2.1 标准曲线
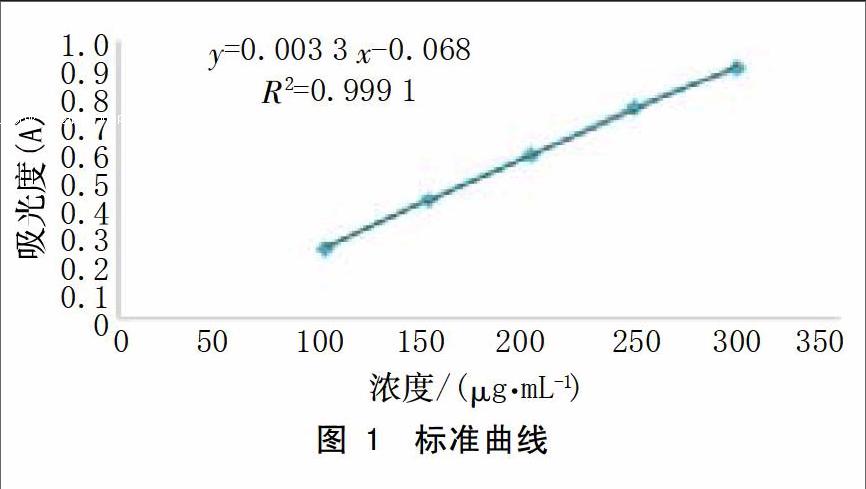
苯酚-硫酸法测定葡萄糖作标准曲线,结果见图1。从图1中可看出,在线性范围为100-300 μg/mL内具有良好的线性关系,在最佳提取条件下得到的多糖含量为44.13 %。
2.2 仙草多糖提取单因素试验
2.2.1 料液比因素
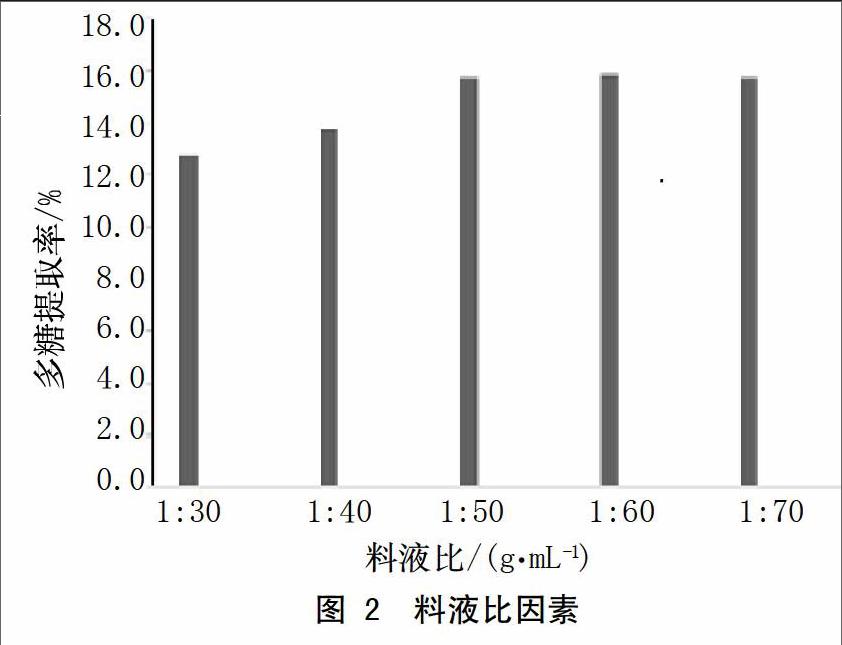
分别称5份5 g的干燥仙草粉末,当浸提溫度90 ℃、浸提1 h、浸提1次时,在料液比分别为1:30、1:40、1:50、1:60、1:70(g/mL)的条件下对仙草粉末进行提取,结果见图2,当提取溶剂水的缓慢增加时,仙草多糖提取率也逐渐的提高,当料液比达1:50时,提取溶剂的再次增加,多糖的提取率几乎不变。
2.2.2 浸提温度因素
分别称取5份5 g的干燥仙草粉末,当料液比1:40、浸提1 h、浸提1次时,而温度分别为50、70、80、90、100 ℃对仙草粉末进行浸提,结果见图3。由图3可知,浸提温度对仙草多糖提取率具有比较大的影响,温度越高,多糖的提取率也越高;当超过80 ℃时,温度的再次升高,多糖的提取率也在增加,并且增加的趋势非常明显。
2.2.3 浸提时间因素
平行称取5份5 g干燥仙草粉末,其他因素不变,设定浸提时间分别为1、2、3、4、5 h,对仙草多糖进行浸提,提取结果见图4。从图4中可看出,浸提时间对其提取率同样具有比较大的影响,在1-2 h时,提取率显著增加;而超过2 h后,提取率加大的幅度有所下降;当达到3 h时,浸提时间再增长,其提取率不再增加反而总体趋于稳定趋势。
2.2.4 浸提次数因素
其他因素不变,设定浸提次数分别为 1、2、3、4、5次,对仙草进行浸提,结果见图5,在一定浸提次数内,提取率会随着提次数的增加而增加,但当超过一定的次数后,多糖的提取率会随着提取次数的增加而降低,其主要原因可能是因为浸提次数太多,合并的滤液也有所增加,大量的滤液在浓缩时会造成多糖的损失,因此多糖提取率反而有所降低。
2.3 正交试验
依据单因素数据的分析,结果发现对仙草多糖提取率影响比较大的因素主要有料液比、浸提温度及浸提时间,因此选择这3个单因素进行正交试验,选择L9(34)进行实验,其SPSS分析结果见表2。
从表3中可看出,复相关系数R2调整之后为0.991,表明仙草多糖提取率的变化有99.1 %的可能性是来源于所选变量的变化引起的。也说明此次试验误差比较小、稳定性强、可操作性好,能较好的描述所选择的各个因素与提取率两者之间的实际影响关系。从P值的大小中可看出,浸提温度B的P值为0.003,P<0.01,说明浸提温度对仙草多糖的提取率具有极显著性影响;浸提时间C的P值为0.048,P<0.05,表明浸提时间的长短对仙草多糖的提取率具有显著性影响;而料液比A的P值为0.125,P>0.05,则说明料液比对多糖的提取率无显著性影响。综上所述,对仙草粗多糖提取率影响最大的因素是浸提温度,其次是浸提时间,最后是料液比。
由表2和图6可知,浸提仙草多糖的最佳工艺为A3B3C3,即料液比为1:60,提取温度为100 ℃,提取时间为3 h。在此最优的提取条件下,能得到仙草多糖提取率的理论值达18.17 %。
为了验证正交试验的真实性,在先前得到的最优提取条件下重新提取实验,测得实际仙草多糖的提取率为17.89 %,与理论预测值比较接近,并且与陈锦鹏等[1]的测定结果相似。同时说明用此种方法获得的浸提优化条件数据真实精确,可有一定的理论和实用参考价值。
3 结论
本试验采用水提法浸提仙草,以仙草多糖的提取率为指标,研究提取时的料液比、浸提温度、浸提时间及浸提次数4个因素对其提取率的影响;再用L9(34)正交法探测几个因素对多糖提取率的影响。结果表明,对仙草多糖提取率影响最大的因素是浸提温度,其次是浸提时间,再次是料液比。正交试验及SPSS分析结果得出的浸提最佳条件为:浸提温度100 ℃、料液比1:60、浸提时间3 h,在此条件下实际测得其提取率为17.89 %,与正交法得到的理论值18.17 %比较接近。同时在此最佳提取条件下多糖含量为44.13 %。
参考文献
[1] 陈锦鹏,林晓翠,王碧玉,等. 仙草多糖提取工艺研究[J]. 化学工程与装备,2009,38(3):1-3.
[2] 程伟伟,栗俊广,蒋爱民,等. 仙草多糖的研究进展及在肉品中的应用前景[J]. 肉类研究,2014,28(9):26-29.
[3] Hung C,Yen G. Antioxidant activity of phenolic compounds isolated from Mesona procumbens Hemsl[J]. Journal of Agricultural and Food Chemistry,2002,50(10):2 993-2 997.
[4] Lai L,Chou S,Chao W. Studies on the antioxidative activity of hsian-tsao(Mesona procumbens Hemsl)leaf gum[J]. Journal of Agricultural and Food Chemistry,2001,49(2):963-968.
[5] Yen G,Hung C. Effects of alkaline and heat treatment on antioxidative activity and total phenolics of extracts from hsian-tsao(Mesona procumbens Hemsl)[J]. Food Research International,2000,33(6):487-492.
[6] 谌国莲,孙远明,黄晓钰,等. 中国凉粉草资源的研究与利用[J]. 农牧产品开发,2000,21(5):6-8.
[7] 刘保财,陈菁瑛,黄颖桢,等. 仙草生产、研究现状与发展趋势[J]. 福建农业学报,2015,30(7):718-725.
[8] 于 辉,蓝宝华,邱桂平. 仙草胶提取方法比较研究[J]. 中国食品添加剂,2011,22(1):141-147.
[9] 蒋文明,李爱军,汪 辉. 微波辅助碱液提取仙草多糖[J]. 食品科学,2011,32(4):11-14.
[10] 冯翠兰,刘富来,董华强. 酶法提取仙草胶最佳工艺及不同产区仙草胶含量比较 [J]. 广东农业科学,2009,36(2):65-68.
[11] 周 超,谢明勇,万 茵,等. 车前子多糖的测定方法研究[J]. 分析实验室,2008,27(4):10-13.
[12] 林慧霞,聂少平,殷军艺,等. 大粒车前子多糖提取工艺优化及其理化性质测定[J]. 食品科学,2010,31(22):226-231.

