早期肝癌肝切除术后疗效与预后评估
陈 杰, 袁岱岳, 朱 斌
(南通大学第二附属医院 普外科, 江苏 南通, 226001)
早期肝癌肝切除术后疗效与预后评估
陈 杰, 袁岱岳, 朱 斌
(南通大学第二附属医院 普外科, 江苏 南通, 226001)
预后因素; 早期肝癌; 肝切除; 米兰标准
肝癌是全球常见的恶性肿瘤之一,肝癌发病率及死亡人数逐年增长,是第3大致死性癌症[1]。肝切除手术仍是肝癌治疗的主要方式。部分肝癌患者行肝切除的预后欠佳。本文回顾性分析南通大学第二附属医院普外科2006年1月—2014年12月收治的46例符合早期肝癌肝切除患者的临床资料,探讨影响患者术后预后的因素,现报告如下。
1 资料与方法
1.1 一般资料
收集南通大学第二附属医院普外科2006年1月—2014年12月收治的46例符合早期肝癌肝切除患者的临床资料。早期肝癌的纳入标准: ① 采用符合米兰标准的肝癌[2], 即单个肿瘤直径≤5 cm, 多发肿瘤不超过3个,且最大者直径≤3 cm; 无肝外转移及大血管浸润; ② 术后病理学均证实为肝细胞性肝癌。所有患者均达到根治性切除,即切缘阴性,切缘距肿瘤≥1 cm。随访数据通过电话随访、门诊随访、再次住院等获得。随访至2015年12月。
1.2 统计学分析
采用Kaplan-Meier法评估生存率。采用SPSS 17.0统计软件分析。对于与临床预后相关的临床危险因素单因素分析采用Log-rank检验,多因素分析采用将单因素分析有意义的因素引入COX回归模型分析。P<0.05为差异有统计学意义。
2 结 果
2.1 生存率及无瘤生存率
随访至2015年12月,术后肝内复发患者根据具体情况选择性行再次肝切除、经皮或者开腹射频消融、选择性肝动脉栓塞化疗等治疗。全组1、3及5年生存率分别为89.1%、69.0%, 49.2%, 1、3及5年无瘤生存率为82.1%、54.3%, 39.5%。
2.2 单因素分析
对下列指标进行单因素分析,包括年龄、性别、HbsAg+/-、Child分级、肝硬化、症状有无,肿瘤大小、AFP、术中失血量、肿瘤数目、微血管浸润、术后早期预防性TACE。术后早期预防性TACE指早期肝癌切除术后4~6周内预防性行肝动脉化疗栓塞术。结果显示,微血管浸润(P=0.004)、症状有无(P=0.042)、肿瘤数目(P= 0.045)及肿瘤大小(P=0.009)是影响早期肝癌患者术后长期生存的重要因素。见表1。
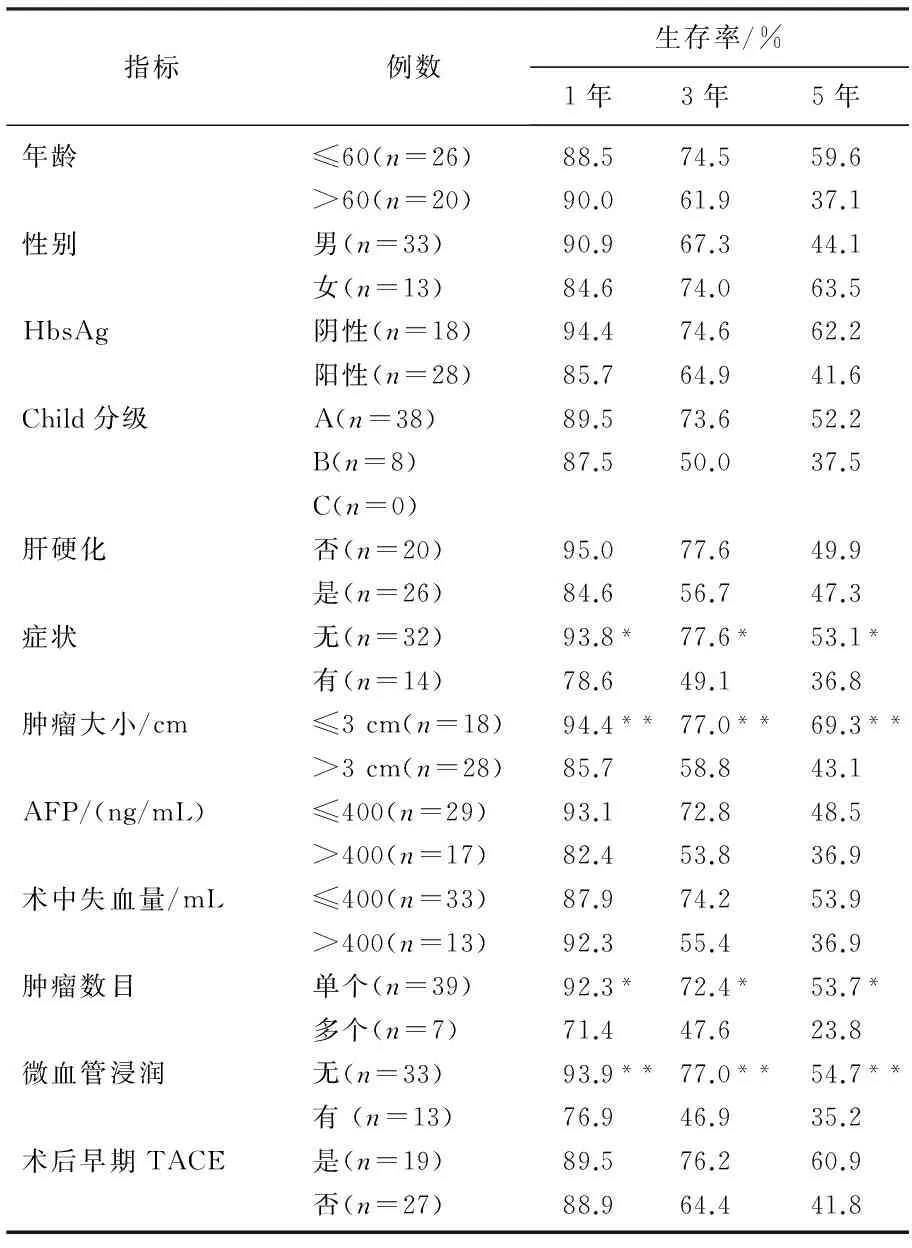
表1 单因素分析结果
与同一指标另一亚项比较, *P<0.05。
2.3 多因素分析
将单因素分析中有统计学意义的4个指标引入COX回归模型,结果显示,肿瘤大小及微血管浸润是影响本组早期肝癌患者术后长期生存的重要独立因素(P<0.05), 见表2。

表2 COX回归模型结果
3 讨 论
原发性肝癌的治疗方式有肝切除,肝移植, TACE, 射频消融,高能聚焦超声刀,全身化疗等,但肝癌患者的预后仍不够理想。肝切除及肝移植被认为是可能治愈肝癌的主要方式,由于肝源的缺乏以及肝移植技术等因素的限制,肝移植治疗早期肝癌无法广泛开展,目前肝切除仍是早期肝癌治疗的主要方式。有研究[3-4]表明,肝切除在治疗早期肝癌患者时, 5年生存率可以达到50%~70%。本研究对符合米兰标准的早期肝癌术后疗效及预后因素进行了分析,结果显示全组5年生存率可达49.2%。单因素分析结果显示,微血管浸润、症状有无、肿瘤数目及肿瘤大小是影响本组肝癌患者术后预后的重要因素。
肿瘤的复发和转移是影响肝癌患者肝切除术后生存率的主要因素之一,即使是那些行根治性切除的患者,肝切除后肝癌的复发率也很高[5]。肝癌患者术后复发的机制十分复杂。有学者[6]认为肿瘤大小与肝癌复发密切相关。肿瘤越大,门静脉癌栓及微血管浸润发生率越高,出现微小转移灶的可能性越大[7]。肿瘤微血管浸润被认为是影响肝癌患者术后复发及预后的重要因素[8], 更有研究[9]表明即使是在复发性肝癌再切除患者中,微血管侵犯仍是影响其复发及预后的重要因素。Du等[10]研究发现,即使是直径≤3 cm的早期肝癌,也有部分肿瘤发生微血管侵犯。本研究同样证实微血管侵犯及肿瘤大小是影响早期肝癌患者术后生存的独立因素,与患者预后密切相关。然而,肝癌微血管侵犯主要依靠术后镜下病理诊断,术前影像学等检查只能发现大血管侵犯,并不能有效预测和诊断微血管侵犯。术前更好的评估和诊断微血管侵犯,将有助于判断肝癌患者预后和选择合理的治疗方式。有学者[11]认为,肝癌微血管侵犯与肿瘤大小及血清AFP水平有关。近期也有学者期望寻找到更多的依据可以术前检测微血管侵犯,得到比较积极的结果[12]。Poté等[13]发现血清PIVKA-Ⅱ高表达是预测早期肝癌微血管侵犯的独立因素。相较于AFP, PIVKA-Ⅱ具有更高的敏感性及准确性,可以作为肝癌术前评估微血管侵犯的重要指标。但是, PIVKA-Ⅱ在部分肝硬化患者中同样升高。临床上仍缺乏特异性标记可以术前准确检测及判断微血管侵犯。
目前对肝癌术后患者预防性治疗主要依靠肝动脉栓塞化疗术,但其治疗疗效仍存在争议。有学者[14]认为术后早期行预防性肝动脉化疗肝动脉栓塞化疗术有助于提高肝癌患者生存率,本研究中单因素及多因素分析均未提示早期TACE治疗有助于提高早期肝癌生存率。究其原因为术后预防性TACE主要作用在于清除潜在扩散的肿瘤细胞及微小转移灶。本研究中选择早期肝癌患者,微小病灶转移相对于中晚期肝癌少见,同时早期肝癌术中对于肿瘤的挤压相对较小,医源性肿瘤细胞播散少见,因此本研究中肝癌术后早期预防性TACE并未明显增加患者术后生存率。由于早期肝癌患者数量的限制,本文未能进一步将早期肝癌患者中出现微血管侵犯的患者进行预防性TACE疗效分析。TACE术后存在一定的并发症,患者可能出现恶心呕吐、白细胞减少,甚至上消化道大出血、肝功能衰竭等严重并发症[15], 因此早期肝癌患者如没有提示高危复发因素,术后早期预防性TACE可能无法改善患者预后。
总之,早期肝癌患者术后5年生存率可达50%左右。早期肝癌术后疗效由多重因素决定,肿瘤大小及微血管浸润可能是影响早期肝癌预后的最重要因素,早期发现、早期治疗是提高肝癌患者预后的重要途径。
[1] Marrero J A. Multidisciplinary management of hepatocellular carcinoma: where are we today[J]. Semin Liver Dis, 2013, 33(Suppl 1): S3-10.
[2] Mazzaferro V, Regalia E, Doci R, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis[J]. N Engl J Med, 1996, 334(11): 693-699.
[3] Adam R, Bhangui P, Vibert E, et al. Resection or transplantation for early hepatocellular carcinoma in a cirrhotic liver: does size define the best oncological strategy[J]. Ann Surg, 2012, 256(6): 883-891.
[4] Gory I, Fink M, Bell S, et al. Radiofrequency ablation versus resection for the treatment of early stage hepatocellular carcinoma: a multicenter Australian study[J]. Scand J Gastroenterol, 2015, 50(5): 567-576.
[5] Umeda Y, Matsuda H, Sadamori H, et al. A prognostic model and treatment strategy for intrahepatic recurrence of hepatocellular carcinoma after curative resection[J]. World J Surg, 2011, 35(1): 170-177.
[6] Shim J H, Jun M J, Han S, et al. Prognostic nomograms for prediction of recurrence and survival after curative liver resection for hepatocellular carcinoma [J]. Ann Surg, 2015, 261(5): 939-946.
[7] McHugh P P, Gilbert J, Vera S, et al. Alpha-fetoprotein and tumour size are associated with microvascular invasion in explanted livers of patients undergoing transplantation with hepatocellular carcinoma[J]. HPB (Oxford), 2010, 12(1): 56-61.
[8] Yamashita Y, Tsuijita E, Takeishi K, et al. Predictors for microinvasion of small hepatocellular carcinoma ≤ 2 cm[J]. Ann Surg Oncol, 2012, 19(6): 2027-2034.
[9] Huang Z Y, Liang B Y, Xiong M, et al. Long-term outcomes of repeat hepatic resection in patients with recurrent hepatocellular carcinoma and analysis of recurrent types and their prognosis: a single-center experience in China[J]. Ann Surg Oncol, 2012, 19(8): 2515-2525.
[10] Du M, Chen L, Zhao J, et al. Microvascular invasion (MVI) is a poorer prognostic predictor for small hepatocellular carcinoma[J]. BMC Cancer, 2014, 14: 38.
[11] Kiriyama S, Uchiyama K, Ueno M, et al. Triple positive tumor markers for hepatocellular carcinoma are useful predictors of poor survival[J]. Ann Surg, 2011, 254: 984-991.
[12] Yamashita Y, Tsuijita E, Takeishi K, et al. Predictors for microinvasion of small hepatocellular carcinoma 62 cm[J]. AnnSurg Oncol, 2012, 19: 2027-2034.
[13] PotéN, Cauchy F, Albuquerque M, et al. Performance of PIVKA-II for early hepatocellular carcinoma diagnosis and prediction of microvascular invasion[J]. J Hepatol, 2015, 62(4): 848-854.
[14] 丁以锟, 吕维富, 周春泽, 等. 术后预防性肝动脉化疗栓塞对肝癌患者生存的影响及预后相关因素分析[J]. 介入放射学杂志, 2014, 23(4): 299-302.
[15] 陈玉强, 洪节约, 张雅雅, 等. 异甘草酸镁治疗肝癌动脉栓塞化疗肝损伤的临床研究[J]. 实用临床医药杂志, 2010, 14(17): 15-17.
2017-01-08
朱斌, E-mail: nantongzb19@163.com
R 735.7
A
1672-2353(2017)07-181-03
10.7619/jcmp.201707062

