AG490联合DDP对人卵巢癌SKOV3细胞增殖和凋亡的影响
马 戎,鲁 琰,顾巧玲
(1.西北民族大学医学院,甘肃 兰州 730000;2.甘肃省妇幼保健院,甘肃 兰州 730000)
AG490联合DDP对人卵巢癌SKOV3细胞增殖和凋亡的影响
马 戎1,鲁 琰2,顾巧玲1
(1.西北民族大学医学院,甘肃 兰州 730000;2.甘肃省妇幼保健院,甘肃 兰州 730000)
目的 探讨AG490联合DDP对人卵巢癌SKOV3细胞增殖和凋亡的影响,初步探讨JAK/STAT信号转导通路在卵巢癌侵袭调控中的作用机制。方法 卵巢上皮癌的细胞株SKOV3用AG490、AG490+DDP处理后,再用MTT法检测不同时间对SKOV3增殖的抑制作用,并用流式细胞仪分析各组细胞周期及细胞凋亡率随时间的变化情况。结果(1)MTT比色试验:AG490处理细胞后,同一时间点不同组的细胞增殖率两两比较,差异有统计学意义(P<0.05);不同时间点同一药物浓度组(除对照组外)两两比较,差异有统计学意义(P<0.05)。(2)流式细胞术分析发现,用AG490处理后,24小时就可看到明显的细胞凋亡峰,而联合用药组凋亡峰出现得更早(P<0.05)。结论(1)AG490能够抑制人卵巢癌SKOV3细胞的生长,细胞的增殖水平明显下降,细胞增殖抑制情况随AG490浓度的增强和作用时间的增加更加明显;AG490联合DDP效果更明显。(2)AG490作用于人卵巢癌SKOV3细胞后,可促进细胞的凋亡,而联合DDP效果更甚。(3)AG490可能是通过阻断STAT3蛋白的激活抑制JAK/STAT信号转导通路,从而抑制人卵巢癌SKOV3细胞的增殖能力,促进细胞凋亡。(4)AG490可以明显提高传统化疗药物DDP的疗效。
AG490;DDP;卵巢癌;SKOV3细胞
卵巢癌(ovarian cancer)是女性生殖系统常见的三大恶性肿瘤之一,占妇科肿瘤的25%,因卵巢位于盆腔深部,不宜早期发现,临床患者初诊70%~80%已是中晚期。以肿瘤细胞减灭术+铂类为基础的联合化疗是卵巢癌公认的最佳初治方案,但超过50%达到完全缓解的患者会出现肿瘤复发,5年生存率一直徘徊在20%~40%[1]。而再次化疗则要面对卵巢癌细胞对药物的不敏感和产生耐药性等问题,故卵巢癌的侵袭转移和化疗耐药始终是治疗的两大难点。本研究观察不同浓度AG490及AG490与DDP(顺铂)联合作用于人卵巢癌SKOV3细胞所引起的生物学效应,主要包括细胞增殖活性、侵袭转移的改变、凋亡以及与此相关的一些基因和蛋白质检测,从而研究JAK/STAT信号转导通路对卵巢癌SKOV3细胞增殖和凋亡的影响及作用机制,现介绍如下。
1 材料与方法
1.1 材料
选用人卵巢浆液性乳头状囊腺癌细胞SKOV3(兰州大学基础医学院实验中心馈赠),用含10%新生牛血清的RPMI-1640培养液培养,置于37℃、5%CO2培养箱培养,实验前换无血清RPMI-1640培养液培养12小时,使细胞同步化,取对数生长期细胞。
1.2 实验方法
1.2.1 MTT比色试验 将对数生长期的SKOV3细胞用0.25%胰蛋白酶和0.02%EDTA消化、吹打,制成细胞悬液浓度为4× 104/ml,取3块96孔培养板,每孔放细胞悬液200 μl,置于37℃、5%CO2饱和湿度培养箱内培养。分组:对照组,AG490 50 μmol/L组、AG490 100 μmol/L组、AG490 50 μmol/L+DDP 1 μg/L组、AG490 100 μmol/L+DDP 1 μg/L组,每组设8个平行孔。加药后继续置于37℃、5%CO2饱和湿度培养箱内培养,分别于加药后的12小时、24小时、48小时各取出一块96孔板,小心吸去每孔的上清液,并在每孔加入200 μl无血清的RPIM-1640及10 μl 5 mg/L的MTT,继续置于培养箱内培养4小时,取出后弃上清液,每孔加200 μl DMSO,并将96孔板置于微型振荡器上振荡10分钟。比色:用酶标仪测定每孔的吸光度值(A值),选取波长570 nm,用只加培养液未加细胞的空白孔进行标准调零,重复测量3次,取平均值。增殖率的计算[2]:细胞增殖率=1-(对照组A值-实验组A值)/对照组A值×100%。观察细胞生长被抑制的情况,包括细胞形态的改变、数目的变化、增殖的变化,计算AG490、AG490+DDP在不同浓度、不同作用时间点时SKOV3细胞的增殖率。
1.2.2 流式细胞凋亡分析 波长为488 nm,取对数生长期的细胞接种于25 ml的培养瓶。分组:对照组、AG490 50 μmol/L组、AG490 100 μmol/L组、AG490 50 μmol/L+DDP 1 μg/L组、AG490 100 μmol/L+DDP 1 μg/L组,每组设10个平行组,分别在加药后12小时、24小时、48小时收集各组的细胞,每个时间点每个组收集的样本数是5个。
1.3 统计学处理
2 结果
卵巢癌细胞株SKOV3正常状态下单层贴壁生长,呈长梭形。加入AG490药物培养后,细胞开始出现圆缩,细胞生长受抑制,凋亡率增加。
2.1 AG490、AG490联合DDP对SKOV3细胞增殖的影响
2.1.1 用显微镜观察细胞形态 显微镜下每日观察各组细胞数量、大小和形态学的变化。对照组:显微镜下见SKOV3细胞单层生长,细胞长梭形或多角形,胞核圆形或椭圆形,胞浆透亮。经AG490或AG490+DDP处理后,细胞胞体变圆,胞浆透亮度下降,颗粒感增强,部分细胞脱落呈悬浮状,并可见细胞碎片。上述变化随AG490作用时间的延长和药物剂量的增加而更加显著。
2.1.2 用MTT比色试验观察SKOV3细胞增殖被抑制的情况AG490和AG490联合DDP对SKOV3细胞的抑制作用在时间和浓度上比较,均存在显著性差异(P<0.05),见图1。

图1 AG490单用或联合DDP对SKOV3细胞增殖率的影响
在相同作用时间,用不同浓度的AG490处理后,与对照组相比,SKOV3细胞的生长均受到不同程度的抑制,表现为吸光度值A降低,增殖率降低。同一时间点不同组之间的细胞增殖率两两比较,差异均具有统计学意义(P<0.05);同一药物浓度组(除对照组外)在不同时间点的细胞增殖率两两比较,差异均具有统计学意义(P<0.05),见表1。
表1 AG490单用或与DDP联合治疗在不同时间点对人卵巢癌SKOV3细胞增殖率的影响(s,%)
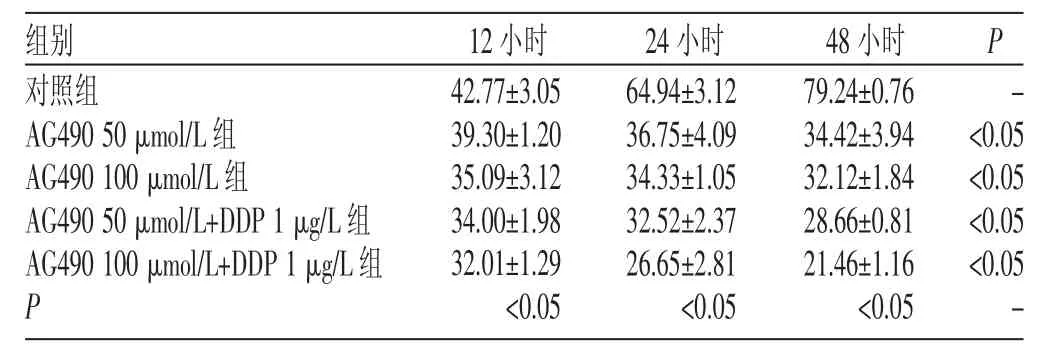
表1 AG490单用或与DDP联合治疗在不同时间点对人卵巢癌SKOV3细胞增殖率的影响(s,%)
组别对照组A G 4 9 0 5 0 μ m o l / L组A G 4 9 0 1 0 0 μ m o l / L组A G 4 9 0 5 0 μ m o l / L + D D P 1 μ g / L组A G 4 9 0 1 0 0 μ m o l / L + D D P 1 μ g / L组P 1 2小时4 2 . 7 7 ± 3 . 0 5 3 9 . 3 0 ± 1 . 2 0 3 5 . 0 9 ± 3 . 1 2 3 4 . 0 0 ± 1 . 9 8 3 2 . 0 1 ± 1 . 2 9<0 . 0 5 2 4小时6 4 . 9 4 ± 3 . 1 2 3 6 . 7 5 ± 4 . 0 9 3 4 . 3 3 ± 1 . 0 5 3 2 . 5 2 ± 2 . 3 7 2 6 . 6 5 ± 2 . 8 1<0 . 0 5 4 8小时7 9 . 2 4 ± 0 . 7 6 3 4 . 4 2 ± 3 . 9 4 3 2 . 1 2 ± 1 . 8 4 2 8 . 6 6 ± 0 . 8 1 2 1 . 4 6 ± 1 . 1 6<0 . 0 5 P -<0 . 0 5<0 . 0 5<0 . 0 5<0 . 0 5 -
2.2 用流式细胞术观察AG490单用或联合DDP对人卵巢癌SKOV3细胞凋亡的影响
在AG490不同药物浓度作用的12小时、24小时、48小时分别检测细胞的凋亡率,并用流式细胞术分析发现,AG490使SKOV3细胞周期阻滞于G2/M期,S期和G0/G1期细胞数减少,细胞凋亡率明显增加(P<0.05或P<0.01),见表2。增加AG490浓度后,24小时就可看到明显的凋亡峰,而在联用DDP时更明显,并与时间有明显相关性(P<0.05),见图2。
3 讨论
JAKs/STATs代表的是一条极其快速的从细胞外到细胞核的信号转导通路。胞浆中具有酪氨酸蛋白激酶活性的激酶(Just Another Kinase,JAK)和信号转导子及转录激活子(STAT)在细胞内与受体相结合,可完成从胞质到核内的信号转导。STATs家族重要成员STAT3在多种肿瘤组织与细胞系中异常激活,目前被确认为是癌基因[3]。AG490是酪氨酸激酶抑制剂,可以阻断JAKs激酶激活,进而抑制STAT3通路活化,但其复杂的信号通路远未完全明确。由于传统的化疗方案不能够完全抑制或消灭卵巢癌细胞生长[4],因此AG490与化疗药物的联合应用可能为卵巢癌的治疗提供新的有效途径。在本实验中,利用AG490来抑制JAK酶活性,并联合顺铂观察JAK酶被抑制后人卵巢癌SKOV3细胞增殖、生长凋亡的变化情况。AG490是一种人工合成的苯亚甲基丙二腈的脂类衍生物,结构类似酪氨酸,可以和酪氨酸激酶竞争受体结合位置,选择性地阻断JAK,从而阻断JAK/STAT信号转导。应用AG490作用于骨髓瘤细胞系U266[5],可通过抑制STAT3和DNA结合的活性来抑制STAT3活化与凋亡,具有抗肿瘤的作用。Burke等[6]发现,乳腺癌细胞系MAD-MB-468中,AG490可以抑制STAT3持续活化,诱导乳腺癌细胞凋亡,但AG490不能诱导正常乳腺细胞凋亡。Huang等[7]发现,STAT3高表达的卵巢癌细胞对顺铂及泰素均耐药,应用顺铂与AG490联合作用于细胞系MDAH2774,可以抑制其STAT3通路活化,促进细胞发生凋亡。万琪等[8]认为AG490可以间接阻断STAT3通路,使肿瘤细胞恢复对化疗药物的敏感性。以上这些证明AG490能够显著抑制肿瘤细胞的生长,诱导肿瘤细胞凋亡,而对正常细胞不产生明显的毒性作用,有望成为肿瘤分子治疗中的新药物。
表2 AG490单用或与DDP联合治疗在不同时间点对人卵巢癌SKOV3细胞凋亡的影响(s,%)
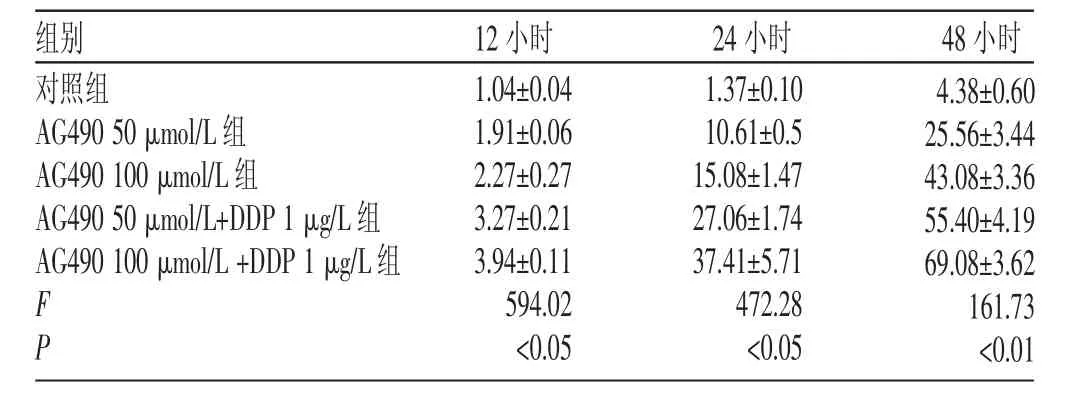
表2 AG490单用或与DDP联合治疗在不同时间点对人卵巢癌SKOV3细胞凋亡的影响(s,%)
组别对照组AG490 50 μmol/L组AG490 100 μmol/L组AG490 50 μmol/L+DDP 1 μg/L组AG490 100 μmol/L+DDP 1 μg/L组48小时F P 12小时1.04±0.04 1.91±0.06 2.27±0.27 3.27±0.21 3.94±0.11 594.02<0.05 24小时1.37±0.10 10.61±0.5 15.08±1.47 27.06±1.74 37.41±5.71 472.28<0.05 4.38±0.60 25.56±3.44 43.08±3.36 55.40±4.19 69.08±3.62 161.73<0.01
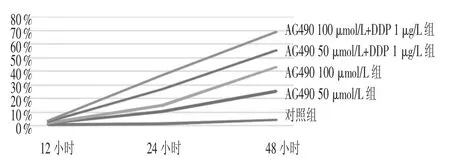
图2 AG490单用或联合DDP时SKOV3细胞的凋亡曲线
本实验用AG490单独或与DDP联合处理人卵巢癌SKOV3细胞,细胞生长均受到抑制,随着时间的延长和药物浓度的增加,这种抑制作用更加明显。从24小时起,AG490+DDP组对肿瘤的抑制作用显著强于任一单药组,产生明显的协同作用,且治疗结束AG490+DDP组抑瘤率、凋亡率显著高于AG490组(P<0.05),说明AG490与DDP联合应用对人卵巢癌SKOV3细胞的抑制作用较为理想,AG490可以增强DDP的药物敏感性,并能减轻顺铂的药物反应。同时流式细胞分析结果表明,AG490阻断STAT3通路,可使人卵巢癌SKOV3细胞凋亡,表明AG490单用或与DDP联合应用,可在卵巢癌的治疗中发挥有效、安全的抗肿瘤作用。
通过本研究结果可以推测,阻断JAK/STAT信号转导通路可能为卵巢癌的治疗提供新的思路,AG490有希望用于卵巢癌治疗,但细胞内信号转导通路是一个复杂的调节网络,各条通路之间存在各种交互联系,相互协同、相互制约,共同介导宫颈癌发生发展过程。因此,还需要大量的动物实验及大样本、多中心临床实验来进一步证实。同时,深入研究STAT3信号转导通路作用机制,有可能为发现高效、低毒的抗卵巢癌药物提供新的理论基础。
[1]曹泽毅,宋鸿钊,严仁英,等.中华妇产科学[M].北京:人民卫生出版社,1999.
[2]孟智超,李淑玲,肖建英.大黄素抑制卵巢癌SKOV3细胞增殖和抑制Survivin及XIAP的蛋白表达[J].基础医学与临床,2014,34(9):1254-1259.
[3]Garcia R,Bowman TL,Niu G,et al.Constitutive activation of Stat3 by the Src and JAK tyrosine kinases participates in growth regulation of human breast carcinoma cells[J].Oncogene,2001(20):2499-2513.
[4]Niu G,Wright KL,Huang M,et al.Constitutive Stat3 activity up regulates VEGF expression and tumor angiogenesis[J].Oncogene,2002,21(13):2000-2008.
[5]Bowman T,Garcia R,Turkson J,et al.STATs in oncogenesis[J].Oncogene,2000(21):2474-2488.
[6]Burke WM,Jin X,Lin HJ,et al.Inhibition of constitutively active STAT3 suppresses growth of human ovarian and breast cancer cells[J].Oncogene,2001,20(55):7925-7934.
[7]Huang M,Page C,Reynolds RK,et al.Constitutive activation of STAT3 oncogene product in human ovarian carcinoma cells[J].Gynecol Oncol,2000,79(1):67-73.
[8]万琪,褚艳侠,郑艾,等.维拉帕米对宫颈癌HeLa细胞株增殖和迁移的影响[J].四川大学学报:医学版,2011,42(1):78-81.
R195
B
1671-1246(2017)08-0105-03
兰州市科技局基金项目(2013-3-1)

