犬膝关节骨关节炎动物模型血清及关节液中IL-1、TNF-α和HA的分析
刘健莹,罗春海,刘瑶,郑程远,邹晓,徐美花,付世新
(黑龙江八一农垦大学动物科技学院,大庆 163319)
犬膝关节骨关节炎动物模型血清及关节液中IL-1、TNF-α和HA的分析
刘健莹,罗春海,刘瑶,郑程远,邹晓,徐美花,付世新
(黑龙江八一农垦大学动物科技学院,大庆 163319)
测定模型组与对照组犬的血清和关节液中IL-1、TNF-α和HA浓度,为验证犬膝关节骨关节炎(OA)不同阶段与其浓度变化是否具有临床意义。将36只犬随机平均分成为模型组和对照组,模型组采用前十字韧带切断法建立犬膝关节骨性关节炎模型,对照组只切开关节囊不切断前十字韧带。造模后第4、8、12周分别采集各组血清和关节液样品,用ELISA方法定量测定各项指标浓度。结果在第4、8、12周模型组与对照组IL-1、TNF-α和HA浓度比较分别差异显著,具有统计学意义P<0.05。随着模型组犬骨性关节炎的加重,犬关节液和血清中IL-l、TNF-α的浓度均呈逐渐升高趋势,犬关节液中HA浓度呈逐渐升高,犬血清中HA的浓度呈下降。说明犬膝关节骨关节炎模型组血清及关节液各成分变化与OA的致病机制密切相关,能作为反应OA病程的临床指标。
犬;IL-1;TNF-α;HA;膝关节骨关节炎
骨关节炎(Osteoarthritis,OA)是犬众多疾病中常出现的一种疾病。据调查显示有20%的中年犬和90%的老年犬患有1个或多个关节的OA[1]。由于OA是一个普遍存在的问题,兽医需要一种尽早诊断疾病的精确方法。在骨关节炎疾病中,关节液的组成成分及理学性质均发生变化,细胞因子含量的变化可以引发关节软骨及滑膜出现不同程度的损伤,其中最重要的细胞因子白介素-1β(IL-1β)和细胞肿瘤坏死因子-ɑ(TNF-ɑ)是炎性反应的调节剂,可使骨关节炎病理过程中的软骨基质降解和关节软骨退变[2]。滑液中透明质酸(HA)可润滑关节和有助于限制炎症,为减缓疼痛和软骨退化充当减震器,并使关节以光滑几乎无摩擦的方式移动[3]。犬OA的诊断常见于中后期和不可逆的阶段,治疗只是减轻疼痛和延缓病情发展的一个治标不治本的方式。通过科学方法对犬OA进行的早期诊断、预防和治疗,使犬OA的治愈变得更为现实。相关研究表明,OA发病时血清和关节液生化数值均有所上升或下降,与软骨损伤密切相关[2]。所以实验选择犬血清和关节液为研究对象。
1 材料与方法
1.1 实验动物及分组
实验选取36只健康普通杂种犬,平均体重23.3 kg,年龄范围1~3岁。实验犬有单独饲养的笼子,每天早晚定时进食,自由饮水。并允许在研究开始之前有一个适应期之后开始实验。按照随机和重复的原则,将36只家犬随机分为6组,4周、8周和12周对照组;4周、8周12周模型组。
1.2 主要试剂及仪器
ELISA试剂盒购买与上海古朵生物科技有限公司,离心机,海尔的电冰箱,2 mL,5 mL无菌针管,真空采血管,盐水,移液器,移液器枪头,头孢曲松钠,陆眠宁II。
1.3 实验方法
1.3.1 模型的制备
犬骨关节炎模型的制备:参考以往诱导成功率高,改良后稳定性好的十字韧带切断法,均取家犬右侧膝关节按前十字韧带切断法手术造模,用舒泰溶液按每0.2 mL·kg-1体重剂量静脉给药麻醉,将犬左侧卧后四肢固定于手术台上,用电剪将右后肢膝关节手术区域剃毛备皮,常规消毒皮肤做术前准备。皮肤切口与膝关节屈曲处关节囊内侧髌旁,逐层切开进入关节腔后,将髌骨翻向膝关节外侧,屈曲膝关节,找到前十字韧带切断后,即可做前后抽屉试验证明前十字韧带断裂。随后用生理盐水冲洗关节腔,逐层缝合关节囊和肌肉筋膜组织,缝合皮肤切口。对照组实验犬手术操作同上,但是不切断前十字韧带。术中过程中要避免手术器械损伤软骨、滑膜、肌肉及软组织。手术一侧肢体不固定,自由活动,术后予各以头孢曲松钠50 mg·kg-1抗感染每天1次,连续皮下注射5 d,密切观察伤口愈合情况,防止伤口感染和其他并发症。自造模日起,每日早晚两次室内强迫驱赶家犬跑动30 min。
1.3.2 血液样本采集与保存
在造模后4周、8周和12周,使用5 mL注射器采集模型组及对照组犬后肢隐静脉血液,置入3 000 r·min-1离心5 min。分离血清,并放入-80℃冰箱保存待检。
1.3.3 膝关节关节液样本的采集与保存
在造模后4周、8周和12周,采集模型组和对照组犬右肢膝关节内关节液。使用舒泰麻醉后仰卧固定于手术台上,用2 mL无菌注射器沿实验动物右肢膝关节髌骨下髌直韧带内侧关节间隙水平穿刺,将充分反复屈曲活动犬膝关节数次,再在髌直韧带外侧关节间隙水平位置穿刺,用5 mL注射器抽取膝关节腔内关节液1 mL,注入离心管,离心后迅速置于-80℃低温冰箱中保存待测。
1.3.4 膝关节活动度测定
先将犬膝关节完全抻直,而后使膝关节弯曲,用测量仪测量其抻直到弯曲的角度是膝关节活动范围,正常膝关节弯曲度约120~150°。在造模前、造模成功后及处死动物前测量犬膝关节活动范围,使用仪器测量膝关节活动最大值,左侧关节活动度是正常对照组,同一时间点每只犬膝关节测量3次,将3次测量平均值作为最终测量值。
1.3.5 血清和关节液主要成分的测定
IL-1、TNF-α和HA浓度测定样本稀释后按ELISA说明书测定。
1.4 统计学方法分析
比较OA模型组与对照组血清和关节液IL-1、TNF-α和HA浓度。用SPSS16.0软件统计学分析,将所得数据均以平均数和标准差()表示,组间选择T检验对检测数据进行分析,P<0.05为差异显著的标准。
2 结果分析
2.1 临床症状观察
在造模完成时犬膝关节骨关节炎临床评分结果显示:犬骨关节炎模型组膝关节在临床触诊及视诊方面均有不同程度的肿胀,挛缩畸形等表现,由表1可知,膝关节活动度在各时间点均明显低于对照组(P<0.01),模型组4周、8周及12周的伸直和屈曲的活动度比较差异显著,有统计学意义(P<0.05)。即膝关节在各个方面表现随时间加重。
表1 模型组与对照组各不同时间点犬膝关节活动度比较(,n=6,单位:度)Table 1 Comparison of the activity of model group and the control group of dogs knee in various time points(,n=6,Unit:degrees)
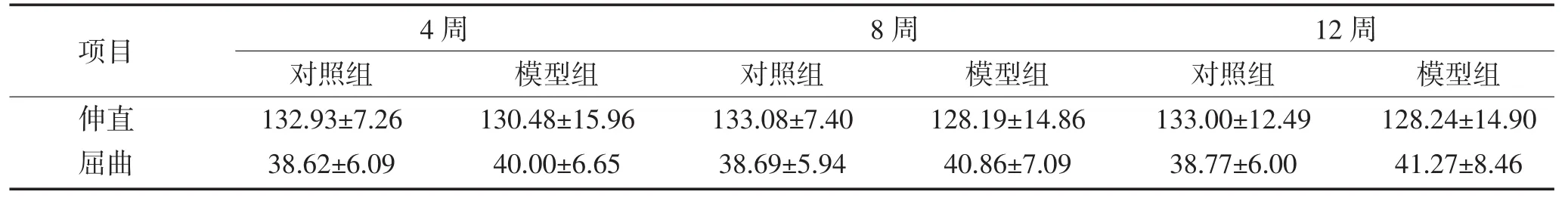
表1 模型组与对照组各不同时间点犬膝关节活动度比较(,n=6,单位:度)Table 1 Comparison of the activity of model group and the control group of dogs knee in various time points(,n=6,Unit:degrees)
项目伸直屈曲4周 8周 12周对照组132.93±7.26 38.62±6.09模型组130.48±15.96 40.00±6.65对照组133.08±7.40 38.69±5.94模型组128.19±14.86 40.86±7.09对照组133.00±12.49 38.77±6.00模型组128.24±14.90 41.27±8.46
2.2 犬血清中IL-1β、TNF-ɑ和HA的检测结果
由表2可知,造模后4周、8周和12周,模型组犬血清中IL-1β浓度呈升高趋势,但在第8周时出现波动,第4周和第8周模型组浓度水平较对照组显著性升高(P<0.05),第12周模型组较对照组极显著性升高(P<0.01)。第4周与第8周、第8周与第12周模型组血清中的IL-1β含量均差异显著(P<0.05),而第4周与第12周模型组血清中的IL-1β含量水平比较差异无显著(P>0.05)。
表2 模型组与对照组第4,8,12周犬血清中IL-1β值(,pg·mL-1)Table 2 IL-1β values of canine serum of model group and control group at 4,8 and 12 weeks(,pg·mL-1)

表2 模型组与对照组第4,8,12周犬血清中IL-1β值(,pg·mL-1)Table 2 IL-1β values of canine serum of model group and control group at 4,8 and 12 weeks(,pg·mL-1)
4周8周12周对照组27.45±1.58 25.06±3.91 26.26±2.23模型组61.06±7.05 58.89±7.23 77.47±8.71 P值P<0.05 P<0.05 P<0.01
由表3可知,造模后4周、8周和12周,模型组犬血清中TNF-α浓度水平与对照组比较均有显著性差异(P<0.05),但第12周模型组与对照组比较差异极显著(P<0.01)。随着造模时间的推移,模型组犬血清中TNF-α的浓度呈升高趋势,模型组犬血清中TNF-α浓度三组组间比较结果显示均有差异显著(P<0.05)。
表3 模型组与对照组第4,8,12周犬血清中TNF-α值(,pg·mL-1)Table 3 TNF-α values of canine serum of model group and control group at 4,8 and 12 weeks(,pg·mL-1)

表3 模型组与对照组第4,8,12周犬血清中TNF-α值(,pg·mL-1)Table 3 TNF-α values of canine serum of model group and control group at 4,8 and 12 weeks(,pg·mL-1)
4周8周12周对照组37.71±1.42 36.60±1.53 36.60±0.76模型组95.16±4.05 97.40±0.88 134.65±6.76 P值P<0.05 P<0.05 P<0.01
表4可知:手术造模后4周、8周和12周,膝关节骨关节炎模型组犬血清中HA的浓度与对照组比较均有显著差异(P<0.05),但第8周和第12周模型组与对照组比较极显著性差异(P<0.01)。随造模时间延长,模型组犬血清中HA的浓度呈逐渐下降,模型组组间比较无显著性差异(P>0.05)。
表4 模型组与对照组第4,8,12周犬血清中HA值(,ng·mL-1)Table 4 HA values of canine serum of model group and control group at 4,8 and 12 weeks(,ng·mL-1)

表4 模型组与对照组第4,8,12周犬血清中HA值(,ng·mL-1)Table 4 HA values of canine serum of model group and control group at 4,8 and 12 weeks(,ng·mL-1)
4周8周12周对照组237.67±44.98 200.33±51.81 222.17±63.88模型组158.21±43.17 132.34±45.03 115.24±52.62 P值P<0.05 P<0.01 P<0.01
2.3 犬关节液中IL-1β、TNF-α和HA的检测结果
由表5可知,造模后4周、8周、12周,膝关节骨关节炎模型组犬关节液中IL-1β浓度水平较对照组极显著性升高(P<0.01),随着造模时间延长,模型组犬关节液中IL-1β浓度水平呈上升趋势,第4周与第8周模型组比较无显著差异(P>0.05);第12周与第4和8周模型组比较均有显著性差异(P<0.05)。
表5 模型组与对照组第4、8、12周犬关节液中IL-1β的测量(,pg·mL-1)Table 5 IL-1β measurement of canine synovial fluid in model group and control group at 4,8 and 12 weeks(,pg·mL-1)

表5 模型组与对照组第4、8、12周犬关节液中IL-1β的测量(,pg·mL-1)Table 5 IL-1β measurement of canine synovial fluid in model group and control group at 4,8 and 12 weeks(,pg·mL-1)
4周8周12周对照组71.58±2.21 72.81±2.58 74.94±7.84模型组107.84±4.72 117.84±5.50 164.08±12.43 P值P<0.01 P<0.01 P<0.01
由表6可知,第4、8和12周膝关节骨关节炎模型组犬关节液中TNF-α浓度水平较对照组均为极显著性升高(P<0.01)。随着软骨病理改变的加重,模型组关节液中TNF-α浓度水平呈波动式逐渐升高,模型组犬关节液中TNF-α浓度水平三组组间比较均有显著性差异(P<0.05)。
表6 模型组与对照组第4、8、12周犬关节液中TNF-α的测量(,pg·mL-1)Table 6 TNF-α measurement of canine synovial fluid in model group and control group at 4,8 and 12 weeks(,pg·mL-1)

表6 模型组与对照组第4、8、12周犬关节液中TNF-α的测量(,pg·mL-1)Table 6 TNF-α measurement of canine synovial fluid in model group and control group at 4,8 and 12 weeks(,pg·mL-1)
4周8周12周对照组90.67±3.51 93.14±3.78 92.08±7.87模型组160.68±3.24 156.38±7.09 217.51±6.51 P值P<0.01 P<0.01 P<0.01
表7可知:手术造模后4、8和12周,膝关节骨关节炎模型组犬关节液中HA的浓度与对照组比较均有显著差异(P<0.05),随造模时间延长,模型组犬血清中HA的浓度呈下降趋势,第4周与第12周模型组组间比较具有显著性差异(P<0.05)。
表7 模型组与对照组第4、8、12周犬关节液中HA值(,mg·mL-1)Table 7 HA measurement of canine synovial fluid in model group and control group at 4,8 and 12 weeks(,mg·mL-1)

表7 模型组与对照组第4、8、12周犬关节液中HA值(,mg·mL-1)Table 7 HA measurement of canine synovial fluid in model group and control group at 4,8 and 12 weeks(,mg·mL-1)
4周8周12周对照组15.82±3.79 15.31±3.09 14.67±3.96模型组10.56±1.87 9.41±3.00 6.61±3.08 P值P<0.05 P<0.05 P<0.05
3 讨论
3.1 IL-1与OA
多项实验证明,细胞因子浓度对OA病理发展过程非常重要,细胞因子与滑膜、关节软骨和软骨下骨的功能改变密切相关。一些细胞因子在关节炎的病理过程中对关节软骨和关节滑膜具有一定的破坏作用,其中最引人注目的是IL-1[4]。IL-1是一种多肽类物质主要来源于巨噬细胞、纤维母细胞、软骨细胞、破骨细胞等,。IL-1的浓度在OA的整个病理过程中不断变化,证明了IL-1在OA发病过程中有致病作用[5]。IL-1引导基质金属蛋白酶基因mRNA表达增高,使明胶酶、胶原酶及基质溶解酶等合成和分泌的上升。IL-1激发软骨细胞表现特定的基因图谱,使软骨基质降解性蛋白质的产生增加,造成软骨的破坏,并参与血管重塑、新生血管形成软骨基质的破坏和重塑[6]。此外,IL-1通过对磷脂酶A2和环氧合酶等作用后,促进滑膜细胞及软骨细胞合成并释放前列环素及其他炎性递质,从而产生强大的致炎作用。OA中IL-1严重扰乱关节滑膜组织的新陈代谢,能促进关节软骨细胞外基质蛋白降解。IL-1是一种多效性细胞因子,分别为IL-1ɑ与IL-1β两种不同的亚型,两者都能导致炎性反应,但是IL-1β是致炎作用强于IL-1ɑ,IL-1ɑ致炎作用主要产生在细胞内部,而IL-1β致炎作用是分泌到细胞膜外面产生,Pelletier JP等[8]人报道膝关节关节液中IL-1多以IL-1β为主要组成部分。有研究表明,在骨关节炎早期采用免疫组化法分析滑膜组织发现关节滑膜衬内层细胞中有IL-1β。在关节软骨细胞中IL-1β相对于关节内的淋巴细胞聚集的地方和外周血管翳处较多。IL-1β刺激加速了滑膜的成纤维细胞上升,使滑膜细胞粘附分子表达升高,加强了滑膜细胞与浸润性炎性细胞的反应,形成不利于关节软骨生存和生长的环境[9]。IL-1是与OA病变中有关的最重要促进炎症反应的分解性细胞因子之一[7]。已有研究发现,膝关节动物模型的关节液和血清中IL-1β水平均高于正常组。实验结果说明模型组血清,关节液中的IL-1β浓度分别与实验对照组对比,差异显著(P<0.05),说明随着犬膝关节OA的病情的不断加重,IL-1β浓度逐渐上升的趋势,证明IL-1β对犬膝关节软骨功能衰退和破坏的最具有影响力,是导致骨性关节炎发病过程中重要的炎症调节因子。
3.2 TNF-α与OA
TNF-ɑ作为一种炎性细胞因子,影响关节软骨的降解过程,还可以参与并介导多种炎症反应过程。OA的发生及发展与关节内滑膜细胞分泌过多的TNF-ɑ有关,曾有学者认为单核细胞等浸润的炎性滑膜组织和变性的软骨细胞可分泌形成TNF-α。TNF-α浓度到达一定程度可激活多型核细胞,增多滑膜细胞产生前列腺素E2,扩张血管通透性。然而,现有实验证明关节液中TNF-α的突然升高主要是因为滑膜A、B型细胞功能的异常引起的[10],能诱发抗自身软骨的自身免疫反应,刺激软骨基质金属蛋白酶的合成和分泌,从而导软骨的破坏。在对骨关节炎患者的血清及关节液检测中发现,TNF-ɑ浓度明显高于正常人[11],而骨性关节炎的关节液中TNF-ɑ是导致关节软骨降解过程最早出现的细胞因子之一[12]。在创伤性骨关节炎病理变化过程中也与TNF-ɑ介导的炎性反应有关[13]。体外研究表明,在病变的软骨细胞和滑膜细胞内,均可检测大量TNF-ɑ的存在,TNF-ɑ能够影响软骨细胞基因表达,造成软骨的主要成分Ⅱ型胶原和蛋白多糖的合成受到抑制,并促使其分解,同时Ⅰ、Ⅲ型胶原的合成增多,从而软骨的结构成分改变,导致关节炎的发生[14]。TNF-ɑ可以与破骨细胞前体上的TNFR-1结合,加快破骨细胞成熟,还可以使巨噬细胞集落刺激因子表达量上升,导致破骨细胞成熟及其功能增强,促使骨质吸收及骨质破坏[15]。查振刚通过研究证明,血清中TNF-ɑ的浓度和OA的轻重程度相关,OA晚期更加明显[16]。实验分别在造模术后4、8、12周取相应模型组的血清及关节液,用ELISA法检测血清和关节液中TNF-α浓度,经统计学分析:各实验组血清和关节液中的TNF-α浓度分别与相应对照组相比,有显著性差异(P<0.05),由结果可以看出,TNF-α的浓度在4、8、12周时浓度有周明显升高,高于对照组。同时,随着OA病情的加重,血清和关节液中TNF-α浓度有上升趋势,有明显的相关性,说明利用血清和关液中TNF-α浓度变化证明OA的严重程度很有意义,但它并不能作为诊断OA的生化指标。
3.3 HA与OA
关节液中的HA属粘多糖物质主要由滑膜B型细胞分泌,是关节液及软骨基质的主要组成成分,在关节液中浓度较机体的其他体液中为最高,关节液中正常浓度及正常属性的HA主要功能为营养、润滑和保护关节软骨[17]。在骨关节炎疾病中,由于金属蛋白酶类和细胞因子的作用,使滑膜组织产生自由基增多,HA的分泌减少导致关节液中HA浓度逐渐下降[18]。此外,透明质酸酶活性的增高也导致关节液中HA分子量进一步降解,使关节液中HA浓度下降[19]。在人类骨关节炎疾病的研究表明,OA患者随病程延长血清中HA浓度增高,可作为疾病诊断和预后的指标,而犬血清中HA浓度变化与之相反[20]。犬的关节液中HA浓度与年龄的变化相关,在未满8个月的犬,血清中HA浓度升高显著,老年犬与成年犬没有显著差异[21]。在骨关节炎的初期阶段,由于各种病理性刺激的反应使滑液HA浓度增加,HA合成克服软骨的退化和损伤,随着病情的发展,滑液中HA浓度与正常滑夜中HA的浓度相比较低[22]。犬膝关节骨骨关节炎的临床症状如破行、疼痛和关节积液及关节液粘度的严重程度与关节液中HA的浓度密切相关,由于关节进一步退化和关节炎症的加重导致关节液中免疫细胞和炎性介质的迁移和合成增加,使关节液中HA浓度下降[23]。髋关节发育不良性骨关节炎犬血清中HA的浓度明显低于非髋关节发育不良犬,血清中HA的浓度变化能够作为犬髋关节发育不良骨关节炎的诊断指标[24]。实验结果,手术造模4、8和12周后,犬膝关节骨关节炎模型组血清和关节液中HA的浓度与对照组比较均P<0.05有显著差异,随造模时间延长,模型组犬血清和血液中HA的浓度呈下降趋势,模型组组间比较差异显著。
参考文献:
[1] Birmingham J,Vilim V,Kraus V.Collagen biomarkers for arthritis applications[J].Biomarker Insights,2006(2):61-76.
[2] Sandra K,Leo ABJ,Al ison MB,et a1.Different roles of tumour necrosis factor a and interleukin-1 in murine streptococcal eell wall arthritis[J].Cytokine,1998,10:690-702.
[3] Canapp S,Cross A,Brown M,et al.Examination of synovial fluid and serum following intravenousinjections of hyaluronan for the treatment of osteoarthritis in dogs[J]. Vet Comp Orthop Traumatol,2005(3):169-174.
[4] 傅欣,林霖,张继英,等.骨性关节炎兔关节软骨、关节液细胞因子IL-1β和TNF-α变化的研究[J].中国运动医学杂志,2007(6):709-713.
[5] 张建清.膝关节炎患者膝关节滑液中白细胞介素-1β白细胞介素-6浓度变化的意义[J].实用医技杂志,2011(2):127-128.
[6] 饶慧.BTY抑制兔实验性骨关节炎血清白细胞介素-6的研究[D].长沙:中南大学,2007.
[7] 马玉捷,汤小朋.诱发性骨关节炎动物模型概述[C]//.中国畜牧兽医学会2010年学术年会——第二届中国兽医临床大会论文集(下册).北京:中国畜牧兽医学会,2010.
[8] Pelletier JP,Faure MP,DiBattista JA,et al.Coordinate synthesiS of stromelysin,interleukin-1,and oncogene proteins in experimentalosteoarthritis.An immunohistochemical study[J].AM J Pathol,1993:142(1):95-105.
[9] Pelletier JP,McCollum R,Cloutier JM,et a1.SynthesiS of metallo—proteases and interleukin-6(IL-6)in human osteoarthritic synovial membrane is an IL-l mediated process[J].Rheumatol Suppl,1995,43:109-114.
[10] 邓廉夫,柴本甫,李慧,等.骨关节炎滑液中肿瘤坏死因子ɑ活性检测及滑膜组织超微结构观察[J].中华外科杂志,1998,36(2):77-79.
[11] Pelletier JP,DiBattista JA,Roughley P,et al.Cytokines and inflammation in cartilage Degradation[J].Rheum Dis Clin North AM,1993,19:546.
[12] Venn G,Nietfeld JJ,Duits AJ,et a1.Elevated synovial fluid levels ofinterleukin-6 and tumor necrosi S factor associated with early experimental canine osteoarthritiS[J].Arthritis Rheum,1993,36(6):819-826.
[13] 刘相和,夏玉军,迟焕芳.创伤性骨关节炎组织CD11、CD54、TNF-ɑ及S100表达[J].青岛大学医学院学报,2008,44(5):409-410.
[14] 谷城,蒋庆余,王欣宇,等.不同程度跛行奶牛血浆中E2、GnRH、FSH和PGF2a的检测与分析[J].黑龙江八一农垦大学学报,2015,27(4):28-31.
[15] Herman S,Kronke G,Schett G.Molecular mechanisms of inflammatory bone damage:emerging targets for therapy[J].Trends Mol Med,2008,14(6):245-253.
[16] 管兴发,董金波,王维山,等.骨关节炎患者血清及关节液中TNF-α与MMP-3浓度及临床意义[J].青岛医药卫生,2008(1):9-12.
[17] Wang CT,Lin YT,Chiang BL,et al.High molecular weight hyaluronic acid down-regulates the gene expression of osteoarthritis-associated cytokines and enzymes in fibroblast-like synoviocytes from patients with early osteoarthritis[J].Osteoarthritis Cartilage,2006,14(12):1237-1247.
[18] 张皓,田金华,朴明淑,等.气肿疽梭菌鞭毛基因克隆载体的构建[J].延边大学农学学报,2015(2):91-95.
[19] Praest BM,Greiling H,Kock R.Assay of synovial fluid parameters:hyaluronan concentration as potential marker for joint diseases[J].Clin Chim Acta.,1997,266(2):117-128.
[20] Budsberg S C,Lenz M E,Thonar E J.Serum and synovial fluid concentrations of keratan sulfate and hyaluronan in dogs with induced stifle joint osteoarthritis following cranial cruciate ligament transaction[J].American Journal of Veterinary Research,2006,67:429-432.
[21] 李平,仝秀清,楚洪波.血浆生物学指标与TOAST分型各亚型的相关性[J].长春大学学报,2016(2):37-40.
[22] Canapp S,Cross A,Brown M,et al.Examination of synovial fluid and serum following intravenous injections of hyaluro-nan for the treatment of osteoarthritis in dogs[J]. Vet Comp Orthop Traumatol,2005(3):169-174.
[23] Kuroki K,Cook J L,Kreeger J M.Mechanisms of action and potential uses of hyaluronan in dogs with osteoarthritis[J].Journal of the American Veterinary Medical Association,2002,221:944-950.
[24] Nganvongpanit K,Itthiarbha,A.,Ong-Chai,S.,et al,Evaluation of serum chondroitin sulfate and hyaluronan:biomarkers for osteoarthritis in canine hip dysplasia[J]. Journal of Veterinary Science,2008(9);317-325.
Analysis of IL-1,TNF-α and HA in Synovial Fluid and Serum of Dog Animal Model with Knee Osteoarthritis
Liu Jianying,Luo Chunhai,Liu Yao,Zheng Chengyuan,Zou Xiao,Xu Meihua,Fu Shixin
(College of Animal Science and Veterinary Medicine,Heilongjiang Bayi Agricultural University,Daqing 163319)
Dog’s IL-1,TNF-α and HA concentration of serum and synovial fluid in model group and control group was determined to verify the clinical significance with the change in concentration at different stages of the canine knee osteoarthritis(OA).36 dogs were randomly divided into model group and control group,Model group were cut off anterior cruciate ligament in dogs was established knee osteoarthritis model,control group were not cut off the joint capsule anterior cruciate ligament.At 4,8 and 12 weeks,respectively,the serum and synovial fluid samples were collected by using ELISA method for quantitatively determining the concentration of the indicators.The model group and control group IL-1,TNF-α and HA concentrations had relatively significant difference in the 4,8and 12 weeks,statistically significant P<0.05.With the model group of canine osteoarthritis aggravated,IL-l and TNF-αof Canine synovial fluid and serum the concentration gradually increased,HA concentration of Canine synovial fluid gradually increased,HA concentrations of Canine serum decreased.The changes of serum and synovial fluid components of knee osteoarthritis model group canine were closely related to OA pathogenesis,which could be used as indicators reaction of clinical course of OA.
Dog;IL-1;TNF-α;HA;knee osteoarthritis
S857.16
A
1002-2090(2017)02-0029-06
10.3969/j.issn.1002-2090.2017.02.006
2016-04-10
刘健莹(1986-),女,黑龙江八一农垦大学动物科技学院2014级硕士研究生。
付世新,女,教授,博士研究生导师,E-mail:fushixin@163.com。

