O-GlcNAc对冷应激下小鼠骨骼肌卫星细胞Caspase-3的影响
张雪,SHI Hao,李士泽,李云龙,刘鹏,甄莉,李鹏,杨玉英
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.弗吉尼亚理工大学农业与生命科学学院)
O-GlcNAc对冷应激下小鼠骨骼肌卫星细胞Caspase-3的影响
张雪1,SHI Hao2,李士泽1,李云龙1,刘鹏1,甄莉1,李鹏1,杨玉英1
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.弗吉尼亚理工大学农业与生命科学学院)
O-连接的N-乙酰葡糖胺糖基化修饰(O-GlcNAcylation)是一种存在于蛋白质Ser/Thr上的翻译后修饰,主要是由OGlcNAc催化转移酶(简称OGT)和O-GlcNAc水解酶(简称OGA)调控的动态过程。其过程与磷酸化相似,在多种细胞过程中扮演着重要的信号转导通路角色,并与神经退行性疾病、Ⅱ型糖尿病、癌症等许多疾病的发病机理密切相关。主要是在低温应激下,通过抑制剂来调控OGT和OGA,间接调控小鼠骨骼肌卫星细胞内O-GlcNAc的含量,来探讨O-GlcNAc对骨骼肌卫星细胞凋亡的作用。实验分为正常对照组、OGA高表达组、OGT高表达组,经过常温(37℃)和亚低温(32℃)不同条件的处理,采用ELISA方法检测Casp-3指标的变化。结果显示:冷应激处理后,人为调控骨骼肌卫星细胞内O-GlcNAc的含量后,所检测的指标有明显差异(P<0.05)。结果说明:在低温应激条件下,O-GlcNAc降低会促进细胞凋亡,从而降低了小鼠骨骼肌卫星细胞的抗应激能力,对骨骼肌卫星细胞造成了一定的影响。
冷应激;O-GlcNAc;骨骼肌卫星细胞
O-GlcNAc转移酶(OGT)最早是在大鼠肝脏提取物中分离出来的,主要在细胞核内表达,并且具有高度保守性,各组织中均可检测到,是哺乳动物细胞中负责O-GlcNAc糖基化转移的唯一酶。经研究学者鉴定,由OGT催化的成千上万种细胞质以及核蛋白质O-GlcNAc糖基化都与细胞过程有着联系,如基因转录和翻译、营养传感、神经元功能、细胞周期进程、淋巴细胞激活和应激反应等[1-6]。O-GlcNAc水解酶(OGA)有130 kDa和75 kDa两种亚型,以O-GlcNAc为特异性底物。中性环境下可去掉O-GlcNAc修饰蛋白上的N-乙酰葡萄糖胺,且具有特异性。在细胞凋亡起始时,O-GlcNAcase可被胱天蛋白酶3(caspase-3)迅速剪切,产生一个65 kD的片段且仍然具有糖苷酶活性,由此可见其在细胞凋亡中也可能发挥作用[7]。
骨髓肌是具有收缩能力的肌细胞(由于其形状成幼长的纤维状,所以亦称作肌纤维)所组成。骨骼肌约占人体总重的40%~60%,并且包含了机体内50%~75%的蛋白质[8],任何的身体活动和体育活动,都是骨骼肌收缩的完成,直接影响人体的力量和耐力。Daniel Bovet经大量研究证实:骨骼肌在血糖利用方面作用极其重要,人体85%的血糖转化和71%的糖元储存由骨骼肌完成的。专家研究发现,99.8%的糖尿病人骨骼肌出现弱化甚至萎缩现象。D’Souza等人发现糖尿病主要是通过影响卫星细胞的活性来损害肌再生细胞的生成[9]。然而许多研究学者认为蛋白质O-GlcNAc水平是糖尿病病理学发生的一个诱发因素[10]。因此O-GlcNAc对骨骼肌卫星细胞的作用受到了越来越多的学者关注,人们认为O-GlcNAc在骨骼肌中扮演着重要的营养代谢传感器的角色。研究学者通过小鼠模型和体外细胞培养实验表明,不适当的O-GlcNAc糖基化会损害肌纤维的形成,并诱导肌肉萎缩[11-12]。那么当冷应激诱导O-GlcNAc调控的蛋白质水平发生变化后,对骨骼肌卫星细胞的营养代谢到底有怎么样的影响是值得我们探讨的。
1 实验材料
1.1 实验动物
7~10日龄昆明小鼠,体重约(4±0.2)g,由黑龙江八一农垦大学动物实验中心提供。
1.2 主要试剂
OGT抑制剂(3-(2-adamantanylethyl)-2-[(4-chlorophenyl)azamethylene]-4-oxo-1,3-thiazaperhyd roine-6-carboxylic acid,TT04):购自美国Tim Tec;OGA抑制剂(Thiamet,ThG):购自美国 Cayman Chemical;二甲基亚砜 DMSO:购自美国 Gayload Slidell,La;GR&D Systems即用型试剂盒:Casp-3 ELISA检测试剂盒。
1.3 试验设备
318MC型酶标仪:上海三科器有限公司
SHP-250型生化培养箱:上海森信实验仪器有限公司
2 试验方法
2.1 小鼠骨骼肌卫星细胞的分离、培养
选用新生7~10 d,体重(4±0.2)g的昆明小鼠,75%酒精浸泡消毒,无菌条件下剥皮,完整取下新生小鼠后肢肌肉、背部肌肉,以及斜肩前肌肉、隔膜肌,并将其分割成细小碎块,进行第一次消化(Ham’s F-10培养基:含500 U·mL-1的胶原酶II,10%马血清和1%青霉素/链霉素)与37℃、5%CO2细胞孵箱中消化约90 min;之后加入等体积的洗涤剂(Ham’s F-10含10%马血清)终止消化,静置1 min,500 g分离1 min,弃掉上清(第1次洗涤),之后再重复洗两次;进行第二次消化37℃下消化30 min,每10 min震荡一次。在消化结束后,加入10 mL洗涤剂(F-10,10% HS)终止消化,500 g离心1 min,上清液用40微米筛目细胞过滤器过滤到50 mL离心管中,1 000 g分离5 min,加入生长培养基(F-10含20%胎牛血清FBS,1%抗生素,5 NG·mL-1的bFGF),每个35 mm培养皿中接种约5×104个细胞,于37℃、5%CO2细胞孵箱中进行培养;24 h后将更换细胞培养液(F-10培养基,20%牛血清,5 NG·mL-1bFGF,1%双抗),于37℃、5%CO2细胞孵箱中继续培养;每3天更换生长培养液,7~8 d进行纯化,用预先温热的PBS洗涤培养皿,加入细胞分化培养基(2%马血清的DMEM中,用1%青霉素/链霉素),每2天换一次培养液,镜下观察细胞状态,14 d左右可以准备进行后续实验处理。
2.2 样品的收集
将上述方法培养小鼠骨骼肌卫星细胞,在收集样品的前一天,无菌条件下将细胞的原培养基弃掉,用预热的PBS清洗两遍,更换成无血清的培养基,将细胞分为正常对照组,OGA高表达组,OGT高表达组。正常组不做任何处理,OGT高表达组是通过在该组细胞内加入OGA的抑制剂ThG,从而使O-Glc-NAc信号积聚;OGA高表达组是通过在该组细胞内加入OGT的抑制剂TT04,从而达到O-GlcNAc信号削弱的效果。将三组细胞放入37℃、5%CO2细胞培养箱中培养24 h,再分别置于常温(37℃)和低温(32℃2 h、32℃ 4 h、32℃ 6 h、32℃ 8 h) 条件下进行处理。收取不同条件下的三组细胞的细胞培养基,3 000 rpm,4℃离心10 min,收取各组上清液,做好标记,置于-20℃下保存。
2.3 ELISA检测
样品室温下进行解冻,并确保其可以解冻的充分均匀;取出保存在2~8℃的ELISA试剂盒,使用前应先在室温下平衡20 min;然后按照ELISA检测试剂盒说明书进行检测,15 min内在450 nm波长处测定各孔的OD值并记录数据;最后处理数据并利用SPSS V19.0软件进行数据分析凋亡指标:人胱天蛋白酶3(Casp-3)。
3 结果
采用ELISA方法,分别计算各组小鼠骨骼肌卫星细胞Casp-3的浓度。结果如图1所示,正常培育温度37℃状态下,OGT高表达处理组Casp-3浓度与正常对照组相比有明显差异(P<0.05),而OGA高表达组Casp-3浓度与正常对照组相比有显著差异(P<0.01)。亚低温32℃状态下:当骨骼肌卫星细胞处于亚低温应激2 h时,OGT高表达处理组Casp-3浓度与常温对照组相比有明显差异(P<0.05),而OGA高表达组Casp-3浓度与常温对照组相比差异显著(P<0.01);在细胞处于应激6 h内,OGT高表达处理组 Casp-3浓度与常温对照组相比有明显差异(P<0.05),而OGA高表达组Casp-3浓度与常温对照组相比无明显差异(P>0.05);当应激8 h后,各组细胞均出现明显凋亡状态,无明显差异(P>0.05)。
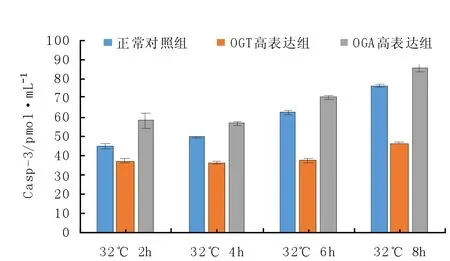
图1 不同条件下三组小鼠骨骼肌卫星细胞中Casp-3检测结果图Fig.1 The concentration of Casp-3 in mouse skeletal muscle satellite cells from three groups under different conditions
4 讨论
细胞凋亡是基因调控的细胞自杀行为,在生理或病条件下均会发生,以此来维持机体内环境的稳定。天冬氨酸特异的半胱氨酸蛋白酶(Caspase)是一类与凋亡发生发展密切相关的蛋白水解家族,其中Caspase3是细胞凋亡主要执行者并与凋亡的形态学特征密切相关,其活化是细胞凋亡的中心环节,一旦被激活,即发生下游的级联反应,使凋亡不可避免,因而Caspase3被称为“死亡蛋白酶”。所以当细胞中Casp-3的浓度增高,说明细胞的凋亡率增加。多种刺激均可导致细胞发生凋亡,而冷应激主要是使细胞内ROS升高,从而导致细胞调亡[13-14]。
当骨骼肌卫星细胞处于37℃状态下,OGT高表达处理组中Casp-3的浓度明显低于正常对照组,然而人为地调控OGT高表达,主要目的是使O-Glc-NAc信号积聚,说明O-GlcNAc增多会抑制骨骼肌卫星细胞的凋亡;相反,人为调控OGA高表达,主要目的是使O-GlcNAc信号减弱,说明O-GlcNAc降低时会促进骨骼肌卫星细胞的凋亡。当骨骼肌卫星细胞处于亚低温32℃状态下,前6 h内,OGT高表达组Casp-3的浓度明显低于正常对照组,但是相比37℃下的OGT高表达组要高一些。说明人为地调控OGT高表达使O-GlcNAc信号积聚后,会抑制骨骼肌卫星细胞的凋亡,但是冷应激会导致O-GlcNAc信号减弱,所以32℃状态下Casp-3的浓度相比37℃下会有所增高,并且32℃下OGA高表达也从反面证实了这一点。这一结果表明O-GlcNAc下调会抑制骨骼肌卫星细胞的凋亡,并且在亚低温状态下也会相应地抑制骨骼肌卫星细胞凋亡,从而更加说明O-Glc-NAc在骨骼肌卫星细胞中扮演着重要的角色,并且在低温状态下,其含量减少对骨骼肌卫星细胞的抗氧能力的保护也相对减少。这一观点让我们不禁会想到,冷应激对动物肌肉品质的影响,这也是值得我们进一步探讨的问题。
[1] Ma J,Hart G W.O-GlcNAc profiling:from proteins to proteomes[J].Clin Proteomics,2014,11(1):1.
[2] Zeidan Q,Wang Z,De Maio A,et al.O-GlcNAc cycling enzymes associate with the translational machinery and modify core ribosomal proteins[J].Mol Biol Cell,2010,21(12):1922-1936.
[3] Gambetta M C,Oktaba K,Müller J.Essential role of the glycosyltransferase sxc/Ogt in polycomb repression[J]. Science,2009,325(5936):93-96.
[4] Yang W H,Kim J E,Nam H W,et al.Modification of p53 with O-linked N-acetylglucosamine regulates p53 activity and stability[J].Nat Cell Biol,2006,8(10):1074-1083.
[5] Fujiki R,Hashiba W,Sekine H,et al.GlcNAcylation of histone H2B facilitates its monoubiquitination[J].Nature,2011,480(7378):557-560.
[6] Li M D,Ruan H B,Hughes M E,et al.O-GlcNAc signaling entrains the circadian clock by inhibiting BMAL1/ CLOCK ubiquitination[J].Cell Metab,2013,17(2):303-310.
[7] Wells L,Gao Y,Mahoney J A,et al.Dynamic O-glycosylation of Nuclear and cytosolic proteins:further characterization of the nucleocytoplasmic β-N-acetylglucosaminidase, O-GlcNAcase[J].J Biol Chem,2002,277(3):1755-1761.
[8] Frontera W R,Ochala J.Skeletal muscle:a brief review of structure and function[J].Calcified Tissue Int,2015,96(3):183-195.
[9] Guimara~es-Ferreira L,Pinheiro C H J.Diabetic myopathy:impact of diabetes mellitus on skeletal muscle progenitor cells[J].Front Physiol,2013,4:379.
[10] Lehman D M,Fu D J,Freeman A B,et al.A single nucleotide polymorphism in MGEA5 encoding O-GlcNAcselective N-Acetyl-β-d glucosaminidase is associated with type 2 diabetes in Mexican Americans[J].Diabetes,2005,54(4):1214-1221.
[11] Huang P,Ho S R,Wang K,et al.Muscle-specific overexpression of NCOATGK,splice variant of O-GlcNAcase,induces skeletal muscle atrophy[J].Am J Physiol Cell Physiol,2010,300(3):C456-465.
[12] Ogawa M,Mizofuchi H,Kobayashi Y,et al.Terminal differentiation program of skeletal myogenesis is negatively regulated by O-GlcNAc glycosylation[J].Biochim Biophys Acta,2011,1820(1):24-32.
[13] 孙婷婷,金京顺,贾立军.新孢子虫与弓形虫交叉抗原基因AMA 1的克隆及原核表达载体构建[J].延边大学农学学报,2015(1):8-11.
[14] Magni F,Panduri G,Paolocci M.Hypothermia triggers iron-dependent lipoperoxidative damage in the isolated rat heart[J].Free Radic Biol Med,1994,16(4):465.
Influence of O-GlcNAc on Mouse Skeletal Muscle Satellite Cells Caspase-3 under Cold Stress
Zhang Xue1,SHI Hao2,Li Shize1,Li Yunlong1,Liu Peng1,Zhen Li1,Li Peng1,Yang Yuying1
(1.College of Animal Science and Veterinary Medicine,Heilongjiang Bayi Agricultural University,Daqing 163319;2.College of Agricultural and life Science,Virginia Polytechnic Institute and State University)
O-GlcNAcylation,a dynamic process that was catalyzed by O-GlcNAc transferase(OGT)and O-GlcNAcase(OGA),represented a signal transduction pathway that played critical roles in a variety of cellular processes.The process was similar to phosphorylation,and was closely related to the pathogenesis of many diseases,such as neurodegenerative diseases,Ⅱ diabetes and cancer.The important role of O-GlcNAc in skeletal muscle satellite cells was explored under low temperature stress through inhibitors OGT and OGA,indirect regulation O-the content of GlcNAc mice skeletal muscle satellite cell.Experiment was divided into normal control group,OGT high expression group and OGA high expression group after normal temperature(37℃)and low temperature(32℃)of different conditions,contents of Casp-3 were detected by ELISA.Results showed that after treated with cold stress,artificial regulation of skeletal muscle satellite cells after the content of O-GlcNAc,the detection index had obvious difference(P<0.05).Results suggested that under the condition of low temperature stress,low O-GlcNAc could effectively inhibit the production in cells and improve the antioxidant capacity of skeletal muscle satellite cells in mice,which played an active protection role in skeletal muscle satellite cells.
cold stress;O-GlcNAc;skeletal muscle satellite cells
Q58
A
1002-2090(2017)02-0025-04
10.3969/j.issn.1002-2090.2017.02.005
2016-03-20
“十三五”国家重点研发计划(2016YFD0501210);国家自然科学基金项目(NO.31272524);农业部948重点计划项目(2011-G35)。
张雪(1989-),女,黑龙江八一农垦大学动物科技学院2013级硕士研究生。
杨玉英,女,教授,硕士研究生导师,E-mail:yalele258@sina.com。

