利用月桂酸和山茶油的酸解反应分析脂肪酶的位置专一性
曹 茜韦 伟张 希冯凤琴(浙江大学食品科学与营养系;浙江省农产品加工技术研究重点实验室,杭州 30058)(云南中医学院,昆明 650500)
利用月桂酸和山茶油的酸解反应分析脂肪酶的位置专一性
曹 茜1韦 伟1张 希2冯凤琴1
(浙江大学食品科学与营养系;浙江省农产品加工技术研究重点实验室1,杭州 310058)(云南中医学院2,昆明 650500)
脂肪酶的位置专一性在结构酯的合成和油脂改性中具有重要意义。由于水体系和非水体系的差异,传统的水解判定法得出的专一性与该酶在合成反应中的表现可能并不一致。本研究利用月桂酸和山茶油的酸解反应来达到直接评估酶在无溶剂体系中位置专一性的目的。反应产物的脂肪酸组成和位置分布由气相色谱测定。通过此方法,Lipozyme RM IM、L02、L03和L04被鉴定为sn-1(3)位专一性,L01为弱专一性,Novozym 435近似无专一性。通过替换酶的底物,模型反应的可预测性得到验证。根据酸解法和水解法结果的对比分析,2种条件下酶的位置专一性通常是相同的,除了易受到溶剂体系影响的Novozym 435。因此,新方法能够避免水解判定结果在合成反应中应用的局限性。此外,它还降低了对底物纯度的要求,这意味着其能在低成本下用于脂肪酶的大规模筛选。
脂肪酶 位置专一性 山茶油 酸解 合成
脂肪酶(EC 3.1.1.3)能够催化甘油三酯的水解,并释放出游离脂肪酸、甘油二酯、甘油单酯和甘油。事实上,由于脂肪酶能够在无水体系中催化合成反应,包括酯化、酯交换、酸解、醇解和氨解等[1-2],因而其底物种类进一步增加。受益于底物和反应种类的多样性,脂肪酶已被广泛应用于许多领域,例如食品、饲料、药品、化妆品、洗涤剂等。此外,一些新兴的应用,特别是生产生物柴油和处理废水,也引起了研究者的关注[3-5]。然而,全能的脂肪酶几乎是不存在的,根据实验室和工业上特定的需求,一个合适的脂肪酶常常需要从大量的催化剂中筛选出来。筛选因子是多种多样的,如最适pH值、最适温度、位置专一性、立体专一性、金属离子耐受性、有机溶剂耐受性、底物特异性等均会深刻地影响脂肪酶的经济价值。
位置专一性是脂肪酶最重要的特性之一。专一性脂肪酶有2种类型:sn-1(3)位和sn-2位专一性[6]。南极假丝酵母(Candida antarctica)脂肪酶A被认为是唯一已知的对2位有反应倾向性的脂肪酶[7]。无位置专一性脂肪酶,即对1(3)位和2位没有选择性的脂肪酶同样存在。不同的结构酯合成和油脂改性,例如母乳化结构酯的合成和油脂中多不饱和脂肪酸的富集,对脂肪酶的位置专一性有不同的需求。因此,一个新型的脂肪酶的专一性在其应用之前必须鉴定准确。
利用薄层色谱分析三油酸甘油酯的酶水解产物是最常见和传统的专一性判定方法。根据此方法,由劳尔氏菌(Ralstonia sp.CS274)、3种芽孢杆菌(Bacillus isolates GK-8,GK-31 and GK-42)、假单胞菌(Pseudomonas sp.GK-80)、异孢镰刀菌(Fusarium heterosporum)、土曲霉(Aspergillus terreus)、肉色曲霉(Aspergillus carneus)和钝顶螺旋藻(Spirulina platensis)产生的脂肪酶为sn-1(3)位专一性[8-13],而由链霉菌(Streptomyces sp.CS268)分泌的脂肪酶则无位置专一性[3]。由此方法分析所得结果显然反映的是水解反应中酶的位置专一性。然而,如上所述,脂肪酶催化的反应不仅包括水解也包括合成反应。并且,一些脂肪酶更适合于合成而非水解。由于水体系和非水体系的区别,在2种体系下脂肪酶的位置专一性可能出现不一致。因此,直接评估脂肪酶在合成反应中位置专一性的方法需要被建立。本研究中,月桂酸和山茶油的酸解反应被设定为模型反应,利用气相色谱测定反应产物的脂肪酸构成和位置分布,从而定量脂肪酶的位置专一性。因为本方法测定的是产物中脂肪酸的组成和分布而非甘油三酯的种类和构成,所以反应底物中甘油三酯的纯度将不再是合成判定体系的限制性因素,这大大降低了反应成本,使得此法能够用于大规模筛选脂肪酶。
1 材料与方法
1.1 试验材料
脂肪酶Lipozyme RM IM、Novozym 435:诺维信公司;Lipozyme RM IM为固定在大孔阴离子交换树脂上的米黑根毛霉(Rhizomucor miehei)脂肪酶,Novozym 435为固定在大孔丙烯酸树脂上的南极假丝酵母(Candida antarctica)脂肪酶B;非固定化脂肪酶L01、L02、L03、L04:深圳绿微康生物工程有限公司;L01和 L04分别产自扩展青霉(Penicillium expansum)和黑曲霉(Aspergillus niger);L02和L03产自不同来源的米曲霉(Aspergillus oryzae);脂肪酸甲酯混标(C4-C24)、1,2-二油酸甘油酯(纯度≥98%)、1,3-二油酸甘油酯(纯度≥99%)、1-单油酸甘油酯(纯度≥99%)、TrizmaⒸbase(≥99.9%)和猪胰脂肪酶(typeⅡ):Sigma-Aldrich有限公司;月桂酸甲酯:东京化工有限公司;山茶油:联华华商集团有限公司;用于薄层色谱的预制硅胶板(GF254)和用于柱层析的300~400目硅胶:烟台市化学工业研究所;其他试剂为分析纯。
1.2 分析无水体系中位置专一性和酶活力
1.2.1 酸解反应
0.9 g月桂酸和1 g山茶油被选定为脂肪酶(0.1 g)的底物,月桂酸和山茶油的摩尔比为4∶1。酸解反应在40~60℃水浴中进行,并同时用转子搅拌。反应结束后,加入4 mL氢氧化钾水溶液(2 mol/L)和3 mL正己烷。氢氧化钾能够中和体系中的游离脂肪酸,并同时中止反应。将反应混合物离心,待测的甘油酯位于上层。
1.2.2 气相色谱分析
取2 mL稀释20倍的上层液体,并加入200 μL氢氧化钾甲醇溶液(2 mol/L)以完成甲酯化。由于天然山茶油中不含有月桂酸,因此月桂酸甲酯的含量就等同于通过酸解反应结合到甘油骨架上的月桂酸的量。分析测定脂肪酸甲酯的检测器为FID,气相柱为DB-23(30 m×0.250 mm×0.25 μm, Agilent Technologies),检测条件:进样温度250℃;分流比为50∶1;氮气为载气;检测器温度为300℃;柱温50℃保持5 min,然后以10℃/min升至180℃,并在180℃保持5 min,最后以5℃/min升至230℃。
sn-2位脂肪酸的分析根据AOCS Official Method Ch 3-91并做了少量调整。1 mL上层液体中加入50 mg猪胰脂肪酶、2 mL Tris-HCl缓冲液(1 mol/L,pH=8.0)、500 μL胆酸钠(1 g/L)和200 μL氯化钙(220 g/L),酶水解反应在40℃水浴中进行2 min,反应过程中不断振荡。水解产物在薄层色谱板上分离之后刮取2-甘油单酯,并重溶于2 mL正己烷,其甲酯化和气相测定方法如前所述。
1.2.3 计算公式
脂肪酶的位置专一性可以利用sn-1(3)位和sn-2位月桂酸的比值来定量。由于气相色谱通过面积归一化法可直接获得总月桂酸和2位月桂酸的摩尔分数,因此位置专一性比值由式(1)和式(2)进行计算。理想状态下,比值为1时,样品为无位置选择性;事实上,考虑到空间位阻效应,当值接近于1时,酶可以被认为是无专一性。比值越高,脂肪酶的1 (3)位专一性则越强。若比值小于1,酶则有2位专一性的潜力。
1(3)位月桂酸摩尔分数=

此模型反应同时还反映了脂肪酶在合成反应中的酶活力,一个酶活力单位(U)被定义为标准反应条件下,山茶油甘油骨架上每小时结合1%月桂酸所需的酶量。
1.3 分析水体系中位置专一性
1.3.1 制备三油酸甘油酯
山茶油经硅胶柱层析分离后可制得三油酸甘油酯的粗品。移动相为正己烷/乙醚(7/3)。过柱2次以达到完全去除甘油二酯、甘油单酯和游离脂肪酸的目的。收集含甘油三酯的洗脱液,利用真空旋转蒸发器去除溶剂。
1.3.2 三油酸甘油酯水解和薄层色谱分析
100 μL三油酸甘油酯、200 μL Tris-HCl缓冲液(0.05 mol/L,pH=7.0)和100 μL溶于缓冲液的酶样加入到2 mL EP管中,在40℃和200 r/min振荡条件下反应1 h。水解产物用200 μL乙醚萃取,并于薄层色谱板上分离,移动相为正己烷/乙醚/甲酸(70/30/1)。利用碘蒸汽使硅胶板上各点显色。
1.4 统计分析
所有试验均做3次平行。相关数据由单因素方差分析进行处理,不同因素或组间的差异利用Duncan's multiplerange test(DMRT)检验。2个因素的非独立样本的差异性则由配对t检验分析。SPSS Statistics 17.0处理了所有的统计分析,P<0.05被认为是具有统计学上的显著性。
2 结果与分析
2.1 操作可行性
如表1所示,山茶油的主要成分为油酸,不含有月桂酸,它的3个位置上的高油酸含量能够确保酶的位置专一性测定不会受到脂肪酸选择性的影响。月桂酸的熔点为44.2℃,并且山茶油能在一定程度上溶解月桂酸,因此,反应体系的液体状态可以保持在44.2℃以下,而液体状态对无溶剂体系的反应是至关重要的。试验表明,反应混合物在40℃仍然工作良好。

表1 山茶油的脂肪酸组成和位置分布
Lipozyme RM IM已长期广泛应用于试验研究和工业生产,因而选择该酶来验证方法的可行性。在选择反应条件时,温度和时间必须纳入考虑范围。不同脂肪酶的最适反应温度可能不同,例如,毕赤酵母(Pichia lynferdii NRRL Y-7723)、铜绿假单胞菌(Pseudomonas aeruginosa)和葡萄球菌(Staphylococcus sp.strain ESW)产脂肪酶分别为 40℃[14]、50~60℃[15]和70℃[16]。但若对一个未知的脂肪酶施以过高的温度并不是明智的选择。所以选定40~60℃和1~8 h作为测试条件。图1为酸解产物甲酯化后气相色谱测定的代表性谱图(反应由 Lipozyme RM IM在50℃催化进行2 h)。

图1 酸解产物甲酯化后气相色谱图
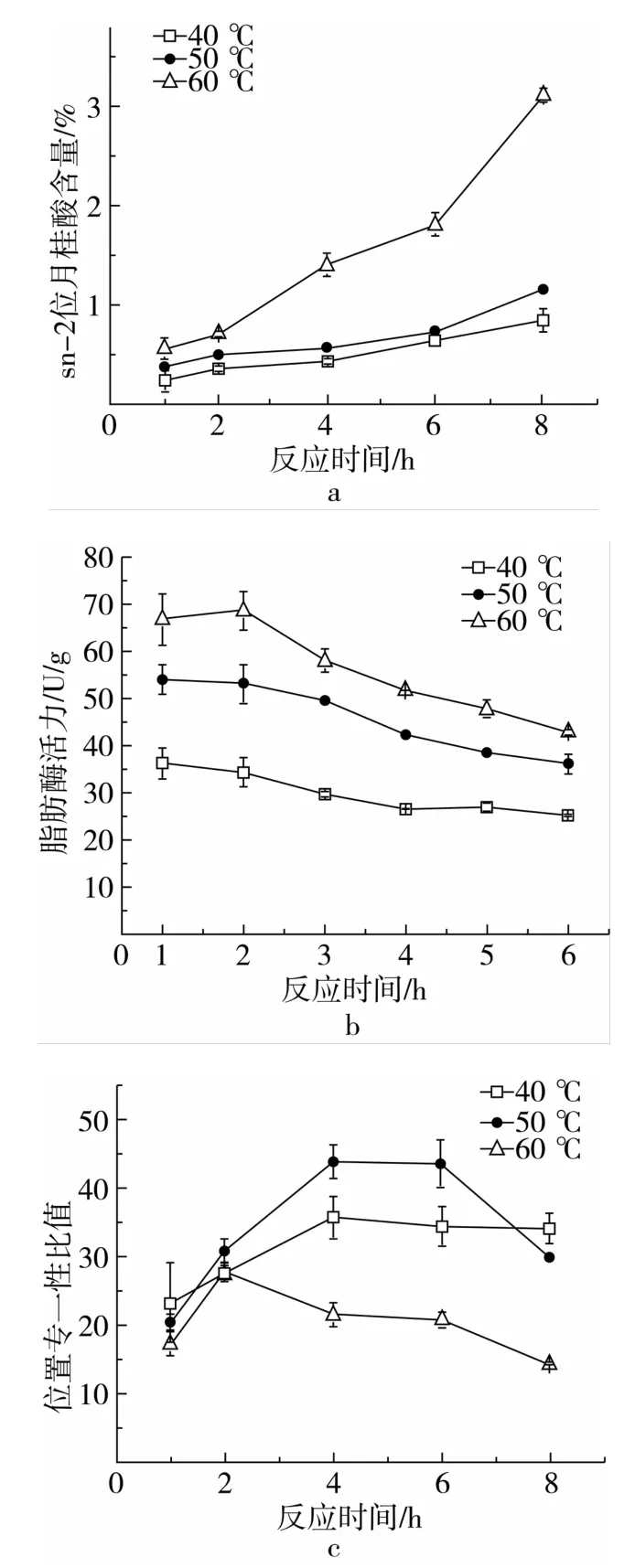
图2 Lipozyme RM IM催化下的酰基迁移酶活力和位置专一性
由于Lipozyme RM IM是一种普遍认可的sn-1 (3)位专一性脂肪酶,因此酰基迁移被认为是sn-2位结合上月桂酸的原因。图2a表明酰基迁移与反应时间和温度相关。60℃时,迁移在前2 h处于低水平,接着便会急剧增加;与此情况相对应的是位置专一性比值在2 h后快速下降(图2c,60℃)。同样的对应性也发生在50℃的6 h后。所以,酰基迁移很可能是造成后期比值降低的原因。由于60℃会严重加剧迁移速率,因而除非是针对嗜热菌,高温条件并不推荐。相对短的反应时间能够最小化酰基迁移的影响,在40℃和50℃时,1%以下的酰基迁移能分别保持8 h和6 h。此外,随着反应的进行,底物的构成将会逐渐发生改变,当游离月桂酸没有处在过量状态时,则可能会影响反应模型的可靠性。如图2b所示,酶催化活力在初期保持稳定,之后则缓慢降低,这很可能源自游离月桂酸减少。经单因素方差分析证明,4 h内的酶活力为同类子集(P>0.05)。在40℃和50℃下,4 h后的专一性比值出现了平台期,说明底物改变的影响已开始出现。如果反应效率和转化率也纳入到考虑范围,为保证鉴定结果的可靠性,50℃和2~4 h是较好的反应条件,特别是对于酶活力较低的脂肪酶,过短的反应时间可能导致得出假1(3)位专一性的结果。但对于热敏性脂肪酶,40℃当然更为适合。配对t检验表明,Lipozyme RM IM催化下,40和50℃的位置专一性比值在4h内无显著性差异。
为了检验此方法对专一性和非专一性脂肪酶是否能有效区分,试验也分析了一个可能的无专一性脂肪酶 Novozym 435。由于其位置专一性比值为1.38到2.25(图3),非常接近理论值1,因而被认定为近似非专一性。由图3可知,50℃时Novozym 435的催化活力低于Lipozyme RM IM,但前者在10 h内一直保持稳定。这是因为,在酶活力相对低的反应体系中,游离月桂酸的过量状态能够维持更长时间。也就是说,对于酸解酶活力低于Lipozyme RM IM的脂肪酶,4 h内一定不会影响结果的可靠性。

图3 50℃时Novozym 435的位置专一性和酶活力
2.2 线性
考虑到常用的酶和底物比,此方案中选择0.1 g作为酶的添加量。但酶的催化活力和获取难易都可能影响其添加量。因此0.05~0.25 g的Lipozyme RM IM,也就是2.6%~13.2%的酶和底物比,都被应用到该方法中,以检验其线性。反应在50℃下进行了2 h。由 OriginPro 8.5计算得出的 R2(图 4a)为0.980 9,这表明总酶活和酶质量具有明显的线性相关,即单位质量的酶活是常量。换句话说,在一定添加范围内,酶和底物比不会影响脂肪酶的分析。图4b显示了不同添加量对位置专一性比值的影响。由图可知,在0.05、0.10和0.25 g 3组中不存在显著性差异;虽然另2组中存在差异,但结论相同,即该脂肪酶为sn-1(3)位专一性。也就是说,不同的酶和底物比不会改变定性判断,但可能会影响专一性的程度。

图4 酶添加量对Lipozyme RM IM总酶活和位置专一性的影响
2.3 适用性和预测性
为了了解该方法的适用性和可预测性,另外4个样品也被分析测定。表2表明,酸解法能够适用于不同的脂肪酶。6种脂肪酶1和4 h酶活的配对t检验再次确认,4 h时模型反应的底物构成仍然适用于酶的分析(P>0.05)。专一性比值显示,L01为弱专一性,L02、L03和L04为sn-1(3)位专一性,且L04的专一性弱于L02和L03。

表2 合成反应中脂肪酶的位置专一性和酶活

表3 不同底物反应中sn-1和3位结合量占总结合量的百分比
在建立的检测方案中,其中1种底物为山茶油,该油的主要成分油酸为单不饱和脂肪酸。饱和脂肪酸棕榈酸在棕榈油中含有(56.16±0.24)%,多不饱和脂肪酸二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)在鱼油中的含量分别为(18.34±0.20)%和(12.22±0.17)%。利用棕榈油和鱼油分别替代山茶油可以达到检验该方法预测性的目的。测定结果见表3。配对t检验证明棕榈油组和鱼油组的差异不显著。组内数据的单因素方差分析表明,由模型反应判定的脂肪酶能够被用于其他甘油酯作为底物的反应,且它们的位置专一性是可预见的。此外,癸酸和肉豆蔻酸也分别取代模型反应底物中的月桂酸来进一步验证,得出的位置专一性与表2的结论是一致的,癸酸组和肉豆蔻酸组的差异也是不显著的。简言之,虽然模型反应的底物为山茶油和月桂酸,但由其评估的脂肪酶的应用并不局限于此反应。
2.4 水解反应和合成反应中位置专一性的对比分析
在薄层色谱法测定水解反应中酶的位置专一性中,三油酸甘油酯最常用。但高纯度的三油酸甘油酯价格太高,特别是对于大规模的筛选任务。如表1所示,山茶油中大约80%为油酸,因而粗三油酸甘油酯可以利用山茶油为原材料通过硅胶柱层析分离得到。虽为粗品,但由于其不含有甘油二酯、甘油单酯和游离脂肪酸,因此能够被成功用于薄层色谱分析。从图5可以得出,Lipozyme RM IM、Novozym 435、L02、L03和L04在水体系中为sn-1(3)位专一性,L01能够催化所有3个位置的酯键。这些结果与文献中的报道一致[17-22]。
从2种方法所得结果的对比可知,Lipozyme RM IM、L01、L02、L03和L04在水解反应和合成反应中的位置专一性是相同的。Sugihara等[17]报道的一种青霉菌(Penicillium abeanum)产的脂肪酶水解sn-1 (3)位酯键的速率是sn-2位的大约9倍,其倾向性与L01在合成反应中的专一性比值(表2)相当接近。显然,差异仅存在于 Novozym 435。Watanabe等[23]认为Novozym 435的位置专一性与反应体系的极性相关,极性越高,专一性越强。Duan等[24]也研究了溶剂对它的位置专一性的影响,随着溶剂的log P值增长,它的专一性会变弱。总之,Novozym 435的位置专一性会受到反应体系的影响,这意味着水解判定法不能总是准确预测脂肪酶在合成反应中的表现。而月桂酸和山茶油在无溶剂体系中的酸解反应则能避免这个问题。此外,对于热敏性脂肪酶催化的反应,可以向体系中添加低极性和高log P值的溶剂,如正己烷等,此类溶剂在降低反应温度的同时对脂肪酶的影响最小。
虽然基于薄层色谱分析的水解法的操作更简单,但酸解法仍然具有一些优势:定量地反映位置专一性和直接体现脂肪酶在无水体系中的特性。但对于酶活过低的脂肪酶,2种方法都不能准确判定其位置专一性。

图5 水解反应中脂肪酶的位置专一性
3 结论
本研究建立了在无溶剂体系中分析脂肪酶的位置专一性的方法。模型反应是以月桂酸和山茶油为底物的酸解反应。考虑到酰基迁移、底物熔点、反应物充足性、转化率和反应效率等,推荐的反应条件为50℃和2~4 h。基于酸解法和水解法判定结果的对比分析,脂肪酶在无水体系和水体系中的位置专一性大多是一致的,除了一些对溶剂体系敏感的酶类,例如Novozym 435。筛选脂肪酶是许多研究领域的基础工作。对于合成反应判定体系,为了便于分析产物的甘油三酯种类和含量,反应底物通常要求是3个位置为相同脂肪酸或者至少1和3位脂肪酸必须相同的高纯度甘油三酯。而本方法降低了该判定体系中对底物纯度的要求,反应成本显著降低,因此,从大量的酶中筛选出适合于特定酯类合成和油脂改性的脂肪酶就变得可行。
[1]Villeneuve P,Muderhwa J M,Graille J,et al.Customizing lipases for biocatalysis:a survey of chemical,physical and molecular biological approaches[J].Journal of Molecular Catalysis B-Enzymatic,2000,9(4-6):113-148
[2]Gandhi N N.Applications of lipase[J].Journal of the A-merican Oil Chemists Society,1997,74(6):621-634
[3]Mander P,Cho S S,Simkhada J R,et al.An organic solvent -tolerant alkaline lipase from Streptomyces sp CS268 and its application in biodiesel production[J].Biotechnology and Bioprocess Engineering,2012,17(1):67-75
[4]Ramani K,Karthikeyan S,Boopathy R,et al.Surface functionalized mesoporous activated carbon for the immobilization of acidic lipase and their application to hydrolysis of waste cooked oil:Isotherm and kinetic studies[J].Process Biochemistry,2012,47(3):435-445
[5]Mahdi B A,Bhattacharya A,Gupta A.Enhanced lipase production from Aeromonas sp S1 using Sal deoiled seed cake as novel natural substrate for potential application in dairy wastewater treatment[J].Journal of Chemical Technology and Biotechnology,2012,87(3):418-426
[6]Jensen R G,Dejong F A,Clark R M.Determination of lipase specificity[J].Lipids,1983,18(3):239-252
[7]Pfeffer J,Richter S,Nieveler J,et al.High yield expression of Lipase A from Candida antarctica in the methylotrophic yeast Pichia pastoris and its purification and characterisation [J].Applied Microbiology and Biotechnology,2006,72 (5):931-938
[8]Yoo H Y,Simkhada J R,Cho S S,et al.A novel alkaline lipase from Ralstonia with potential application in biodiesel production[J].Bioresource Technology,2011,102(10):6104-6111
[9]Meghwanshi G K,Agarwal L,Dutt K,et al.Characterization of 1,3-regiospecific lipases from new Pseudomonas and Bacillus isolates[J].Journal of Molecular Catalysis B-Enzymatic,2006,40(3-4):127-131
[10]Shimada Y,Koga C,Sugihara A,et al.Purification and characterization of a novel solvent-tolerant lipase from Fusarium heterosporum[J].Journal of Fermentation and Bioengineering,1993,75(5):349-352
[11]Yadav R P,Saxena R K,Gupta R,et al.Purification and characterization of a regiospecific lipase from Aspergillus terreus[J].Biotechnology and Applied Biochemistry,1998,28:243-249
[12]Saxena R K,Davidson W S,Sheoran A,et al.Purification and characterization of an alkaline thermostable lipase from Aspergillus carneus[J].Process Biochemistry,2003,39 (2):239-247
[13]Demir B S,Tukel S S.Purification and characterization of lipase from Spirulina platensis[J].Journal of Molecular Catalysis B-Enzymatic,2010,64(3-4):123-128
[14]Kim H R,Hou C T,Lee K T,et al.Enzymatic synthesis of structured lipids using a novel cold-active lipase from Pichia lynferdii NRRL Y-7723[J].Food Chemistry,2010,122(3):846-849
[15]Cherif S,Mnif S,Hadrich F,et al.A newly high alkaline lipase:an ideal choice for application in detergent formulations[J].Lipids in Health and Disease,2011,10(1):221
[16]Karadzic I,Masui A,Zivkovic L I,et al.Purification and characterization of an alkaline lipase from Pseudomonas aeruginosa isolated from putrid mineral cutting oil as component of metalworking fluid[J].Journal of Bioscience and Bioengineering,2006,102(2):82-89
[17]Sugihara A,Shimada Y,Takada N,et al.Penicillium abeanum lipase:Purification,characterization,and its use for docosahexaenoic acid enrichment of tuna oil[J].Journal of Fermentation and Bioengineering,1996,82(5):498-501
[18]Dheeman D S,Antony-Babu S,Frías J M,et al.Purification and characterization of an extracellular lipase from a novel strain Penicillium sp.DS-39(DSM 23773)[J]. Journal of Molecular Catalysis B:Enzymatic,2011,72 (3):256-262
[19]Yadav R P,Saxena R K,Gupta R,et al.Purification and characterization of a regiospecific lipase from Aspergillus terreus[J].Biotechnology and Applied Biochemistry,1998,28(3):243-249
[20]Toida J,Arikawa Y,Kondou K,et al.Purification and characterization of triacylglycerol lipase from Aspergillus oryzae[J].Bioscience,Biotechnology,and Biochemistry,1998,62(4):759-763
[21]Namboodiri V M H,Chattopadhyaya R.Purification and biochemical characterization of a novel thermostable lipase from Aspergillus niger[J].Lipids,2000,35(5):495-502
[22]Mhetras N,Bastawde K,Gokhale D.Purification and characterization of acidic lipase from Aspergillus niger NCIM 1207 [J].Bioresource Technology,2009,100(3):1486-1490
[23]Watanabe Y,Nagao T,Shimada Y.Control of the regiospecificity of Candida antarctica lipase by polarity[J]. New Biotechnology,2009,26(1):23-28
[24]Duan Z Q,Du W,Liu D H.The mechanism of solvent effect on the positional selectivity of Candida Antarctica lipase B during 1,3-diolein synthesis by esterification[J]. Bioresource Technology,2011,102(23):11048-11050.
Analysis of Regioselectivity of Lipases Using Acidolysis of Lauric Acid and Camellia Oil
Cao Xi1Wei Wei1Zhang Xi2Feng Fengqin1
(Zhejiang Key Laboratory for Agriculture Products Processing Technology Research;Department of Food Science and Nutrition,Zhejiang University1,Hangzhou 310058)
(Yunnan College of Traditional Chinese Medicine2,Kunming 650500)
Regioselectivity of lipases played a crucial role in structured lipids synthesis and oil modification. Because of differences between aqueous and non-aqueous systems,regioselectivity analyzed by the conventional hydrolysis method might not always match that in synthesis reactions.In this paper,acidolysis of lauric acid and camellia oil was developed to directly evaluate regioselectivity of lipases in solvent-free system.Fatty acid composition and positional distribution of reaction products were detected by gas chromatography.Through this protocol,Lipozyme RM IM,L02,L03 and L04 were identified as sn-1(3)regioselectivity,L01 was partially selective,and Novozym 435 was nearly non-selective.Predictability of the model reaction had been verified by replacing substrates of lipases. According to the comparative analysis of results of the acidolysis method and hydrolysis one,regioselectivity of lipases under two situations was generally the same,except selectivity of Novozym 435 which was susceptible to solvent systems.Therefore the present method avoided limits of hydrolysis determination results in synthesis reactions.And moreover it lowered the requirement on purity of reactants,which means it can be used to screen numerous lipases at low cost.
lipase,regioselectivity,camellia oil,acidolysis,synthesis
TQ925+.6
A
1003-0174(2017)03-0074-07
浙江省重大科技专项(2012C12005-2)
2015-08-13
曹茜,女,1988年出生,博士,食品科学
冯凤琴,女,1964年出生,教授,博士生导师,食品化学与食品生物技术

