银杏叶提取物对人胚肺成纤维细胞增殖与凋亡的干预研究
张兴彩,蔡余力,张伟,陈宪海
(山东中医药大学附属医院肺病科,山东 济南 250011)
银杏叶提取物对人胚肺成纤维细胞增殖与凋亡的干预研究
张兴彩,蔡余力,张伟,陈宪海
(山东中医药大学附属医院肺病科,山东 济南 250011)
目的:观察银杏叶提取物对人胚肺成纤维细胞增殖、凋亡的影响,为临床治疗肺纤维化提供理论依据。方法:HELF细胞培养后,分别分为A对照组;B模型组加入TGF-β1;C1-3TGF-β1+银杏叶提取物低中高剂量组。MTT法测量各孔吸光度OD值并计算各药物组细胞生长抑制率,流式细胞术Annexin V/PI双染色法检测细胞凋亡率。结果:与对照组相比,模型组细胞OD值明显升高;与模型组相比,银杏叶提取物各浓度组细胞增殖OD值均明显降低,其中高浓度组明显低于中、低浓度组,经统计学处理,有显著差异性(P<0.05)。与对照组相比,模型组细胞凋亡率明显降低;与模型组相比,银杏叶提取物各浓度组细胞凋亡率均明显升高,其中高浓度组明显高于中、低浓度组,经统计学处理,有显著差异性(P<0.05)。结论:TGF-β1可明显促进成肺纤维细胞的增殖,抑制其凋亡;银杏叶提取物具有抑制肺成纤维细胞增殖,促进其凋亡的作用,且作用成一定量效相关。
TGF-β;人胚肺成纤维细胞(HELF);银杏叶提取物;肺纤维化
肺间质纤维化(简称肺纤维化)是最常见的肺间质疾病,也是呼吸系统最严重疾病之一。它累及肺间质、肺泡和(或)细支气管的肺部弥漫性疾病,其主要病理改变为弥漫性肺泡炎症,肺泡上皮细胞持续损伤,肺成纤维细胞过度增殖,细胞外基质的反复修复和过度沉积。目前已有多种中药制剂用于治疗肺纤维化,其疗效及可能的作用机制都尚未明确[1-2]。目前关于中药对肺纤维化的研究多以动物模型为实验对象,与人体研究结果尚存在差异。本研究通过体外培养人胚肺成纤维细胞HELF,利用TGF-β诱导其肺纤维化模型, 观察银杏叶提取物对细胞增殖、细胞凋亡的影响。进一步探讨中药的作用机理,为临床治疗肺纤维化提供理论依据。
1 实验材料
1.1 实验细胞
实验所用细胞株购自南京凯基生物科技发展有限公司,使用含10%的胎牛血清的α-MEM培养基,置入5%CO2、37℃培养箱中培养HLF-Ⅰ细胞,当培养瓶内细胞生长达80%左右时,用胰酶消化传代,选择第3~4代细胞用于实验。
1.2 实验药物
银杏叶提取物:商品名金纳多,17.5 mg/5 mL,批准文号:X20010117,德国威玛舒培博士药厂。
1.3 主要试剂
小牛血清:南京凯基生物科技发展有限公司;α-MEM培养基(含青霉素、链霉素):南京凯基生物科技发展有限公司;GF-β1(储存液:0.01 μg/μL;工作液:1 ng/5 μL;终浓度:1 ng/mL):南京凯基生物科技发展有限公司;胰蛋白酶:美国Sigma公司;二甲基亚砜(DMSO):美国Sigma公司;MTT:美国Amresco公司;碘化丙啶(PI):美国Sigma公司;其它常规化学试剂均为进口或国产分析纯产品。
1.4 主要仪器
超净工作台:YZ-875 苏州净化设备厂;低温离心机:国产,仪器型号:TG16W;流式细胞仪:Beckman XL型,Beckman Coulter 公司;CO2培养箱:国产,仪器型号:GNP-9080型;恒温水浴箱:江苏常州国华仪器厂;振荡混合仪:美国,仪器型号:S0200-230V;酶联免疫检测仪:TAKARA,日本;紫外分光光度计:ND1000,美国;移液枪:吉尔森。
1.5 主要试剂的配制
培养液:90%培养基+10%胎牛血清;消化液:胰蛋白酶-EDTA消化液;冻存液:10%DMSO+90%胎牛血清;PBS(磷酸盐缓冲液):0.2 mol/L 磷酸氢二钠溶液+磷酸氢二钠(无水)28.4 g+氯化钠8.77 g+去离子水或双蒸水至1000 mL。调pH至7.2,高压灭菌。
2 方法
2.1 HELF细胞分组处理
2.1.1 收集细胞并记数
大培养瓶内细胞经胰酶消化后,离心收集,弃上清液,用新的培养液定容至4mL,取少量用血球计数板计数。
2.1.2 细胞接种至培养板
96孔板用于MTT实验,按照实验分组接种,每组5个复孔,使细胞浓度达到:1×105个/mL,体积:200 μL/孔;16孔板用于流式凋亡细胞检测,每组3个复孔,使细胞浓度达到:1×105个/mL,体积:2 mL/孔。混匀,5%CO2、37℃培养箱中贴壁培养4 h。
2.1.3 实验分组
A组为对照组;B组为模型组加入TGF-β1(1 ng/mL);C1组加入TGF-β1(1 ng/mL) +银杏叶提取物(5 μL/mL);C2组加入TGF-β1(1 ng/mL)+银杏叶提取物(10 μL/mL);C3组加入TGF-β1(1 ng/mL)+银杏叶提取物(20 μL/mL);12孔板每组各6个复孔,96孔板每组各5个复孔。加药后充分混匀,孵育24 h。
2.2 方法
2.2.1 MTT实验
96孔板,每孔加入200 μL的培养液,铺板使待测细胞调密度至1×105个/mL,(边缘孔用无菌PBS填充)。提前4 h每孔加入MTT(噻唑蓝)10 μL,轻晃混匀,放入CO2培养箱培养,若药物与MTT能够反应,可先离心后弃去培养液,小心用PBS冲2~3遍后,再加入含MTT的培养液。4 h后取出板,弃上清液,在预先准备好的吸水纸上轻拍两下,弃净上清液。用排枪加入DMSO(二甲基亚砜),在振荡器上低速震荡10 min,使结晶物充分溶解。490 nm波长依序测量各孔吸光度OD值并计算各药物组细胞生长抑制率。细胞生长抑制率计算公式:生长抑制率=(对照组OD值-药物组OD值)/对照组OD值×100%。
2.2.2 流式检测细胞凋亡
药物作用24 h后,从CO2培养箱取出12孔板,拍照,每孔取1 mL上清液至1.5 mLEP管,置于-80℃冻存,用于ELISA法检测培养上清液中的蛋白含量。取净剩余上清液,1×PBS(磷酸缓冲盐溶液)洗2遍,加入适量胰酶消化,用培养液终止消化,收集细胞至EP管,4℃离心,650 g,7 min,1×PBS洗2遍,用500 μL 1×binding buffer重悬细胞,过滤转管,抗体标记:FITC-Annexin V 4μL,PI 8μL,室度避光孵育5 min,上机检测(分析软件:采用Winmidi 2.9分析)。结果判断:凋亡细胞对细胞活性染料PI有抗染性,坏死细胞则不能。细胞膜有损伤的细胞的DNA可被PI着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期PI不会着染而没有红色荧光信号。正常活细胞与此相似。
2.3 观察指标
2.3.1 对细胞增殖的影响
MMT法检测人胚肺成纤维细胞增殖情况,以确定TGF-β1对其增殖的影响,以及药物对细胞增殖的抑制作用。
2.3.2 对细胞凋亡的影响
流式细胞术Annexin V/PI双染色法检测细胞凋亡率。
2.4 统计学方法

3 结果
3.1 MTT实验

表1 MTT实验结果
注:与模型组比较,△P<0.05;与不同浓度组比较,▲P<0.05;与对照组比较,★P<0.05
见表1。与对照组相比,模型组细胞OD值明显升高;与模型组相比,银杏叶提取物各浓度组细胞增殖OD值均明显降低,其中高浓度组明显低于中、低浓度组,经统计学处理,有显著差异性(P<0.05)。
3.2 流式检测细胞凋亡
见表2、图1。与对照组相比,模型组细胞凋亡率明显降低;与模型组相比,银杏叶提取物各浓度组细胞凋亡率均明显升高,其中高浓度组明显高于中、低浓度组,经统计学处理,有显著差异性(P<0.05)。

图1 各组流式细胞凋亡散点图(B2-坏死细胞,B3-活细胞,B4-凋亡细胞)
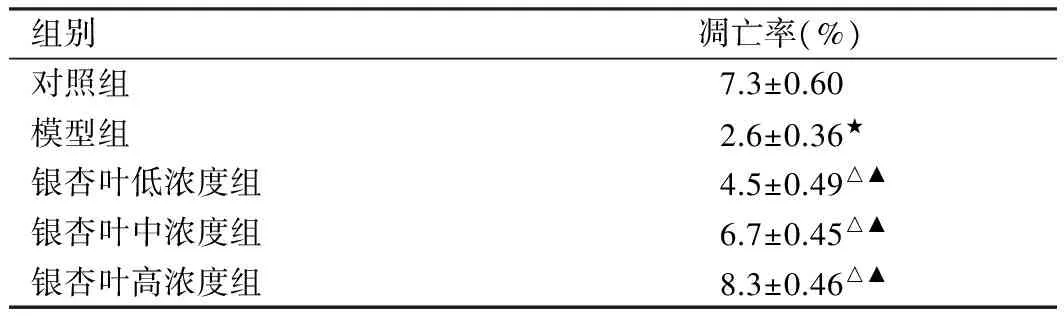
组别凋亡率(%)对照组7.3±0.60模型组2.6±0.36★银杏叶低浓度组4.5±0.49△▲银杏叶中浓度组6.7±0.45△▲银杏叶高浓度组8.3±0.46△▲
注:与模型组比较,△P<0.05;与同种药物不同浓度组比较,▲P<0.05;与对照组比较,★P<0.05
4 讨论
银杏叶为银杏科植物银杏的干燥叶,性味苦、涩,平。具有敛肺平喘,活血止痛之功效。银杏叶提取物以银杏黄酮为主要活性成分具有扩张血管、改善微循环及抗氧化、清除氧自由基的作用。有实验证实银杏叶提取物可抑制TGF-β1诱导人肾小管上皮细胞的α-SMA及Ⅰ型胶原的表达[3];从银杏叶中分离的成分Bioparyl可以调节核糖核酸酶的活性,防止或逆转各组织的纤维变性[4];银杏叶提取物能够有效抑制实验性肺纤维化大鼠血清PDGF和TGF-β1的表达, 对肺纤维化具有一定的防治作用[5];银杏叶制剂可以抑制NF-kB活性,从而使其调控的TGF-βmRNA表达及其蛋白分泌降低,而使肺泡炎及纤维化的程度减轻[6]。目前,相关研究主要以动物实验为主,尚缺乏大样本的临床研究资料。
肺纤维化过程中的一个重要病理特点就是成纤维细胞的异常分裂增殖,正常情况下肺组织内成纤维细胞处于静息状态,当纤维化发生时,成纤维细胞受到内外各种因素的刺激活化,从静息状态转变为过度增殖状态,使成纤维细胞的数目不断增加。过多的成纤维细胞逐渐形成肺部的成纤维灶,取代正常的肺组织,导致肺部结构的异常重塑,进而诱发肺间质纤维化。这一过程是成纤维细胞参与肺纤维化的重要方面。发生肺纤维化时,活化的成纤维细胞发生功能和表型改变,转化为可以表达α-SMA的肌成纤维细胞[7]。肌成纤维细胞同时具有成纤维细胞和平滑肌细胞的特性,导致纤维化后肺组织的机械特性发生改变,顺应性降低。研究发现, 肌成纤维细胞的凋亡在纤维化的发展过程中受到抑制,而且持续存在,从而导致纤维化进行性发展。因此,通过促进成纤维细胞的凋亡,有利于肺纤维化恢复[8]。
本实验研究结果表明:银杏叶提取物可以抑制肺成纤维细胞的异常增殖,并促进肺成纤维细胞凋亡,其中高浓度组作用最显著,结果显示其作用呈一定的量效相关关系。由此推测银杏叶提取物主要通过干预肺成纤维细胞的增殖与凋亡,起到减缓和阻断肺纤维化的发生与发展的作用。目前,中药制剂已广泛应用于肺纤维化的临床治疗,但不同药物的作用靶点不尽相同,在中医辨证论治与辨病论治相结合的基础上,更加深入了解中药制剂的作用机理,将有助于揭示肺纤维化的中医病因病机实质,获得更好的临床疗效。
[1] 张伟,郑建,朱雪,等.益气类中药对博莱霉素所致肺纤维化大鼠血管新生机制的影响[J].中医药信息,2014,31(4):85-88.
[2] 左冬冬,滕林,李兰.软坚通络益气养阴法治疗特发性肺间质纤维化的临床观察[J].中医药信息,2015,32(1):106-108.
[3] 刘娜,严海东,李雪竹.银杏叶提取物对TGF-1诱导α-SMA和Ⅰ型胶原表达的抑制作用[J].上海交通大学学报(医学版),2008,28(4):399-402.
[4] 李俊义,成丽.银杏叶资源开发与应用研究概况[J].华西药学杂志,1994,9(1):39-40.
[5] 丁明桥,许朝霞,陈瑞,等.银杏叶提取物对肺纤维化大鼠模型血清PDGF及TGF-1的影响[J].长春中医药大学学报,2011,27(4):519-520.
[6] Kim S H, Park K S,Chang M J,et al.Efects of Panax ginseng extract on exercise-induced oxidative stress [J].Sports Med Phys Fitness,2005,45(2):178-182.
[7] Willis BC,L ieb ler JM,Luby-PhelpsK,et al. Induction of epithelial mesenchymal transition in alveolar epithelia1 cells by transforming growth factor-beta1:potential role in idiopathic pulmonary fibrosis[J].Am J Pathol,2005,166:1321-1332.
[8] Phan SH.The myofibrob last in pulmonary fibrosis[J].Chest,2002,122(Suppl6):S286-S289.
Effect of Ginkgo Biloba Extract on Proliferation and Apoptosis ofHuman Embryonic Lung Fibroblasts
ZHANG Xing-cai, CAI Yu-li, ZHANG Wei, CHEN Xian-hai
(DepartmentofLungDiseases,AffiliatedHospitalofShandongUniversityofTraditionalChineseMedicine,Jinan250011,China)
Objective:The research observed the effect of ginkgo biloba extract on the proliferation and apoptosis of human embryonic lung fibroblasts ,to provided the theory basis for clinical treatment of pulmonary fibrosis. Methods: After HELF cell culture, the cells were divided into control group A, model group B which was added withTGF-β1, groups C1-3 which were added withTGF-β1and ginkgo biloba extract from low to high doses. Each hole absorbance of OD value was measured by MTT method and the cell growth inhibition rate of all drug groups were calculated, and the cell apoptosis rates were detected by flow cytometry Annexin V/PI double staining method. Results: The cell OD value of the model group B was increased significantly compared with that of the control group A; the cell OD value of groups C1-3 which were added withTGF-β1 and ginkgo biloba extract from low to high doses were significantly lower compared with model group B, and the cell OD value of group C3 which was added withTGF-β1 and ginkgo biloba extract of high dose was significantly lower than that of the medium dose or the low dose.There was a significant difference after statistics processing (P<0.05).The cell apoptosis rate of model group B was significantly decreased compared with that of control group A; the cell apoptosis rate of groups C1-3 which were added withTGF-β1 and ginkgo biloba extract from low to high doses were significantly higher compared with that of model group B, and the cell apoptosis rate of group C3 which was added with TGF-β1 and ginkgo biloba extract of high dose was significantly higher than that of the medium dose or the low dose. There was a significant difference after statistics processing (P<0.05). Conclusion: The TGF-β1 can obviously promote the proliferation of the lung fibroblasts, inhibit its apoptosis; Ginkgo biloba extract can inhibit the proliferation and promote the apoptosis of the lung fibroblast, and the effect is related to the dose.
TGF-β1; Human embryonic lung fibroblasts (HELF); Ginkgo biloba extract; Pulmonary fibrosis
2016-04-08
2016-09-03
中医肺病学泰山学者岗位资金资助(ts20110819);山东省博士后创新项目专项基金(201303066)
张兴彩(1974-),女,博士,副主任医师,硕士研究生导师,主要从事中医肺病学专业。
R285.5
A
1002-2392(2017)02-0029-04

