Aβ42对果蝇攻击和交配等社交行为的不同调节作用
宋 纤,平 勇
(上海交通大学Bio-X研究院,教育部遗传发育与精神疾病重点实验室,上海 闵行 200240)
Aβ42对果蝇攻击和交配等社交行为的不同调节作用
宋 纤,平 勇
(上海交通大学Bio-X研究院,教育部遗传发育与精神疾病重点实验室,上海 闵行 200240)
Aβ42(β-amyloid 42)蛋白聚集的毒性作用可能是阿尔兹海默病(Alzheimer’s disease,AD)的主要病因之一.运用模式生物果蝇研究Aβ42可能对果蝇部分社交行为的影响.首先,在Aβ42果蝇AD模型中观察到Aβ42在果蝇神经中枢蘑菇体区域的聚集和沉积.然后,观察Aβ42果蝇的攻击性,实验发现Aβ42能加速首次攻击时间,并增加攻击频率等.最后,观察Aβ42果蝇的交配行为.实验证明,表达Aβ42可以增强中年果蝇攻击性行为,而对交配取向没有明显作用.实验结果可为后续深入研究Aβ42对攻击性行为影响的神经环路和分子基础提供参考.
果蝇;β淀粉样蛋白;社交行为;攻击性行为;调节作用
0 引言
阿尔兹海默病(Alzheimer’s disease,AD)是一种起病相对隐匿的进行性发展的神经系统退行性疾病,并且一般发病较晚,大多在65岁以上.中国已进入老龄化社会,老龄人比例将逐步升高,AD患者数量也将呈递增趋势[1].AD最常见的临床问题是出现认知障碍.通过多种动物模型研究,在细胞分子水平上,已获得相当多的研究成果,从神经元突触的变化到神经元凋亡等[2-4].除了认知问题外,AD病人也会出现一些精神紊乱和社交障碍[5],包括部分病人相对具有较强的攻击性[6].在与AD相关的小鼠APP(amyloidprecursorprotein)基因突变体中也有类似现象[7].为此,需要了解这些社交行为变化的细胞分子基础,为针对性治疗提供实验和理论支持.
果蝇行为学研究历史久远[8],从节律睡眠到交配机制研究等均有涉及[9-10].关于果蝇攻击性研究可以追溯到1915年[11].最近,对果蝇攻击性和交配取向又有了更多新的认识[12-14],比如章鱼胺能神经元参与调控果蝇攻击性行为[13]等.考虑到果蝇也是众多神经退行性疾病研究的模式生物[15-17],果蝇行为学研究或许能为一些神经疾病的研究如AD等贡献力量.
Aβ42在脑内的聚集被认为是引起AD的主要病因之一[4].利用模式生物可以获得更多的关于AD病发的分子机制,例如,前期工作利用Aβ42果蝇发现了AD果蝇中神经元兴奋性变化的分子基础,即Aβ42下调一类钾通道(Kv4)表达[18].除此之外,已有更多的下游分子被发现[15].因此,Aβ42果蝇是研究AD病理基础的重要动物模型之一[15,19].
本研究率先用AD果蝇模型检测其部分社交行为,包括攻击性行为和交配取向行为.实验发现表达Aβ42能增强大龄果蝇的攻击性行为,包括攻击频率增加等,而Aβ42对交配取向行为则没有明显影响.
1 材料与方法
1.1 实验材料与试剂
实验中用到的果蝇有elav-Gal4;UAS-Aβ42,W;UAS-Aβ40,elav-Gal4;+;其中UAS-Aβ42和UAS-Aβ40系来自美国科罗拉多州立大学生物医学部Susan Tsunoda教授和清华大学钟毅教授的实验室.所有果蝇都在明暗12 h交替,温度25 ℃的环境中培养.实验中所用到的果蝇无论雌雄都挑选羽化8 h以内的果蝇.实验中用到的5#剥脑镊子购自广州伯齐生物科技有限公司,后经磨尖等处理;Triton、多聚甲醛以及PBS磷酸缓冲液均购自美国SIGMA公司;BSA和Rhodamine二抗购自上海生物生工有限公司;抗荧光衰减封片剂(fluorescent mounting medium)购自美国Dako公司;果蝇培养液、Thioflavin S( TS )购自美国SIGMA公司;Anti-β-Amyloid(1-42)抗体购自美国CALBIOCHEM公司;普通体式显微镜购于意大利OPTIKA公司;激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)来自德国LEICA公司.
1.2 果蝇杂交实验
挑选处女蝇elav-Gal4;+;+与雄果蝇W;UAS-Aβ40,将其放在同一管食物里置于25 ℃环境中培养繁殖.10 d后转走亲代果蝇,挑选刚羽化出来的子一代elav-Gal4;UAS-Aβ40果蝇进行后续实验.
1.3 脑组织切片ThioflavinS(TS)染色
分别挑选7 d左右的elav-Gal4;UAS-Aβ42和elav-Gal4;UAS-Aβ40雄性果蝇,用CO2迷晕后置于90倍体式显微镜下在果蝇培养液中剥离脑组织.将剥离干净的脑组织放置多聚甲醛溶液中室温固定30 min,之后用2%(体积分数,以下同)的PBT(PBS+Triton)溶液清洗3~4次,使细胞膜孔打开,每次10~15 min.接着将脑组织转入0.025 g·mL-1的TS溶液(0.25 g TS,5 mL PBS,5 mL Ethanol)中,4 ℃冰箱过夜.第二天,在50%(体积分数)的酒精中清洗浸泡10 min进行脱色,再用2%的PBT溶液清洗3~4次,每次5 min.最后滴加封片剂进行封片.
在加入Anti-β-Amyloid(1-42)抗体(Rabbit pAb,Calbiochem)实验中,固定清洗后加入适量的10% BSA(BSA+2% PBT,质量分数,以下同)溶液进行封闭.30 min后,加入1 μL抗体和100 μL的10% BSA溶液(抗体体积分数为1∶100),置于4℃冰箱过夜.第二天,继续用2%的PBT溶液清洗4~5次,每次5~10 min.过后加入1 μL的Rhodamine二抗和100 μL的10% BSA溶液,室温避光封闭1 h后再用PBT溶液清洗3~4次,每次5 min.然后滴加适量封片剂封片,避光保存,在-20 ℃冰箱放置2 h后进行激光扫描共聚焦显微成像实验[18].
1.4果蝇攻击性实验
收集羽化8 h以内的果蝇,将实验组和对照组果蝇都分别分成7 d和15 d两个不同年龄段的组别.将每只需要测试的雄果蝇单独饲养在5 mm×60 mm的小管里.果蝇饲养到第7天或第15天的时候,分别将对照组和实验组的果蝇各自成对地放入测试室进行攻击性行为实验.测试室是15 mm×15 mm×8 mm的手工制作的小纸盒,果蝇迷晕放进去后,盖上18 mm×18 mm的盖玻片.需要注意的是,测试室里面必须放有充足的食物.待果蝇苏醒后,记录15 min内的攻击次数以及第一次发起攻击的时间.实验过程通过摄像头拍摄.攻击行为包括俯冲/追逐等,检测参见文献[20].
1.5 果蝇交配取向实验
大量收集羽化8 h以内的果蝇.其中,将测试需要用的雄果蝇(test fly)单独放置在盛有适量食物的小管里培养7 d或15 d,而供选择交配的目标雄性果蝇和雌性果蝇(testee male or female)则分别群体培养相应的天数.第7天以及第15天的时候,将群体饲养的雄果蝇和雌果蝇分别断头后固定在用来供选择交配的小型一次性培养皿的两端.之后,将迷晕的测试雄果蝇放入,待其苏醒后,将在两只去头的目标果蝇中选择它要交配的对象,记录其2 h内选择不同的交配对象的交配时间.实验过程通过摄像头拍摄,参见文献[14].计算交配取向指数,公式如下:
Preference Index(PI)=(tfemale-tmale)/(tfemale+tmale)×100%
1.6 数据分析
获得数据通过Sigma Plot 10、Coreldraw、Photoshop CS2等软件分析并作图.数据完全根据实验方法所获得,每组数据分析采用平均值±标准误差(mean ± SEM).对于成正态分布的数据一般通过student’s test和ANOVA(多组)比较分析,分为匹配比较和非匹配比较两种.当*P值小于0.05,即为有显著性差异,同时设定**P< 0.01,***P< 0.001.
2 实验结果
2.1 Aβ42果蝇脑内出现Aβ缠结
分别将相同年龄段的elav-Gal4;UAS-Aβ42,elav-Gal4;UAS-Aβ40雄果蝇迷晕剥取脑组织,固定后用TS染色制成脑切片.TS即硫代黄素S,是一种混合物,来自于甲基化的脱氢硫甲苯胺和磺酸,可以用于对阿尔兹海默斑点进行染色.elav-Gal4是一种pan-Gal4,可以驱动UAS-目的基因在全神经元范围内的表达.elav-Gal4;UAS-Aβ40基因型的果蝇表达神经毒性相对较小的Aβ40(记为Aβ40)[19],实验组则为Aβ42.进而,在激光共聚焦扫描显微镜下观察TS标记的Aβ缠结.图1(a)左侧图显示的是通过TS染色的Aβ40果蝇神经中枢蘑菇体(mushroom body,MB)区域的情况,颜色较暗,几乎没有染上;图1(a)右侧图为Aβ42果蝇脑切片,颜色鲜亮,在镜下可以看到MB区域有非常明显的缠结.这结果说明TS识别了Aβ42果蝇中由Aβ42形成的缠结,而Aβ40果蝇则几乎没有缠结.一般认为,长肽Aβ42相较Aβ40而言更易形成纤维缠结.而在诱导遗传型AD的早老素突变的小鼠模型中,虽然总量可能降低,目前认为Aβ42/Aβ40比例增加而导致纤维缠结的出现[21],提示Aβ40可能具备抑制Aβ42形成缠结的功能.Aβ40果蝇没有出现缠结可能的解释包括:① 驱动表达的Aβ40量不足以形成缠结;② 果蝇脑内环境(包括Aβ40清除)不利于Aβ40形成缠结.
接着,检测Aβ42果蝇脑内Aβ42蛋白的表达情况.分别加入相同体积比(1∶100)的Aβ42抗体制成脑切片后继续在显微镜下观察,图1(b)分别显示的是通过Aβ42抗体标记的对照组w;UAS-Aβ42 (Control,Ctr)果蝇和实验组Aβ42果蝇MB区域Aβ42蛋白表达的共聚焦图.与TS染色结果基本一致,对照组依然没有看到明显的Aβ42蛋白表达,而统计分析发现实验组Aβ42蛋白表达量则显著高于对照组(见图1(c)).

图1 Aβ42果蝇脑内MB区域出现Aβ缠结Fig.1 Aβ42 depositions in Aβ42 flies,but not in Aβ40 or Ctr flies
2.2 Aβ42果蝇影响果蝇攻击性行为
分别测试实验组Aβ42果蝇和对照组Aβ40果蝇在7 d以及15 d大小时的攻击性行为.果蝇的生活周期较短,7 d的AD果蝇正处于青年时期,而15 d时已接近中年.在果蝇攻击性行为实验中主要统计两个数据:一是果蝇进入攻击室苏醒后15 min内首次发起攻击的时间,即第一次攻击开始的延时(latency);二是15 min内攻击的次数(即频率,frequency).图2(a)左边的柱状图显示的是对照组和实验组年轻果蝇首次攻击的延时时间平均值.可以看到它们几乎都是在200 s后才开始发动攻击,且Aβ40果蝇和Aβ42果蝇之间没有显著差异.当继续测试15 d大小的果蝇攻击性实验时,发现Aβ40果蝇和Aβ42果蝇之间有了明显的差异.Aβ40果蝇进入攻击室后2 min左右才会出现第一次攻击对方,而Aβ42果蝇的延时明显短于Aβ40果蝇,如图2(a)右边所示.选用Aβ40对照组主要考虑到转基因背景对果蝇可能潜在的影响,相较野生型果蝇,Aβ40果蝇作为对照组更为适宜.Aβ40果蝇在14 d出现攻击潜伏时间缩短现象,在野生型果蝇中也观察到类似现象.
分析其在15 min之内攻击的次数,不同年龄段不同基因型的果蝇的表现很不一致.年轻的果蝇,不管是实验组还是对照组,似乎都不具备强的攻击性,彼此之间也没有很大的差别.而当它们到中年时,实验组和对照组果蝇的攻击频率都增大了,且实验组果蝇增加的幅度高于对照组,攻击次数显著高于对照组,见图2(b).实验结果说明,Aβ42能加速首次攻击时间,且增强中年AD果蝇的攻击性行为.
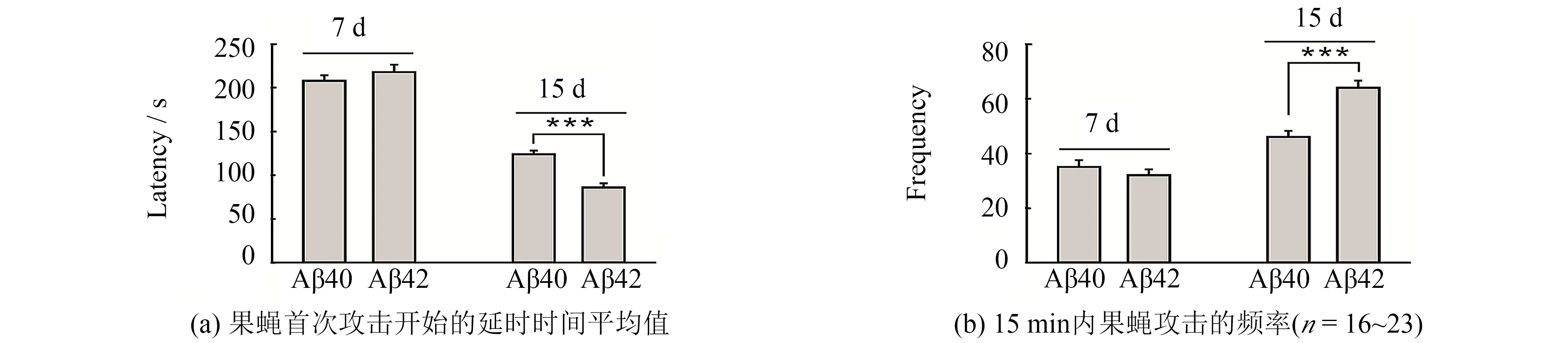
图2 Aβ42增强中年果蝇的攻击性行为Fig.2 Aβ42 expression enhances aggression behaviors in mid-aged flies
2.3 Aβ42果蝇对交配取向行为没有影响
为了进一步观察Aβ42对果蝇的其它的行为是否有影响,除去已被大众所熟知的的学习记忆等,研究方向定在果蝇的交配取向行为上.继续选取Aβ40果蝇作为Aβ42果蝇的对照组,继续检测不同年龄段的交配取向行为实验.当果蝇饲养至7 d大小时,将目标雌雄果蝇分别断头放在测试皿的两端,之后将迷晕的测试果蝇放在中间位置,距离断头果蝇距离几乎相同,见图3(a).待其苏醒后,记录2 h内测试果蝇分别与断头雌果蝇和雄果蝇的交配行为时间,分别记作tfemale和tmale.统计交配取向指数PI如图3(b)所示:Aβ40和Aβ42果蝇之间没有显著性变化.是不是如攻击性行为实验一样,Aβ42果蝇的交配取向行为也要到中年时才会有显著差异呢?于是又做了15 d大小果蝇的交配取向行为实验.这一次,Aβ40和Aβ42组之间依然没有任何显著性变化.这些结果说明了Aβ42不改变雄性果蝇交配取向.

图3 Aβ42不改变雄性果蝇交配取向 Fig.3 Aβ42 expression doesn’t change the mating orientation of the flies
3 结语
实验结果首次证明了Aβ42表达能影响部分果蝇社交行为,如攻击性行为,而对交配取向则没有明显作用.这些结果与对AD病人的观察基本一致,比如一些AD病人在早期也会出现攻击性行为.这些结果提示,今后可以利用果蝇AD模型,深入研究一些社交行为变化的神经环路和细胞分子基础.
AD病人如何会出现社交障碍?社会活动经验是现代化生活的必须知识,且主要是后天通过与环境和其他人交互作用而获得[22].在退行性疾病如AD中,会出现多种不同层面的衰退,从突触消失,到神经元凋亡、行为异常[2,23].在果蝇中,控制社交行为如攻击性行为的神经中枢目前还不明确[12-13].下一步将研究控制攻击性行为的中枢神经网络系统.进而观察在AD模型中,网络功能的可能变化以及推测其对攻击性行为的影响.研究也提示了果蝇脑内部分中间神经元参与调控果蝇攻击性行为[12-13],因此,后续可以找出Aβ42果蝇的中间神经元活动的变化是否导致攻击性行为变化.
[1] 宁宇,李波,方芳,等.人口老龄化与老年人口健康及疾病问题的研究进展[J].吉林大学学报(医学版),2008,34(4):1 102-1 105.
[2] SELKOE D J.Alzheimer’s disease[M].New York:Cold Spring Harb Perspect Biol,2011:1-198.
[3] SELKOE D J.Preventing Alzheimer’s disease[J].Science,2012,337(6 101):1 488-1 492.
[4] WALSH D M,SELKOE D J.A beta oligomers:a decade of discovery[J].J Neurochem,2007,101(5):1 172-1 184.
[5] LI X L,HU N,TAN M S,etal.Behavioral and psychological symptoms in Alzheimer’s disease[J].Biomed Res Int,2014,2014(13):927-934.
[6] BALLARD C,CORBETT A.Agitation and aggression in people with Alzheimer’s disease[J].Curr Opin Psychiatry,2013,26(3):252-259.
[7] LALONDE R,FUKUCHI K,STRAZIELLE C.APP transgenic mice for modelling behavioural and psychological symptoms of dementia(BPSD)[J].Neurosci Biobehav Rev,2012,36(5):1 357-1 375.
[8] BELLEN H J,TONG C,TSUDA H.100 years ofDrosophilaresearch and its impact on vertebrate neuroscience:a history lesson for the future[J].Nat Rev Neurosci,2010,11(7):514-522.
[9] OZKAYA O,ROSATO E.The circadian clock of the fly:a neurogenetics journey through time[J].Adv Genet,2012,77:79-123.
[10] YAMAMOTO D,KOGANEZAWA M.Genes and circuits of courtship behaviour inDrosophilamales[J].Nat Rev Neurosci,2013,14(10):681-692.
[11] STURTEVANT A H.Experiments on sex recognition and the problem of sexual selection inDrosophila[J].Anim Behav,1915,5:351-366.
[12] LIU W,LIANG X,GONG J,etal.Social regulation of aggression by pheromonal activation of Or65a olfactory neurons inDrosophila[J].Nat Neurosci,2011,14(7):896-902.
[13] ZHOU C,RAO Y.A subset of octopaminergic neurons are important forDrosophilaaggression[J].Nat Neurosci,2008,11(9):1 059-1 067.
[14] SHAO L,SHUAI Y,WANG J,etal.Schizophrenia susceptibility gene dysbindin regulates glutamatergic and dopaminergic functions via distinctive mechanisms inDrosophila[J].Proc Natl Acad Sci U S A,2011,108(46):18 831-18 836.
[15] FERNANDEZ-FUNEZ P,DE MENA L,RINCON-LIMAS D E.Modeling the complex pathology of Alzheimer’s disease inDrosophila[J].Exp Neurol,2015,274(Pt A):58-71.
[16] FINELLI A,KELKAR A,SONG H J,etal.A model for studying Alzheimer’s Abeta42-induced toxicity inDrosophilamelanogaster[J].Mol Cell Neurosci,2004,26(3):365-375.
[17] LU B,VOGEL H.Drosophilamodels of neurodegenerative diseases[J].Annu Rev Pathol,2009,4(4):315-342.
[18] PING Y,HAHM E T,WARO G,etal.Linking abeta42-induced hyperexcitability to neurodegeneration,learning and motor deficits,and a shorter lifespan in an Alzheimer’s model[J].PLoS Genet,2015,11(3):e1005025.
[19] IIJIMA K,LIU H P,CHIANG A S,etal.Dissecting the pathological effects of human Abeta40 and Abeta42 inDrosophila:a potential model for Alzheimer’s disease[J].Proc Natl Acad Sci U S A,2004,101(17):6 623-6 628.
[20] CHEN S,LEE A Y,BOWENS N M,etal.Fighting fruit flies:a model system for the study of aggression[J].Proc Natl Acad Sci U S A,2002,99(8):5 664-5 668.
[21] XIA D,WATANABE H,WU B,etal.Presenilin-1 knockin mice reveal loss-of-function mechanism for familial Alzheimer’s disease[J].Neuron,2015,85(5):967-981.
[22] SOKOLOWSKI M B.Social interactions in “simple” model systems[J].Neuron,2010,65(6):780-794.
[23] SELKOE D J.The therapeutics of Alzheimer’s disease:where we stand and where we are heading[J].Ann Neurol,2013,74(3):328-336.
(责任编辑:洪江星)
Aβ42 differently regulates aggression and courtship behaviors inDrosophila
SONG Qian,PING Yong
(Bio-X Institutes,Key Laboratory for the Genetics of Developmental and Neuropsychiatric Disorders (Ministry of Education),Shanghai Jiao Tong University,Minhang,Shanghai 200240,China)
The accumulation of β-amyloid(Aβ)oligomers in the brain has strongly been implicated as one of primary events in the progression of AD(Alzheimer’s disease).This study tested possible social interaction changes,including aggression and mating orientation by using a Aβ42 expressingDrosophilaAD model.Firstly,the results confirmed that there were Aβ42 depositions in Aβ42 fly brains.Moreover,Aβ42 increased aggression behaviors in middle-aged flies,but not in young flies.Aβ42 significantly decreased aggression latency and increased frequency.Lastly,no mating orientation changes were found in Aβ42 flies at different ages.Results demonstrated that Aβ42 expression increased aggression behaviors in flies,but without changing mating orientation.
Drosophila; β-amyloid; group behavior; aggression behavior; modulation effects
10.7631/issn.1000-2243.2017.02.0296
1000-2243(2017)02-0296-05
2015-12-22
平勇(1985- ),副教授,主要从事神经生物学方面的研究,yoping@sjtu.edu.cn
国家自然科学基金资助项目(81371482);上海教委科研创新重点资助项目(14ZZ028);上海交通大学医工交叉资助项目(YG2014MS71)
Q42
A

