FKN在apoE-/-小鼠颈动脉粥样硬化不同病理分期中的表达及意义
许增祥,孙健豪,王小雨,侯 爽,周 军,胡浩然
(皖南医学院 1.病理解剖学教研室;2.临床医学院,安徽 芜湖 241002)
·基础医学·
FKN在apoE-/-小鼠颈动脉粥样硬化不同病理分期中的表达及意义
许增祥1,孙健豪2,王小雨2,侯 爽2,周 军2,胡浩然1
(皖南医学院 1.病理解剖学教研室;2.临床医学院,安徽 芜湖 241002)
目的:探讨不规则趋化因子(FKN)在apoE-/-小鼠颈总动脉粥样硬化不同病理分期中的表达及其意义。方法:高脂喂养apoE-/-小鼠12周,建立动物模型,与普食喂养的apoE-/-小鼠做对照。模型成熟后,取其颈总动脉进行常规病理切片观察,按病变严重程度分为正常对照组、脂纹组、纤维斑块组和粥样斑块组。应用免疫组织化学方法检测FKN在不同病理分期斑块内的表达情况。结果:与对照组(2.70±0.67)比较,脂纹组、纤维斑块组和粥样斑块组中FKN表达均上升(分别为5.70±2.00、8.40±2.22、11.00±1.63,P<0.05);三个实验组组间比较差异均具有统计学意义 (P<0.05)。结论:FKN在动脉粥样硬化病变不同病理分期的表达均升高,且其表达与病变严重程度呈正相关,提示FKN在动脉粥样硬化整个发病过程中都发挥重要作用,具有重要的临床指导意义。
不规则趋化因子;动脉粥样硬化;病理变化;分期
【DOI】10.3969/j.issn.1002-0217.2017.02.003
动脉粥样硬化(atherosclerosis,AS)病因和发病机制复杂,主要特征是血脂异常和血管壁成分改变。有研究表明,不规则趋化因子(Fractalkine,FKN)及其受体CX3CR1过度表达于病变血管的内皮细胞和单核细胞,认为冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CAD)的遗传性危险因素之一是CX3CR1的多态性[1];因此,FKN及其受体CX3CR1在AS形成中的作用受到日益关注。此研究以高脂喂养apoE-/-小鼠为动物模型,观察FKN在apoE-/-小鼠颈总动脉粥样硬化斑块不同病理时期的表达,分析FKN与AS严重程度之间的关系,进而研究FKN在AS发病过程中的可能作用。
1 材料和方法
1.1 材料 SABC(兔IgG)免疫组织化学试剂盒、多克隆兔抗小鼠 FKN 抗体购自武汉博士德生物工程有限公司;12只6~8周龄雄性apoE-/-小鼠购自北京大学医学部实验动物中心。
1.2 动物模型制备 按照前期课题组方法制备动物模型[2],采用完全随机法将apoE-/-小鼠分为实验组和对照组,实验组喂以高脂饲料 (含5%的猪油、1%胆固醇);对照组喂以普通饲料,喂养12周。每只小鼠每日给予5 g饲料,并自由饮水(pH值2.8~3.0消毒水)。
1.3 动脉粥样硬化血管HE染色 在apoE-/-小鼠的左侧相同部位的颈总动脉选择约1 cm长的血管,常规4%福尔马林液固定、石蜡包埋后,连续切厚度为5 μm,待发现斑块之后连续切片约100张,中间每隔10张,选取1张进行HE染色。
1.4 动脉粥样硬化斑块病变分析及实验分组 根据AS基础理论和HE染色结果,斑块可分为脂纹、纤维斑块和粥样斑块。脂纹主要病变特点是泡沫细胞的局部聚集;纤维斑块可见明显的纤维帽和脂质池结构;而粥样斑块除了可见纤维帽和脂质池结构外,还会压迫动脉中膜、形成肉芽组织,并且可能含有胆固醇结晶、钙盐沉积等继发病变。另外实验以正常动脉壁为对照组。
1.5 免疫组织化学染色 选取正常对照组、脂纹组、纤维斑块组和粥样斑块组切片各10张,采用SP法检测斑块处FKN阳性细胞的表达,稀释FKN抗体浓度(1∶150),根据免疫组织化学试剂盒的说明,然后在显微镜下用二氨基联苯胺(DAB)控制颜色,最后苏木素染色。阳性结果呈现形式是:细胞质或细胞膜出现明显的阳性信号,即黄色至棕黄色颗粒染色。将染色强度和阳性细胞的数目相结合进行分级(方法见表1)。两人双盲法观察切片是先在低倍镜下选择染色最强的部位,然后在高倍镜下观察。每张切片都会随机选择10个高倍镜视野。若两个人观察结果相差3分则重新评定。所得数据取其平均值。
表1 阳性结果分级

计分按着色程度计分按阳性细胞比例计分0分细胞着色与背景相似视野中阳性细胞数<5%1分着色浅、略高于背景视野中阳性细胞数5%~2分中度着色、明显高于背景视野中阳性细胞数25%~3分强染、着色很深者视野中阳性细胞数50%~4分视野中阳性细胞数≥75%
2 结果
2.1 apoE-/-小鼠颈总动脉病理形态学观察 对照组小鼠血管形态如下:内膜光滑,中膜平滑肌细胞排列整齐,血管壁壁厚均匀,有较好的连续性(图1a);实验组经HE染色后,镜下可见血管内膜增厚,病变部位有斑块向管腔内突起:脂纹组病变主要由泡沫细胞构成(图1b),还可见少量其他细胞,可能是巨噬细胞、平滑肌细胞或淋巴细胞;纤维斑块组病变可累及整个管腔,可见明显纤维帽、脂质池形成(图 1c);粥样斑块组病变除了具有纤维帽和脂质池结构外,斑块压迫动脉中膜,致使中膜变薄,部分可见肉芽组织形成,甚至可见斑块阻塞管腔(图1d)。
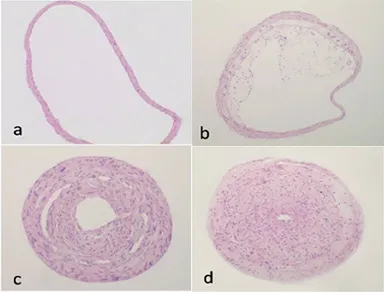
a.对照组;b.脂纹组;c.纤维斑块组;d.粥样斑块组。
图1 apoE-/-小鼠颈总动脉粥样硬化不同分期病变(HE ×100)
2.2 apoE-/-小鼠斑块处FKN表达 随机选择10个不同的高倍视野,结合双盲法对细胞染色强度和阳性细胞的数目评分,且对两种评分数值进行乘积比较。结果显示,对照组、脂纹组、纤维斑块组和粥样斑块组FKN表达分别为2.70±0.67、5.70±2.00、8.40±2.22、11.00±1.63;各个组间FKN的表达存在差异,数据具有统计学意义(n=10,F=42.133,P=0.000),见图2。
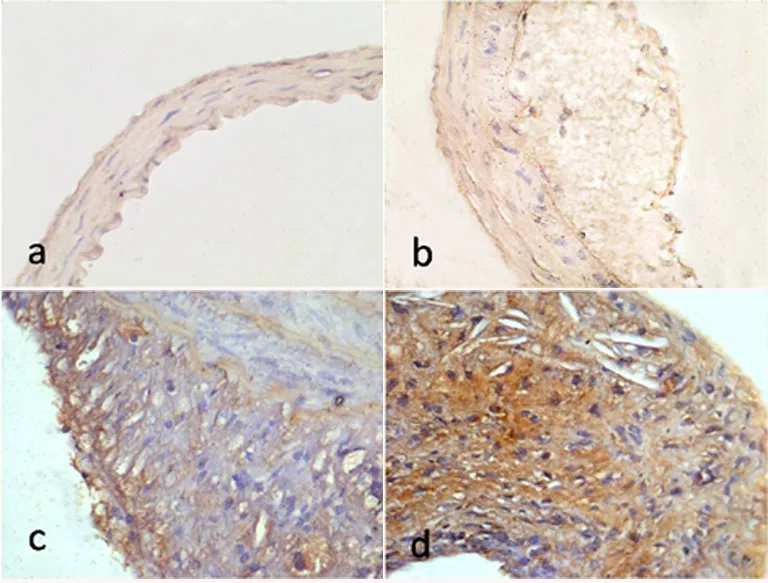
a.对照组;b.脂纹组;c.纤维斑块组;d.粥样斑块组。
图2 apoE-/-小鼠颈总动脉粥样硬化斑块FKN的表达 (免疫组织化学SP法×400)
3 讨论
趋化因子在AS 形成过程中起到至关重要的作用,其中循环血液中白细胞内皮下入侵通过趋化因子的调节来完成,所以在斑块炎症反应中趋化因子的作用日益受到人们的重视[3-4]。作为趋化因子CX3C亚科的唯一成员,不规则趋化因子存在膜型和可溶型,主要分布于血管内皮细胞、平滑肌细胞、树突状细胞和巨噬细胞等。在健康个体的血管壁上难以检测到FKN的存在[5],而在动脉粥样硬化严重病变的血管壁上发现FKN呈高表达状态[6]。本实验采用免疫组织化学染色方法,发现FKN在颈总动脉粥样硬化脂纹期和进展期病变均有不同程度的表达,说明趋化因子FKN从AS早期病变开始就已参与其中。
FKN与其受体CX3CR1结合后,进一步刺激Gi蛋白偶联的信号传导,从而增强自然杀伤细胞的杀伤力,导致血管内皮细胞损伤[7]。并且产生定向迁移信号,趋化表达其配体的淋巴细胞、单核巨噬细胞等与内皮细胞发生黏附、游走,病灶处移动,最终促进AS的形成和发展。已报道,FKN受体CX3CR1的基因多态性T280M及V249I也影响AS发生、发展[8]。此外,孙健等研究显示,FKN可以通过活化单个核细胞内ERK、NF-κB等信号分子,进而诱导TNF-α等Th1型炎症因子的表达而促进AS的形成和发展[9-10]。而且越来越多的研究证明FKN参与了AS病变的过程,如冠状动脉心脏疾病患者和健康人相比可发现CX3CR1阳性细胞更高的出现率[11];FKN及其受体有助于血小板-单核细胞聚集体形成进而加速斑块的形成[12]。尽管Stolla等[13]对FKN在AS早期病变和进展期病变的表达进行分析,发现FKN与斑块严重程度正相关;但并没有进一步描述FKN表达与AS不同病理时期的关系。本实验分析不同病理时期的AS斑块,比较FKN表达差异,证明了FKN表达贯穿于AS的整个发生发展过程,并且与AS的严重程度呈正相关。
通过研究在apoE-/-小鼠颈总动脉粥样硬化不同病理变化时期中FKN的表达,进一步明确不同病变时期的斑块内FKN的表达是不同的,也可以说其炎症反应是不同的。我们知道AS斑块脆性增加可加剧一些临床事件的发生,而斑块的脆性增加与炎症反应的强弱有相当重要的关系。因此,针对AS不同病理时期的斑块采取针对性临床处理,是否可降低AS相关临床事件的发生,尚需要更多的临床研究证实。
[1] 孙健.FKN/CX3CR1与动脉粥样硬化的相关性及其信号转导机制的研究和卡托普利的干预作用[D].吉林:吉林大学,2007.
[2] XU ZENGXIANG,LU LINMING,ZHANG YUNGUI,etal.Expressions of Fractalkine and CD11c on Common Carotid Artery Atherosclerotic Plaques from apoE-/-Mice [J].Acta Academiae Medicinae Sinicae,2013,35(5):519-23.
[3] BURSILL CA,CHANNON KM,GREAVES DR.The role of chemokines in atherosclerosis:recent evidence from experimental models and population genetics [J].Curr Opin Lipidol,2004,15 (2):145-149.
[4] ZHONG L,CHEN WQ,JI XP,etal.Dominant-negative mutation of monocyte chemoattractant protein-1 prevents vulnerable plaques from rupture in rabbits independent of serum lipid levels [J].J Cell Mol Med,2008,12(6A):2362-2371.
[5] KIM KW,VALLON-EBERHARD A,ZIGMOND E,etal.In vivo structure/function and expression analysis of the CX3C chemokine fractalkine[J].Blood,2011,118(22):156-167.
[6] GREAVES DR,HAKKINEN T,LUCAS AD,etal.Linked chromosome 16q13 chemokines,macrophage derived chemokine,fractalkine,and thymus-and activation-regulated chemokine,are expressed in human atherosclerotic lesions [J].Arterioscler Thromb Vasc Biol,2001,21(6):923-929.
[7] GUO X,PAN Y,XIAO C,etal.Fractalkine stimulates cell growth and increases its expression via NF-κB pathway in RA-FLS [J].Int J Rheum Dis,2012,15(3):322-329.
[8] WU J,YIN RX,LIN QZ.Two polymorphisms in the Fractalkine receptor CX3CR1 gene influence the development of atherosclerosis:a meta-analysis [J].Dis Markers,2014,2014:ID 913678.
[9] 郑柳颖,孙健,雷明明,等.趋化因子FKN对外周血单个核细胞 NF-κB 和 TNF-α 表达的影响及蛋白激酶 C在其中的作用[J].大连医科大学学报,2008,30(4):310-313.
[10] 雷明明,孙健,张学颖,等. FKN 对外周血单个核细胞ERK1/2 活化和TNF-α 表达的影响及ERK1/2的临床作用[J].中国老年学杂志,2011,31(12):2264-2266.
[11] APOSTOLAKIS S,KRAMBOVITIS E,VLATA Z,etal. CX3CR1 receptor is up-regulated in monocytes of coronary artery disease patients:impact of pre-inflammatory stimuli and renin-angiotensin system modulators [J].Thromb Res,2007,121(3):387-395.
[12] FLIERL U,BAUERSACHS J,SCHAFER A.Modulation of platelet and monocyte function by the chemokine fractalkine (CX3CL1) in cardiovascular disease [J].European Journal of Clinical Investigation,2015,45(6):624-633.
[13] STOLLA M,PELISEK J,VON BRUHL ML,etal.Fractalkine is expressed in early and advanced atherosclerotic lesions and supports monocyte recruitment via CX3CR1[J].Plos One,2012,7(8):e43572-e43572.
Fractalkine expressed in ApoE-/-mice with common carotid atherosclerosis in diversepathological stages and the expression implications
XU Zengxiang,SUN Jianhao,WANG Xiaoyu,HOU Shuang,ZHOU Jun,HU Haoran
Department of Pathology,Wannan Medical College,Wuhu 241002,China
Objective:To investigate the expression level and implications of chemokine Fractalkine in apoE-/-mice with common carotid atherosclerosis in diverse pathology staging.Methods:ApoE-/-mice were fed on a high-fat diet or normal diet for 12 weeks to prepare the animal models of common carotid atherosclerosis.After successful modeling,common carotid arteries were taken and sectioned for observing the atherosclerotic plaques via HE staining.Then the plaques were divided into control group,fatty streak group,fibrous plaque group and atheromatous plaque group by the severity of plaque formation.Immunohistochemical technique was used to detect the Fractalkine expression in plaques in dissimilar pathology staging.Results:Compared to the control group(2.70±0.67),Fractalkine expression was up-regulated in fatty streak group(5.70±2.00),fibrous plaque group(8.40±2.22) and atheromatous plaque group(11.00±1.63),P<0.05,and the difference was significant among the three observational groups(P<0.05).Conclusion:Fractalkine expression was up-regulated in atherosclerotic lesions in different pathological stages,and the expression level is positively correlated with the severity of plaque formation.The findings suggest that Fractalkine may play a pivotal role in the pathogenesis of atherosclerosis,and has clinical implications for therapeutic target in patients with atherosclerotic vascular lesions.
Fractalkine;atherosclerosis;pathology;stage
1002-0217(2017)02-0111-03
皖南医学院大学生创新训练计划项目(201510368058);皖南医学院重点科研项目培育基金(WK2016Z08)
2016-10-26
许增祥(1980-),男,讲师,硕士,(电话) 0553-3932474,(电子信箱) xuzx1980@126.com。
R 543.5;R 361.1
A

