蛇毒血小板抑制因子急性毒性作用的研究
贾金礼,桑金凤,李 曙,张根葆,2
(皖南医学院 1.病理生理学教研室;2.蛇毒研究所,安徽 芜湖 241002)
·基础医学·
蛇毒血小板抑制因子急性毒性作用的研究
贾金礼1,桑金凤1,李 曙1,张根葆1,2
(皖南医学院 1.病理生理学教研室;2.蛇毒研究所,安徽 芜湖 241002)
目的:探讨蛇毒血小板抑制因子(AHV-PI)对小鼠的急性毒理反应,研究AHV-PI作为一种新的抗凝药物使用可能存在的毒性反应。方法:采用小鼠半数致死量法,对空白对照组和AHV-PI组未死亡的小鼠连续观察1周,全部处死眼球取血检测血液流变学变化。结果:小鼠中毒反应表现随剂量加大而加重,可见肌肉僵硬、运动失衡等。小鼠腹腔注射AHV-PI的LD50及其95%可信限为13.44(12.72~14.16)mg/kg;两肺肉眼可见血液渗出。存活的实验动物在1周观察期后处死,检测不同剂量组均能使全血高、中、低切黏度及血浆黏度降低。结论:血小板抑制因子可以降低血液黏稠度,引起凝血功能障碍,全身各脏器出血倾向加剧,尤其以肺组织出血最为严重,是小鼠死亡最可能的因素。
血小板抑制因子;急性毒性;半数致死量;血浆黏度
【DOI】10.3969/j.issn.1002-0217.2017.02.002
皖南蝮蛇粗毒是含有多种蛋白质的混合物质,经过一定方法分离纯化以后可以得到一种抑制血小板聚集的组分[1]。皖南蝮蛇毒粗毒通过阴阳离子交换柱和凝胶G50分子筛后得到一种具有抑制血小板聚集活性的物质组分命名为血小板抑制因子(venom blood platelet inhibitory factor,AHV-PI)[2],在对该物质进行生物活性方面的初步探讨之后初步了解到AHV-PI具有十分显著的抑制血小板聚集从而降低凝血的活性。当前血小板抑制因子相关药效活性研究已经大量进行,有研究显示该物质对家兔颈动脉血栓模型抗凝治疗效果显著[3]。本实验通过对皖南蝮蛇毒中血小板抑制因子注射到小鼠体内诱发小鼠的急性中毒反应进行相关观察,初步了解其毒性剂量和有效剂量之间的差别,为后续研究开发纯度更高、药效更为显著的与蛇毒相关的对抗血栓性疾病的相关物质提供依据。
1 材料与方法
1.1 药品及器械 皖南蝮蛇毒血小板抑制因子(AHV-PI)是本实验室纯化制备的蛇毒冻干粉。HE切片染色器械一套,全自动血液流变动态分析仪(型号MEN-C100,山东美医林仪器厂),全自动脱水机等。
1.2 动物 正常清洁小白鼠,体质量19~24 g;雌雄数目相同,皖南医学院动物房购买运送,动物饲养生活环境温度控制在23℃左右,足量饮食,饱水。
1.3 毒性实验
1.3.1 预实验 购买动物后人工饲养小鼠1周适应新环境,随后随机取3组小鼠共24只,雌雄数目相同,用去离子水配置浓度相差3倍的AHV-PI溶液备用,为保持腹膜接触吸收面积一致,分别按体质量抽取相应溶液,并以去离子水补充至0.5 mL等体积腹腔注射。持续不间断观察1周,上限为该组动物全部死亡,下限为该组动物全部存活,解剖死亡小鼠,结束预实验。结果:皖南蝮蛇毒AHV-PI小鼠腹腔注射给药,最大致死量(LD100)为18.0 mg/kg,最小致死量(LD0)为9.0 mg/kg,组间距r=0.84,n=5。
1.3.2 正式实验
1.3.2.1 小鼠分组设计 健康小白鼠120只,雌雄各半,分别把雌雄性小鼠随机等数目分成6个小组,每组20只。所有小鼠实验前断粮1 d,不限制饮水,即去离子水空白对照组和AHV-PI组,将分组完成的小鼠通过腹腔注射,所有组别小鼠注射总体积为0.5 mL/只,空白对照组相同注射处理。
1.3.2.2 观察指标 确定LD50及其可信限;对于存活下来的小鼠继续观察1星期。给药1 d内持续观察;以后每天上、下午准时查看小鼠存活状况,了解并登记小鼠饮食、进水等一般情况、中毒后的症状表现以及有无死亡情况。死亡动物立即解剖,取动物的内脏,生理盐水清洗后肉眼观察肺和肝等主要脏器有无病变发生,并对取下的各个脏器组织进行HE染色,切片厚度为5 μm/片,在显微镜下观察并拍照。观察1周后将剩余存活小鼠,用毛细管从小鼠眼球每只采血2.0 mL检测血液流变学变化。
1.4 统计学方法 计算小鼠急性毒性皖南蝮蛇毒中AHV-PI的LD50及其可信限[4]。两组均数的比较采用SPSS 18.0 统计软件进行单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各实验组小鼠行为学观察 各组小鼠出现不同程度的中毒反应:口鼻出血、偶有红色泡沫溢出,呼吸急促伴发呼吸困难、毛发蓬松、站立不稳、不思饮食、嗜睡、心率上升、蜷缩。高浓度蛇毒组(18.0 mg/kg)约10 min即可观察到中毒症状出现。中浓度蛇毒组(12.7 mg/kg)约1 h观察到中毒表现,低浓度蛇毒组(9.0 mg/kg)约2 h观察到中毒表现。对照组未见异常表现。
2.2 急性毒性实验量效关系结果及LD50的计算 结果详见表1。
表1 蛇毒AHV-PI腹腔注射对小鼠的急性毒性情况
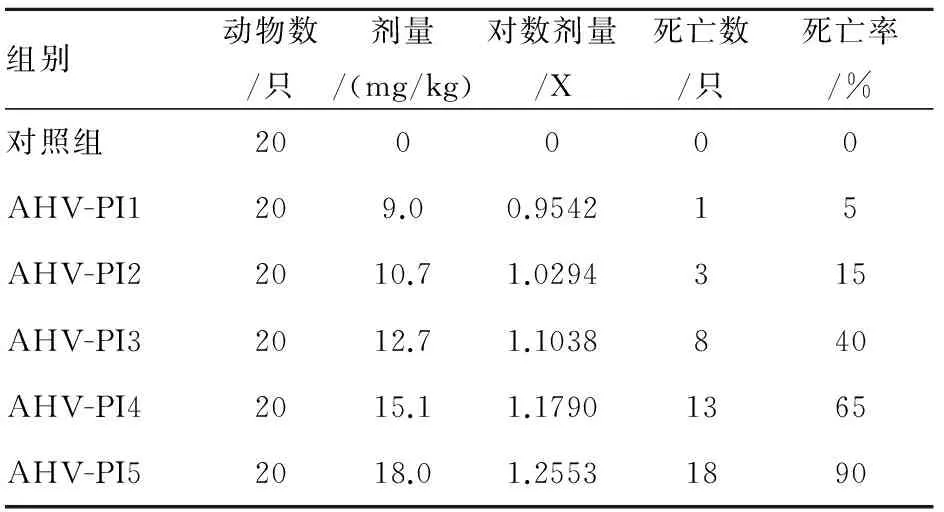
组别动物数/只剂量/(mg/kg)对数剂量/X死亡数/只死亡率/%对照组200000AHV-PI1209.00.954215AHV-PI22010.71.0294315AHV-PI32012.71.1038840AHV-PI42015.11.17901365AHV-PI52018.01.25531890
回归方程y=2.9268X-2.8022,半数致死量LD50=13.44 mg/kg,LD50 95%的可信限=12.72~14.16 mg/kg,LD5=9.43 mg/kg,LD95=19.14 mg/kg。
2.3 各脏器病理切片观察 对于1周内死亡和处死的小鼠,快速取下各个主要脏器并作大体观察和病理切片检查,标本眼观可见两肺有斑片状出血点出血斑,观察肺部出血情况可知出血量的大小和浓度剂量呈正相关关系。镜检(图1)为病理切片,厚度为5 μm。生理盐水对照组肺组织正常未见出血等异常表现(图1A),轻度出血主要出血部位为肺间质等肺实质部位(图1B),重度可累及实质和肺泡甚至整个肺脏(图1C),其他脏器胰腺(图1D)、心脏(图1E)、肝脏(图1F)、肾脏(图1G)与对照组相比未见明显异常。动物死亡主要原因可能和肺部出血有一定相关性。
2.4 血液流变学检验结果 结果显示,AHV-PI能使全血高、中、低切黏度以及血浆黏度下降,且剂量变化有一定差异性(P<0.05)。因此AHV-PI可通过抑制血小板的聚集作用起到抗凝血作用,降低机体血浆黏度,使血液微循环得到相应的改善,从而对血栓性疾病产生重要的治疗作用。详见表2及图2。
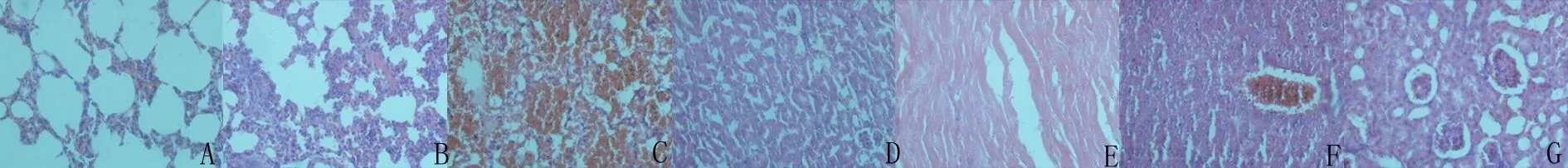
A.正常肺组织;B.轻剂量中度肺间质出血;C.高剂量重度弥漫性肺出血;D.胰腺组织未见出血等异常表现;E.心肌组织未见出血等异常表现;F.肝脏组织未见出血等异常表现;G.肾脏组织未见出血等异常表现。
图1 AHV-PI腹腔注射小鼠脏器病理图(HE,×40)

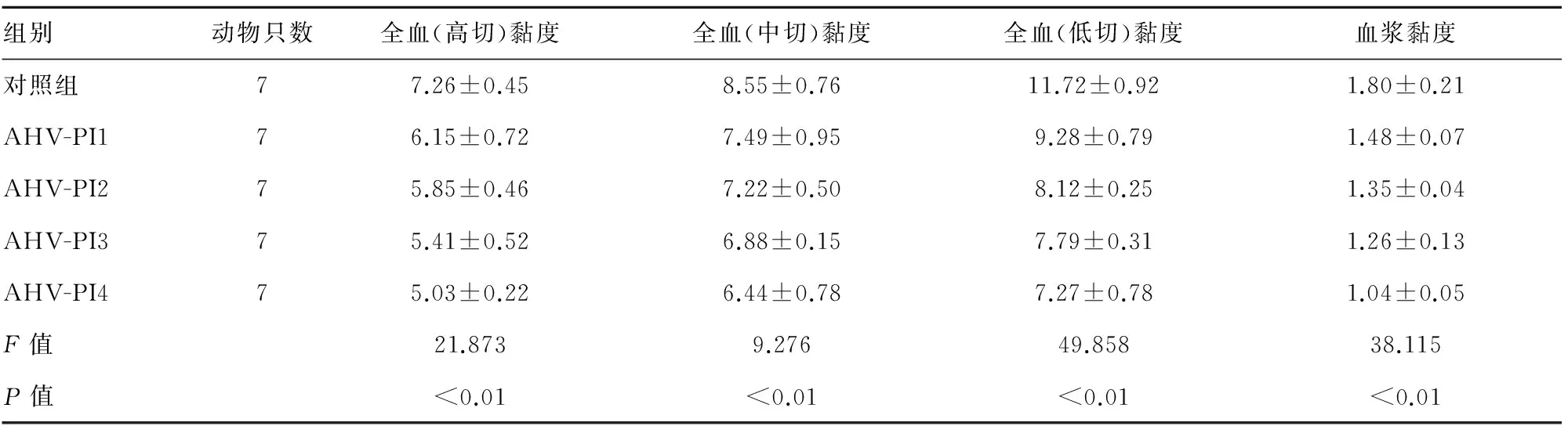
组别动物只数全血(高切)黏度全血(中切)黏度全血(低切)黏度血浆黏度对照组77.26±0.458.55±0.7611.72±0.921.80±0.21AHV-PI176.15±0.727.49±0.959.28±0.791.48±0.07AHV-PI275.85±0.467.22±0.508.12±0.251.35±0.04AHV-PI375.41±0.526.88±0.157.79±0.311.26±0.13AHV-PI475.03±0.226.44±0.787.27±0.781.04±0.05F值21.8739.27649.85838.115P值<0.01<0.01<0.01<0.01
AHV-PI各剂量组与对照组相比较P<0.01。AHV-PI5组存活2只,未进行统计计算。

Ⅰ:生理盐水组;Ⅱ:AHV-PI1剂量组;Ⅲ:AHV-PI2剂量组;Ⅳ:AHV-PI3剂量组;Ⅴ:AHV-PI4剂量组。
图2 AHV-PI对小鼠血液流变学的影响
3 讨论
AHV-PI具有纤溶酶原激活活性,破坏了纤维蛋白原与血小板结合的部位,达到阻止血小板聚集反应的作用[2]。本实验通过研究皖南蝮蛇毒中血小板抑制因子对小鼠的急性毒性反应情况,可见小鼠的中毒反应为神情呆滞,口鼻偶有红色泡沫溢出,呼吸急促,毛发松散脱落,站立不稳,少动,不思饮食,嗜睡,心率上升、蜷缩等现象;小鼠腹腔注射AHV-PI的LD50及其95%可信限为13.44(12.72~14.16)mg/kg。小鼠的毒性反应症状表现与剂量大小成正相关性。
解剖可见两肺表面有血液渗出情况,HE染色示出血可累及全肺。提示中毒剂量的AHV-PI的靶器官主要为肺脏,肺组织严重弥漫性出血导致呼吸功能受到损害是小鼠死亡主要原因。其他脏器未见明显异常表现,说明其毒性较小。AHV-PI从腹腔注入后,腹膜吸收入血后通过血循环可能首先进入肺部,肺泡间毛细血管网林立丰富,而且肺组织结构较松散。首先在肺泡间质出血,然后伴随AHV-PI浓度的逐渐上升出血由间质累积到两侧全肺从而引起动物急性呼吸功能严重损害,机体缺氧而死亡。本研究同时为蛇毒中毒急性期死亡提供了器官水平上的依据,对蛇毒中毒患者急性期病理改变和死因的认识也有一定帮助。
有实验研究显示[1]AHV-PI能够通过降低兔血浆中vWF含量的方法,在一定程度上改善血液的高凝状态。有研究显示血小板粘附性和血浆黏稠度在一定范围内具有正相关特性[5]。机体中各种原因导致的血小板聚集反应过度会相应地减少微循环的灌注血量从而导致血黏度增加[6]。这表明超过一定剂量(小鼠腹腔注射≥9.0 mg/kg)的AHV-PI在肺组织毛细血管内可能抑制血小板聚集降低血液黏稠度从而引发肺部出血性疾病。目前临床上应用抗血小板药物治疗血栓性疾病已得到十分广泛的应用,但是依然存在很多如阿司匹林抵抗、氯吡格雷抵抗和出血倾向等[7-9]不良反应。有研究显示AHV-PI可显著抑制血小板聚集率[10]降低血液黏稠度导致出血。对比之前药物活性研究可得AHV-PI通过腹腔给药引起小鼠急性中毒浓度剂量远远高于其有效剂量,由此可知在药效学的剂量下AHV-PI对机体不会出现中毒反应,为临床用药安全提供了保障。其对动物机体的长期蓄积性毒性剂量及反应是下一步研究的方向。
[1] HUANG CH,WU JL,KONG Y,etal.Novel anti-platelet aggregation protein from agkistrodon acutus:isolation and characterization[J].Chin J Natmed,2006,4(4):312-316.
[2] 黄璐,张根葆,闵志雪,等.蝮蛇毒血小板抑制因子对动脉血栓形成的影响及机制研究[J].中国临床药理学与治疗学,2012,17(12):1355-1360.
[3] 季娜,张根葆,黄璐,等.蝮蛇毒血小板抑制因子对家兔动脉血栓形成的影响[J].中国临床药理学与治疗学,2014,19(9):987-990.
[4] 袁伯俊,廖明阳,李波.药物毒理学实验方法与技术[M].北京:化学工业出版社,2007:200-210.
[5] 尹奇焕.血液流变学检测的影响因素、结果解释及临床意义[J].亚太传统医药,2011,11(7):78-79.
[6] 侯振江.加强血液分析仪质量控制浅析[J].中国医药导刊,2011,13(8):1461-1462.
[7] MEHTA SR,YUSUF S,PETERS RJ,etal.Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy In patients undergoing precutaneous coronary intervention:the pci-cure study[J].Lancet,2001,358(9281):527-533.
[8] RAYMOND C,MENON V.Dual antiplatelet therapy in coronary artery disease:a case-based approach[J].Cleve Clin J Med,2009,76(11):663-667.
[9] KUZNIATSOVA N,SHANTSILA E,BLANN A,etal. A contemporary viewpoint on aspirin resistance[J].Ann Med,2012,44(8):773-783.
[10] 吴娟,张根葆,张娅,等.蝮蛇毒血小板抑制因子对急性心肌梗死大鼠血液流变影响及机制的研究[J].中国临床药理学与治疗学,2016,21(3):259-263.
Acute toxicity of the blood platelet inhibitory factor from snake venom in mice
JIA Jinli,SANG Jinfeng,LI Shu,ZHANG Genbao
Department of Pathophysiology,Wannan Medical College,Wuhu 241002,China
Objective:To observe the acute toxicological reaction of venom blood platelet inhibitory factor (AHV-PI) in mice in order to minimize the potential toxicity of AHV-PI as a new anticoagulant.Methods:Experimental mice were divided into blank controls and treatment group with AHP-PI as LD50 determination,and the survivals were observed for consecutive 1 week.Then all mice were sacrificed,and blood was taken via the eyeball for measuring the rheology.Results:Toxicological reaction in mice was represented by aggravated sign with additional dose,marked muscle stiffness and imbalanced movement.LD50 for AHV-PI in mice via intraperitoneal injection was 13.44 mg/kg,and the 95% confidence limit was 12.72-14.16 mg/kg.Blood effusion was visibly seen in the two lungs.Observation of the survival animals after being sacrificed following one week indicated that diverse dose of AHV-PI had led to decreased shear viscosity of high,medium and low in whole blood as well as plasma viscosity.Conclusion:AHV-PI can down-regulate the blood viscosity in mice,resulting in coagulation disorders and intensive hemorrhage in body organs,especially severe bleeding in the lung tissues that is responsible for the death of experimental mice.
platelet inhibitory factor;acute toxicity;LD50;blood viscosity
1002-0217(2017)02-0107-04
安徽省教育厅自然科学研究基金重点项目(KJ2011A266)
2016-10-25
贾金礼(1989-),男,2014级硕士研究生,(电话)18895338797,(电子信箱) 1224701368@qq.com; 张根葆,男,教授,硕士生导师,(电子信箱)zgb858@163.com,通信作者。
R 996.3
A

