PBDEs好氧微生物降解动力学过程及热力学机制研究①
程吟文,谷成刚,刘总堂,朱梦荣,刘 畅,叶 茂,卞永荣,杨兴伦,蒋 新
(1 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
PBDEs好氧微生物降解动力学过程及热力学机制研究①
程吟文1,2,谷成刚1*,刘总堂1,2,朱梦荣1,2,刘 畅1,2,叶 茂1,卞永荣1,杨兴伦1,蒋 新1
(1 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
多溴联苯醚 (PBDEs)是一种曾在全球范围内被广泛使用的溴代阻燃剂,具有半挥发性、生物蓄积性、神经毒性和内分泌干扰效应等,严重威胁生态环境和人体健康安全。本研究选择典型好氧降解菌伯克氏菌属LB400,对环境中普遍检出的中低溴联苯醚开展了降解动力学过程研究,探讨了外加碳源作为共代谢底物对降解性能的影响,模拟计算了降解中关键反应路径热力学状态函数性质变化,以揭示其与表观降解速率常数k之间的相关关系。结果表明:联苯作为共代谢底物时PBDEs的去除效率最高,在降解菌的作用下,0 ~ 120 h内中低溴代PBDEs均能够发生降解,降解过程符合一级反应动力学。羟基化反应可能是PBDEs微生物降解过程的速控步骤,相比于间/对位取代,活性氧自由基如·OH更倾向于攻击苯环碳原子的邻/间位置,这为揭示PBDEs好氧微生物降解的分子作用机制,促进土壤中高效好氧降解菌的选育与污染修复应用提供了科学依据。
多溴联苯醚;共代谢;降解动力学;羟基化;热力学机制
多溴联苯醚(PBDEs) 作为一种典型的添加型溴代阻燃剂,由于其热稳定性好、价格低廉等优点,曾被大量应用于各种电子电器、建材纺织和石油化工等工业领域中[1–2]。然而,随着溴代阻燃剂使用量的不断上升,目前全球范围内包括土壤、水、大气、沉积物与底泥,以及不同生物组织等多种环境介质中均有PBDEs的检出[3–8]。PBDEs化学性质稳定,具有半挥发性和生物蓄积性,可通过食物链传递作用进入人体并产生生物累积与生物放大效应[9–10]。据大量文献报道,PBDEs作为一种典型的内分泌干扰物[11],可干扰生物体雌激素和甲状腺激素代谢水平[9–10],且具有神经毒性[12–16]、生殖毒性和胚胎毒性等[17–19],严重威胁人体健康安全。由于商用五溴联苯醚和八溴联苯醚在2009年《斯德哥尔摩公约》中被新增列入“持久性有机污染物(POPs)”受控名单,PBDEs污染所带来的环境问题备受关注。
微生物降解是环境中有机污染物自然消减的主要方法,也是PBDEs污染消除的重要途径之一,包括好氧、厌氧与混合功能微生物降解技术[20–25]。其中,好氧微生物降解周期短、成本低、能够彻底开环并矿化完全,已成为微生物降解研究领域的新热点。研究表明,好氧微生物如鞘氨醇单胞菌Sphingomonas sp. PH-07[26]、铜绿假单胞菌Pseudomonas aeruginosa[27]、红球菌Rhodococcusjostii RHA1和伯克氏菌Brkholderia xenovorans LB400[28]均可在联苯醚等不同碳源存在的情况下,发生共代谢降解PBDEs,其降解性能除受底物水溶性、温度、pH和外加碳源种类的影响外[29],更取决于PBDEs中溴原子取代位置和数量:随着溴取代基数目的增加,PBDEs降解性能下降,且降解开环反应更容易发生在没有溴原子取代的苯环上[28]。与结构相似的多氯联苯(PCBs)类似,PBDEs好氧微生物降解过程亦可能受联苯代谢基因(bph途径)及其编码酶——联苯双加氧酶(BPDO)的催化调控而优先羟基化,继而脱氢,环裂解和水解矿化为小分子物质[30–31]。然而,由于现已分筛的PBDEs高效降解菌相对匮乏,加之实际降解过程复杂、影响因素繁多而使得降解产物和中间体捕获鉴定分析困难,PBDEs好氧降解机理的认识还处于初始阶段,尤其羟基化反应的发生机制与意义也不清晰。因此,本研究选择对中低溴代联苯醚具有一定降解能力的伯克氏菌Brkholderia xenovorans LB400,开展典型 PBDEs好氧微生物降解动力学过程和底物影响研究,模拟计算关键反应路径的热力学函数性质变化,探讨微生物表观降解性能与羟基化、脱氢等反应热力学函数变化之间的关系,并阐释相关作用机制,以期从热力学受控性角度反映羟基化反应对于整个好氧降解通道的决定性意义,从而为PBDEs高效好氧降解菌的选育与污染修复应用提供科学依据。
1 材料与方法
1.1 试剂
试验选取6种典型PBDEs,包括2-一溴联苯醚(BDE-1),2,2'-二溴联苯醚(BDE-4),2,4,4'-三溴联苯醚(BDE-28),2,2',4,4'-四溴联苯醚(BDE-47),2,2',3, 4,4'-五溴联苯醚(BDE-85)和 2,2',3,4,4',5'-六溴联苯醚(BDE-138),纯度均为99.5%,购于美国AccuStandard公司;色谱纯正己烷购于德国Merck KgaA公司;试验中使用的无水乙醇、乙酸乙酯、丙酮、无水硫酸钠等试剂,均为分析纯,购于国药集团化学试剂有限公司。
1.2 菌种与培养条件
实验用菌种选择对PCBs具有广谱降解能力的优势菌B. xenovorans LB400[32],购自德国菌种保藏中心(DSMZ no. 17367)。LB400菌株活化和培养采用胰蛋白胨大豆肉汤培养基(TSB)作为碳源,购自青岛希望生物技术有限公司。称取6 g TSB,加水200 ml配制TSB液体培养基,灭菌后取少量加入安瓿瓶内,活化LB400冻干粉末。称取6 g TSB、3 g 琼脂,加入200 ml水于三角烧瓶中,灭菌冷却后于超净工作台中倒平板,制作TSB固体培养基。用平板划线法将菌株接种至 TSB固体培养基,置于30℃恒温培养箱中培养。3 d后,取一环单菌落至TSB液体培养基中进行放大培养(30℃ 恒温水浴,150 r/min)。当微生物生长至对数生长期时,取菌液离心(20 min、3 000 r/min),并用磷酸盐缓冲溶液清洗2遍,接种至无机盐培养基(DSMZ medium no.457)中,加入共代谢底物在恒温水浴中条件下继续培养(30℃,150 r/min)。培养基中其他无机盐化合物均为分析纯,购自南京化学试剂有限公司。所有培养基在使用前均经过 121℃、20 min高温高压灭菌处理。菌液生长的对数期通过紫外可见分光光度计在600 nm波长下测定吸光度值(OD600)获得。
1.3 PBDEs共代谢底物筛选与降解动力学实验
PBDEs好氧微生物降解一般是通过外加碳源共代谢的方式来完成的。分别以10 mmol/L的联苯、乙醇和乙酸乙酯作为外加碳源加入降解体系中,并设置一组不加共代谢底物的空白对照。设置BDE-47在降解体系中的初始浓度为100 μg/L,分别在降解体系建立后的0、3、9、24、48、72 h进行取样,测定溶液体系中 BDE-47随时间变化的降解残留,并计算BDE-47在不同底物存在下的去除效果。
在PBDEs好氧降解动力学实验体系中,以10 mmol/L的联苯作为底物,利用好氧降解菌LB400对BDE-1、BDE-4、BDE-28、BDE-85和BDE-138进行降解动力学研究。实验中选用单标化合物溶于异辛烷中并调节溶液浓度为50 μg/ml,用移液枪移取10 μl于12 ml玻璃样品瓶中,置通风橱中待溶剂挥发。5 min后,接种无机盐培养基中处于对数生长期的菌液(OD600约为0.26 ~ 0.27)5 ml于样品瓶中,无菌透气封口膜封口,降解初始浓度为100 μg/L。设置空白对照组,在污染物中加入5 ml灭菌后的无机盐培养基,使浓度同样为100 μg/L。为了避免偶然误差,所有处理组和对照组均设置3个平行。所有的样品置于恒温水浴中振荡培养(30℃,150 r/min)[28]。由于不同溴代模式PBDEs降解周期不同,对于每种化合物的取样时间点设置也不相同。
1.4 测定方法
降解体系中PBDEs残留的提取采用正己烷(1︰1,v/v)液–液萃取方法。待萃取完全,转移2 ml有机相至离心管中,加入0.5 ml无水硫酸钠,12 000 r/min下离心1 min以去除水分和细菌残留,静置30 min,转移1 ml至GC棕色进样瓶中,等待进样测定。PBDEs定量分析采用Aglilent 7890A-ECD气相色谱仪。选择DB-5毛细管色谱柱(30.0 m ´ 0.32 mm ´ 0.25 μm),进样口和检测器的温度分别设为265℃ 和 300℃,设计升温程序如下:初始温度为140℃,保持2 min;后以 5℃/min的速度升至 180℃,保持 5 min;再以5℃/min的速度升至 260℃,保持 2 min;最后以15℃/min的速度升至315℃,保持 21 min。载气为N2,采用不分流进样,进样量 1 μl。试验中 PBDEs的残留浓度采用外标法测定,获得各单标PBDEs化合物标准曲线,R2均大于0.999。溶液体系中PBDEs的回收率在84% ~ 128%。
1.5 理论计算与数据分析
为揭示PBDEs好氧微生物降解过程的热力学受控性,围绕降解过程中关键反应步骤,假定邻(ortho)/间(meta)位-、间(meta)/对(para)位–双加氧,即羟基亲核加成反应和脱氢反应历经通道分别如图1(a ~ c),采用量子化学半经验分子轨道 AM1计算方法对PBDEs与活性氧自由基HO·以及反应中间体IM1、IM2和 IM1¢等(图 1)进行结构优化和频率分析,并计算热力学状态函数——反应吉布斯自由能变化(ΔrG),即ortho/meta-羟基化和脱氢反应吉布斯自由能变ΔrG1和ΔrG2,以及 meta/para-羟基化反应吉布斯自由能变ΔrG1。其中,ΔrG为产物吉布斯自由能与反应物吉布斯自由能的差值,即ΔrG=Σ(ε0+Gcorr)products–Σ (ε0+Gcorr)reactants(ε0和Gcorr分别为总电子能和吉布斯自由能校正值)。结构优化和频率分析以Gaussian 03软件完成[33]。实验数据差异性比较分析采用t检验或单因子方差分析方法(ANOVA),以SPSS19.0统计分析软件完成。

图1 PBDEs好氧降解中理论假定起始反应通道Fig. 1 Initial reaction routes theoretically hypothesized for PBDEs aerobic biodegradation
2 结果与讨论
2.1 PBDEs好氧微生物降解的底物选择性与降解动力学
前人研究表明,选择合适的外加碳源作为共代谢底物能够显著提高微生物对PBDEs的降解效率[34]。10 mmol/L联苯、乙醇和乙酸乙酯分别作为底物时,BDE-47的加标回收率分别在87.1% ~ 93.7%,如表1所示。方差分析显示,3种底物对BDE-47的回收率不存在显著性差异(P>0.05),表明加入底物不会对PBDEs的提取效率造成显著影响。然而,加入底物能够对 BDE-47的降解效率产生显著影响。在 72 h范围内,较BDE-47为唯一碳源时,加入不同的底物能够提高BDE-47的降解效率(图2),这可能是由于BDE-47的水溶性较低,LB400难以直接利用其作为生长底物而进行自身代谢增殖,相反加入水溶解度较大的乙醇等底物时,可以作为能量碳源而为微生物生长利用,促进BDE-47的降解。不同底物相较而言,联苯最能提高BDE-47的降解效率(53.07%),其次分别为乙醇(37.39%)和乙酸乙酯(25.28%)(表1),这可能是由于联苯作为代谢底物时,其与BDE-47的结构相似性能够激发微生物降解反应中相关酶的活性,从而提高降解效率[34]。

表1 共代谢底物选择对BDE-47降解效率的影响(%)Table 1 Degradation ratios of BDE-47 under different substrates
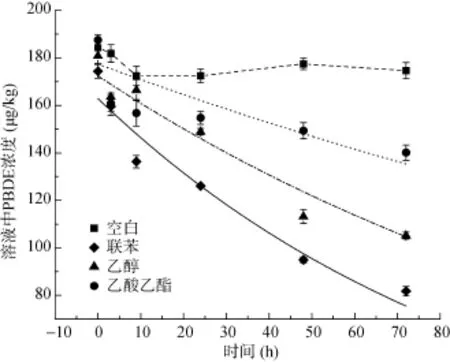
图2 降解周期内BDE-47在不同共代谢底物作用下的降解动力学Fig. 2 Biodegradation kinetics of BDE-47 under different substrates in its degradation period
在未经微生物处理的空白对照组中,对不同时间点下PBDEs残留量进行了测定。根据单因素方差分析,随着时间推移,各空白对照组溶液体系中PBDEs的残留量没有显著性变化(P>0.05,图 3),说明实验周期内PBDEs的化学转化与挥发作用等因素可以忽略不计;相反,在微生物处理下PBDEs的残留变化,可推断其源自微生物的降解作用。LB400处理下,不同PBDEs异构体化合物的残留浓度随时间延长而显著下降(P<0.05),其降解动力学过程如图4所示。图4显示,PBDEs好氧微生物降解过程在120 h范围内均能够达到平衡状态;然而,随着溴代程度的提高,降解平衡时间延长,降解效率下降,如从 BDE1到BDE138,降解效率从100% 降低为48.4%,与前人的研究结果相一致[28]。这可能是由于溴原子取代使PBDEs分子体积增大,与联苯双加氧酶BphA1蛋白接触并发生有效亲合作用的难度增大,从而导致降解效率降低,降解周期相对延长。

图3 微生物空白对照组PBDEs残留变化方差分析P值Fig. 3 p values given by One-way ANOVA of PBDEs concentration in control group
前人研究发现[34],好氧降解菌施氏假单胞菌Pseudomonas stutzeri BFR-01能够有效降解BDE-47,两周内的降解效率达 97.94%,降解过程符合一级反应动力学规律。为此,本研究以一级反应动力学方程ln(C/C0)= –kt+a(式中:t为降解时间,h;C0和 C分别为PBDEs初始与时间t下的浓度,μg/L;k为一级反应动力学常数,h–1;a为常数项)对 LB400降解PBDEs动力学过程进行了拟合。从线性拟合结果来看,一级反应动力学方程能够较好地反映菌株对PBDEs的降解趋势(线性拟合决定系数R2在0.910 ~ 0.991,图4),LB400 对PBDEs的降解过程符合一级反应动力学特征,BDE-1、BDE-4、BDE-28、BDE-47、BDE-85和BDE-138降解速率常数k分别为0.754、0.218、0.028、0.009 7、0.007 5和0.006 2 h–1。与溴代数目的相关性分析可以看出,降解速率与溴代数目呈现显著的负相关关系(R2达 0.998),即随溴代数的增加,呈现一级指数衰减趋势。

图4 PBDEs好氧微生物降解动力学过程及线性拟合Fig. 4 Process of aerobic biodegradation kinetics of PBDEs and their linear fit analyses
2.2 PBDEs好氧微生物降解的热力学受控性
受联苯调控途径 bph基因及其编码酶的酶促作用,PBDEs好氧微生物降解过程中也可能起始发生ortho/meta-位、meta/para-位羟基化和脱氢反应,为此本研究计算了 PBDEs及其不同位置羟基化和脱氢反应中间体的热力学性质和标准摩尔生成吉布斯自由能,并由此得到相应的活化吉布斯自由能变 ΔrG。根据 PBDEs好氧微生物降解反应通道的理论假定,起始反应步骤的吉布斯自由能变计算值见表2。

表2 PBDEs好氧降解过程中羟基化与脱氢反应ΔrG计算值(kJ/mol)Table 2 Calculation of ΔrG of hydroxylation and dehydrogenation of PBDEs in aerobic biodegradation
PBDEs好氧微生物降解是由一系列复杂的基元反应组成的,其表观降解速率常数k是各基元反应降解速率常数的线性或非线性组合。然而,由于调控各基元反应发生的蛋白酶结构不同、功能各异,其对活化能降低和整个降解过程速率的调节与贡献也各不相同。类似于一般化学反应,PBDEs好氧微生物降解具有热力学受控性。根据反应过渡态理论[35],基元反应吉布斯自由能变与其反应速率常数 lnkn之间呈线性关系,即 ,其中,n =1,2,…,是常数。
因此,以基元反应过程的活化吉布斯自由能变来表征其反应速率并探讨与表观速率常数之间的关系,量化其对表观速率常数的贡献,可从热力学角度揭示降解途径中各反应步骤对总反应速率的影响,有助于明晰降解途径的分子作用机制。研究表明,bph上游基因编码酶 BphA调控羟基化的过程是 PBDEs好氧微生物降解的起始反应[36]。当 PBDEs苯环的ortho/meta-位置被羟基自由基进攻时,生成溴代2,3-二羟基联苯醚,其活化吉布斯自由能变ΔrG1与表观速率常数lnk的关系如图5a所示。从图5a中可以看出,二者之间有着较强的线性关系,R2达到了0.981,暗示 ortho/meta-位羟基化反应速率与表观速率密切相关,对 PBDEs好氧微生物降解反应的限制与调控,具有重要意义。这可能是由于BphA,尤其是α亚基BphA1的底物选择范围通常窄于降解途径中的其他酶,从而限制了羟基化反应的进行。PBDEs双加氧的过程还需催化脱氢反应步骤。由表2可知,催化脱氢反应步骤的活化吉布斯自由能变相对较小,意味反应进行所需翻跃的势能垒较低,反应速率较快。催化脱氢活化吉布斯自由能变ΔrG2与表观反应速率常数lnk之间的关系,如图5B所示。由图5B分析可知,催化脱氢活化吉布斯自由能变与 lnk间无显著的负相关关系,说明催化脱氢反应步骤进行较快,对表观速率常数的影响较弱而不属限速步骤;相较而言,ortho/meta-位羟基化反应可能属于限速步骤。

图5 PBDEs好氧微生物降解表观反应速率常数与吉布斯自由能变的相关关系Fig. 5 Correlations between aerobic biodegradation kinetics constants of PBDEs and Gibbs free energy change
若 PBDEs苯环的 meta/para-位置发生羟基自由基的进攻反应,其反应活化吉布斯自由能变 ΔrG1¢与表观速率常数lnk之间没有很好的线性相关关系,R2仅为0.008,如图5C,说明PBDEs好氧微生物降解速率与meta/para-位羟基化反应速率的相关性较差。值得注意的是,当图5C中将BDE-138化合物剔除时,其他5种PBDEs羟基化反应吉布斯自由能变与其lnk间的线性关系大为改善。从结构上可以看出,相比于其他BDE化合物,BDE-138溴代程度更高、立体空间位阻更大,从而使其与BphA1蛋白的活性位点接触难度变大;且 BDE-138的 meta-位有两个位置被Br原子取代,而其他化合物中只有 BDE-85有一个meta-位被取代,·OH很难与苯环碳原子发生亲核加成,导致meta-位羟基化反应很难发生。
因此,从羟基化反应活化吉布斯自由能变与lnk的线性负相关关系来看,ortho/meta-位羟基化反应发生的可能性明显优于meta/para-位取代模式,这在一定程度上与PBDEs好氧微生物降解中2,3-二羟基-4-苯氧基-4,6-己二烯产物的检出很好地吻合[26]。可以推断,PBDEs好氧微生物降解过程中,活性氧自由基如·OH可攻击苯环碳原子而发生亲核加成并优先在ortho/meta-位发生羟基化反应,随后发生催化脱氢反应。其中,羟基化反应为整个降解途径各基元反应的限速步骤。
3 结论
1) 利用LB400好氧降解菌,联苯作为共代谢底物时,PBDEs的降解去除效率最高。LB400作用下,中低溴代PBDEs均能够发生不同程度的降解,降解过程符合一级化学反应动力学,且降解效率随着溴取代基数目的增加而降低。
2) PBDEs好氧微生物降解的热力学受控性分析表明,羟基化反应是PBDEs微生物降解反应的速控步骤,这可能是由于联苯双加氧酶的 α亚基-BphA1的底物选择范围通常窄于降解途径中的其他酶,在一定程度上阻碍了反应的快速进行。
3) 相比于间/对位取代,活性氧自由基如·OH更倾向于攻击苯环的邻/间位置而发生亲核加成反应,与 PBDEs好氧微生物降解中关键产物的检出相吻合。这为明晰PBDEs好氧微生物降解的分子作用机制,进而促进高效好氧降解菌的选育与污染修复应用提供了科学依据。
[1] Vonderheide A P, Mueller K E, Meija J, et al. Polybrominated diphenyl ethers: Causes for concern and knowledge gaps regarding environmental distribution, fate and toxicity[J]. Science of the Total Environment, 2008, 400(1/2/3): 425–436
[2] Alaee M, Arias P, Sjodin A, et al. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/ regions and possible modes of release[J]. Environment International, 2003, 29(6): 683–689
[3] Birgul A, Katsoyiannis A, Gioia R, et al. Atmospheric polybrominated diphenyl ethers (PBDEs) in the United Kingdom[J]. Environ Pollut, 2012, 169: 105–111
[4] Hale R C, Alaee M, Manchester-Neesvig J B, et al. Polybrominated diphenyl ether flame retardants in the North American environment[J]. Environment International, 2003, 29(6): 771–779
[5] Law R J, Allchin C R, de Boer J, et al. Levels and trends of brominated flame retardants in the European environment[J]. Chemosphere, 2006, 64(2): 187–208
[6] Luo Y, Luo X J, Lin Z, et al. Polybrominated diphenyl ethers in road and farmland soils from an e-waste recycling region in Southern China: Concentrations, source profiles, and potential dispersion and deposition[J]. Science of the Total Environment, 2009, 407(3): 1105–1113
[7] Yang S W, Fu Q, Teng M, et al. Polybrominated diphenyl ethers (PBDEs) in sediment and fish tissues from Lake Chaohu, central eastern China[J]. Archives of Environmental Protection, 2015, 41(2): 12–20
[8] 曾光明, 刘敏茹, 陈耀宁, 等. 土壤中多溴联苯醚研究进展[J]. 土壤学报, 2014, 51(5): 934–943
[9] Erratico C, Currier H, Szeitz A, et al. Levels of PBDEs in plasma of juvenile starlings (Sturnus vulgaris) from British Columbia, Canada and assessment of PBDE metabolism by avian liver microsomes[J]. Science of the Total Environment, 2015, 518: 31–37
[10] Hoydal K S, Letcher R J, Blair D A D, et al. Legacy and emerging organic pollutants in liver and plasma of long-finned pilot whales (Globicephala melas) from waters surrounding the Faroe Islands[J]. Science of the Total Environment, 2015, 520: 270–285
[11] 万斌, 郭良宏. 多溴联苯醚的环境毒理学研究进展[J].环境化学, 2011, 30(1): 143–152
[12] Peters A K, Nijmeijer S, Gradin K, et al. Interactions of polybrominated diphenyl ethers with the aryl hydrocarbon receptor pathway[J]. Toxicological Sciences, 2006, 92(1): 133–142
[13] Politi R, Rusyn I, Tropsha A. Prediction of binding affinity and efficacy of thyroid hormone receptor ligands using QSAR and structure-based modeling methods[J]. Toxicol. Appl. Pharmacol., 2014, 280(1): 177–189
[14] Yang W, Mu Y, Giesy J P, et al. Anti-androgen activity of polybrominated diphenyl ethers determined by comparative molecular similarity indices and molecular docking[J]. Chemosphere, 2009, 75(9): 1159–1164
[15] Chen G, Bunce N J. Polybrominated diphenyl ethers as Ah receptor agonists and antagonists[J]. Toxicol. Sci., 2003, 76(2): 310–320
[16] 王赢利, 陈建松, 阳宇翔, 等. 十溴联苯醚对秀丽隐杆线虫毒性研究[J]. 土壤学报, 2015, 52(5): 1116–1123
[17] Costa L G, Giordano G. Developmental neurotoxicity of polybrominated diphenyl ether (PBDE) flame retardants[J]. Neurotoxicology, 2007, 28(6): 1047–1067
[18] McDonald T A. A perspective on the potential health risks of PBDEs[J]. Chemosphere, 2002, 46(5): 745–755
[19] Yang J, Chan K M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL[J]. Aquatic Toxicology, 2015, 159: 138–147
[20] Hamers T, Kamstra J H, Sonneveld E, et al. Biotransformation of brominated flame retardants into potentially endocrine-disrupting metabolites, with special attention to 2,2',4,4'-tetrabromodiphenyl ether (BDE-47)[J]. Mol. Nutr. Food Res., 2008, 52(2): 284–298
[21] Lagalante A F, Shedden C S, Greenbacker P W. Levels of polybrominated diphenyl ethers (PBDEs) in dust from personal automobiles in conjunction with studies on the photochemical degradation of decabromodiphenyl ether (BDE-209)[J]. Environment International, 2011, 37(5): 899–906
[22] Liu Z T, Gu C G, Ye M, et al. Debromination of polybrominated diphenyl ethers by attapulgite-supported Fe/Ni bimetallic nanoparticles: Influencing factors, kinetics and mechanism[J]. J Hazard Mater, 2015, 298: 328–337
[23] Mas S, de Juan A, Lacorte S, et al. Photodegradation study of decabromodiphenyl ether by UV spectrophotometry anda hybrid hard- and soft-modelling approach[J]. Anal. Chim. Acta, 2008, 618(1): 18–28
[24] 刘翠英, 王艳玲, 蒋新. 六氯苯在土壤中的主要迁移转化过程[J]. 土壤, 2014, 46(1): 29–34
[25] 唐婷婷, 金卫根. 多环芳烃微生物降解机理研究进展[J]. 土壤, 2010, 42(6): 876–881
[26] Kim Y M, Nam I H, Murugesan K, et al. Biodegradation of diphenyl ether and transformation of selected brominated congeners by Sphingomonas sp. PH-07[J]. Appl. Microbiol. Biotechnol., 2007, 77(1): 187–194
[27] Shi G Y, Yin H, Ye J S, et al. Aerobic biotransformation of decabromodiphenyl ether (PBDE-209) by Pseudomonas aeruginosa[J]. Chemosphere, 2013, 93(8): 1487–1493
[28] Robrock K R, Coelhan M, Sedlak D L, et al. Aerobic Biotransformation of Polybrominated Diphenyl Ethers (PBDEs) by Bacterial Isolates[J]. Environ. Sci. Technol., 2009, 43(15): 5705–5711
[29] 杨志浩, 吴鹏, 吴梅林, 等. 多溴联苯醚的微生物降解研究进展[J]. 生态科学, 2014, 6): 1224–1230
[30] Robrock K R, Mohn W W, Eltis L D, et al. Biphenyl and Ethylbenzene Dioxygenases of Rhodococcus jostii RHA1 Transform PBDEs[J]. Biotechnology and Bioengineering, 2011, 108(2): 313–321
[31] Suenaga H, Goto M, Furukawa K. Active-site engineering of biphenyl dioxygenase: Effect of substituted amino acids on substrate specificity and regiospecificity[J]. Appl. Microbiol. Biotechnol., 2006, 71(2): 168–176
[32] Goris J, De Vos P, Caballero-Mellado J, et al. Classification of the biphenyl-and polychlorinated biphenyl-degrading strain LB400T and relatives as Burkholderia xenovorans sp. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(5): 1677–1681
[33] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 03, revision B. 03[J]. Gaussian Inc, Pittsburgh, PA, 2003
[34] Zhang S W, Xia X H, Xia N, et al. Identification and biodegradation efficiency of a newly isolated 2,2',4,4'-tetrabromodiphenyl ether (BDE-47) aerobic degrading bacterial strain[J]. International Biodeterioration & Biodegradation, 2013, 76: 24–31
[35] McQuarrie D A, Simon J D. Physical chemistry: a molecular approach[M]. Sterling Publishing Company, 1997
[36] Yamazoe A, Yagi O, Oyaizu H. Biotransformation of fluorene, diphenyl ether, dibenzo-p-dioxin and carbazole by Janibacter sp.[J]. Biotechnology letters, 2004, 26(6): 479–486
Research on Aerobic Biodegradation Kinetics Process and Thermodynamic Mechanism of PBDEs
CHENG Yinwen1,2, GU Chenggang1*, LIU Zongtang1,2, ZHU Mengrong1,2, LIU Chang1,2, YE Mao1, BIAN Yongrong1, YANG Xinglun1, JIANG Xin1
(1 Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
Polybrominated diphenyl ethers (PBDEs) are typified as kinds of brominated flame retardants which are widely used around the world. They have some characteristics like semi-volatilization, bioaccumulation, neurotoxicology and endocrine disrupting effects, which severely threaten the ecological system and human health. In this study, a typical aerobic biodegradation strain LB400 was chosen for the performance of degradation kinetics process of lower and middling PBDEs congeners, which are widely detected in the environment. The influence of extra carbon sources as the co-metabolism substrates on degradation performance was discussed. With the simulative computation of variation of thermodynamical state function of key reaction path during degradation, the relationship between the calculated thermodynamics and biodegradation kinetics constant was revealed as well. It is indicated that the highest degradation rate would be obtained if biphenyl were added as the carbon source. Within 0–120 h, all tested PBDEs could be effectively degraded by LB400, and the process could be well described by the first-order kinetics. Relatively, the initial hydroxylation of PBDEs might be the rate-limiting step in the degradation process, and such reactive oxygen radicals as ·OH prefers the nucleophilic addition at ortho/meta position to that occurred at meta/para sites of benzene ring. This study could help deeply understand the molecular mechanics of PBDEs aerobic biodegradation, provide some scientific proofs on the selection of highly efficient degradation strains in the soil as well as the application in the soil contaminated remediation.
PBDEs; Co-metabolism; Degradation kinetics; Hydroxylation; Thermodynamic mechanism
X13;X592
A
10.13758/j.cnki.tr.2017.01.016
国家自然科学基金项目(21377138)、国家重点基础研究发展计划(973计划)项目(2014CB441105)、国家自然科学基金项目(41271327和41271464)和中科院“一三五”计划和领域前沿项目(ISSASIP1618)资助。
* 通讯作者(cggu@issas.ac.cn)
程吟文(1992—),女,安徽合肥人,硕士研究生,研究方向为PBDEs好氧微生物降解及其分子作用机制。E-mail: ywcheng@issas.ac.cn

