姜黄素对2型糖尿病肾病大鼠保护作用及机制研究
王道周 裘志成 杨 艳 张涤华
(铜仁市人民医院肾脏内分泌血液科,铜仁554300)
姜黄素对2型糖尿病肾病大鼠保护作用及机制研究
王道周 裘志成①杨 艳②张涤华②
(铜仁市人民医院肾脏内分泌血液科,铜仁554300)
目的:探讨姜黄素对2型糖尿病肾病(DN)大鼠保护作用及可能的作用机制。方法:30只Wistar大鼠随机分为对照组、DN组和姜黄素组,每组10只。DN组和姜黄素组采用高脂饲料喂养后注射链脲佐菌素建立DN模型,造模成功后姜黄素组以200 mg/kg姜黄素灌胃,每天1次,对照组和DN组给予等量羧甲基纤维素钠灌胃,连续给药12周。末次给药后收集24 h尿量,称重,腹腔麻醉后心脏取血,检测血糖(Blood glucose,BG)、总胆固醇(Total cholesterol,TC)、甘油三酯(Triacylglyceride,TG)、血尿素氮(Blood urea nitrogen,BUN)、血肌酐(Serum creatinine,Scr)、尿微量白蛋白(Vrine microalbumin,mAlb),计算尿蛋白排泄率(Urinary protein excretion rate,UAER);处死大鼠,摘取双肾除去包膜后称重(KM),计算肾重指数(KI);多聚甲酚固定肾皮质用于苏木素-伊红(HE)染色,肾皮质制成匀浆检测MDA和SOD活性,Western blot检测肾组织中核因子相关因子2(Nrf2)和血红素加氧酶1(HO-1)蛋白表达。结果:DN组和姜黄素组BG、TC、TG、KI、BUN、Scr、UAER、MDA显著高于对照组,BM、KM、SOD显著低于对照组,且姜黄素组上述指标升高或降低幅度小于DN组,差异均有统计学意义(P<0.05);HE染色结果显示,与DN组比较,姜黄素组肾小管变性明显减轻,炎性细胞浸润明显减少;Western blot结果显示对照组Nrf2和HO-1蛋白表达显著低于DN组和姜黄素组,而姜黄素组显著高于DN组,差异均有统计学意义(P<0.05)。结论:姜黄素可能通过激活Nrf2/ARE信号通路,降低糖尿病肾病大鼠氧化应激、发挥肾脏保护作用。
姜黄素;2型糖尿病肾病;氧化应激;Nrf2/ARE信号通路
糖尿病(Diabetes mellitus,DM)是一种全身性代谢疾病,以持续高血糖为主要特征,是严重危害人类健康的最常见慢性非传染性疾病之一。各地区流行病数据均显示,DM的患病率以及患病人数均显著上升[1,2]。2013版的中国2型糖尿病防治指南中指出[3],2007~2008年全国糖尿病流行病学调查显示我国20岁以上成年人糖尿病患病率高达9.7%,糖尿病前期人数高达50%。糖尿病肾病(Diabetic nephropathy,DN)是常见的DM微血管并发症,我国约39.7%的糖尿病患者合并慢性肾脏疾病[3]。DM患者由于系膜区细胞外基质(Extra cellular matrix,ECM)进行性积聚,肾小球基底膜增厚,引起肾小球呈弥漫性或结节性,甚至出现硬化,引起大量蛋白尿,肾功能呈进行性下降,并最终发展为终末期肾病。DN是引起终末期肾病的重要原因之一,因此,探讨DN有效治疗方案,提高DN治疗效果,对于改善患者生活质量,保障人类生命健康具有重要的意义。
目前关于DN的发病机制不明确,研究发现糖代谢异常、遗传易感、血流动力学障碍、细胞因子过表达、脂质代谢紊乱等多种因素和多个环节共同参与了DN的发病,且氧化应激在诸多机制中均扮演了不同程度的作用[4]。转化生长因子β1(Transforming growth factor-β1,TGF-β1)在肾小球ECM积聚、基底膜增厚等肾脏病理学形态改变中具有关键性的作用。作为重要的致纤维化因子,TGF-β1不仅能够抑制ECM降解,还能诱导包括纤连蛋白在内的多种ECM成分表达并积聚于肾小球内,并引起肾间质纤维化和肾小球硬化。而低水平的活性氧(Reactive oxygen species,ROS)堆积以及高血糖介导的氧化应激是TGF-β1激活和高表达的重要因素之一[5]。
Nrf2-ARE信号通路是一种重要的抗氧化应答机制信号通路。核因子E2相关因子2(Nrf2)是一个转录因子,富含亮氨酸拉链结构,能够调控细胞和机体对抗氧化应激损伤。Nrf2结构上的Neh1区域通过识别并结合抗氧化反应元件(ARE)上的碱基系列启动ARE调控的抗氧化酶基因表达,从而清除ROS,降低细胞和机体受到的氧化应激损伤,并维持细胞内氧分压动态平衡[6]。Nrf2降低机体氧化应激损伤可能通过激活或增加血红素加氧酶1(Heme oxygenase-1,HO-1)等细胞内氧化还原基因有关[7]。赵璐等[8]采用丙二醛(Malondialdehyde,MDA)处理肾小球系膜细胞,结果发现,MDA能显著抑制HO-1以及Nrf2的表达,认为MDA可能通过抑制Nrf2/ARE来调控ROS生成,从而抑制肾小球系膜细胞的活性,影响DN。
姜黄素是一种植物多酚,是姜黄的主要成分,具有广泛的生物活性。近年来,姜黄素已经广泛应用于临床治疗溃疡性结肠炎、急性百草枯中毒、双向情感障碍[9-11]。Stauffer等[12]研究发现姜黄素能够增加CD20抗原表达促进淋巴瘤细胞凋亡。关于姜黄素对DN大鼠肾脏保护作用已有报道,但研究具体作用机制的不多,且姜黄素可能通过多种途径发挥肾脏保护作用[13]。本研究旨在探讨姜黄素对DN大鼠肾脏保护作用及可能的作用机制。
1 材料与方法
1.1 实验材料 30只2月龄雄性Wistar大鼠,体重150~170 g,均购自贵州医科大学动物实验中心,许可证号:SCXK(黔)2012-0001;链脲佐菌素(STZ)购自美国Sigma公司;姜黄素购自上海国药集团化学试剂有限公司,批号:8239401,纯度为99%;7600自动生化分析仪购自日本Hitachi公司;血糖检测仪购自罗氏公司;CP224S电子天平购自德国Sartorius公司;mAlb、超氧化物歧化酶(Superoxide dismutase,SOD)、MDA试剂盒购自武汉博士德生物技术有限公司;图像分析系统为美国Media-Cybernetics公司Image-proplus6.5;光学显微镜购自日本Olympus公司;聚偏氟乙烯微孔膜购自德国Merck-Millipore公司;anti-β-actin、anti-Nrf2、anti-H1、anti-HO-1均购自美国Santa cruz公司;所有动物饲养及后续实验均在医院实验室完成,饲养环境:温度24℃~26℃,相对湿度40%~60%,每12 h光照和黑暗交替,饲养期间自由进食和饮水。本研究经医院伦理委员会批准实施,符合动物伦理相关规定。
1.2 方法
1.2.1 动物分组及造模 适应性喂养5 d,随机分为3组,对照组10只,始终给予正常饲养;DN组和姜黄素组各10只,实验开始时给予高脂饲料喂养,5周时饥饿12 h后注射25 mg/kg STZ,此时对照组大鼠腹腔注射等量生理盐水。
1.2.2 给药方法 STZ注射72 h后检测BG,以BG大于16.7 mmol/L,24 h尿量以及尿白蛋白大于造模前50%为造模成功,两组均造模成功,造模成功后姜黄素组以200 mg/kg(羧甲基纤维素钠配置成混悬液)姜黄素灌胃,每天1次,对照组和DN组给予等量羧甲基纤维素钠灌胃,连续给药12周。
1.2.3 标本收集及生化指标检测 末次给药后收集24 h尿量,分装保存待检。称重,腹腔麻醉后心脏取血、离心、分离血清保存待检。采用血糖仪检测BG,生化分析仪检测TC、TG、BUN、Scr,按照试剂盒方法检测mAlb,计算尿蛋白排泄率(UAER)=mAlb×24 h尿量/时间。处死大鼠,摘取双肾除去包膜后称重(KM),计算肾重指数(KI)=BM/KM。取8 mm3肾皮质,采用多聚甲酚固定,用于HE染色。剩余肾皮质切成小块置于液氮中待用。
1.2.4 肾皮质匀浆中MDA和SOD活性检测 取0.5g肾皮质,制成10%的生理盐水匀浆,离心分离上清液,按照试剂盒方法检测MDA和SOD活性,严格按照操作说明进行。
1.2.5 HE染色 多聚甲酚固定的肾组织石蜡包埋,切成3 μm切片,冷却后备用。染色时常规脱蜡,水化;磷酸缓冲液(PBS)洗涤2~3次,每次5 min;苏木素液染核2 min,盐酸酒精分化后自来水冲洗至细胞核变蓝,伊红溶液染色3 min,自来水冲洗后乙醇脱水,树胶封片后镜下观察。
1.2.6 Western blot 取肾皮质组织0.1 mg,组织裂解液裂解,冰浴匀浆后离心取上清液,上清液加入上样缓冲液进行封闭,10 min沸水浴,-80℃保存。以20 μl总蛋白样品上样,聚丙烯酰胺凝胶电泳,转至PVDF微孔膜,用脱脂奶粉封存60 min,4℃条件下一抗封闭。PBST(PBS溶液加上Tween-20)洗膜3次后加入二抗,常温孵育60 min,PBST漂洗,采用凝胶成像系统成像并用Image-proplus6.5分析目的条带灰度值。分别采用β-actin、H1对HO-1、Nrf2进行校正。
2 结果
2.1 三组一般情况及体质量、肾质量比较 实验期间对照组体质量缓慢增加,精神状态良好,毛泽光滑,动作自如,反应灵敏,进食、饮水和尿量正常。DN组建模成功后逐渐出现消瘦、 多食、多饮、多尿,精神萎靡、反应迟钝、尾巴苍白湿冷、毛发枯黄等表现;姜黄素组建模成功后表现以DN组类似,但给药4周后毛色明显转好,精神状态有所改善,饮水、进食和尿量均有所改善,给药8周后上述现象改善尤为明显。待实验结束后称重,对照组BM和KM显著高于DN组和姜黄素组,KI显著低于DN组和姜黄素组,而姜黄素组BM和KM显著高于DN组,KI显著低于DN组,差异均有统计学意义(P<0.05),见表1。
2.2 三组血糖、血脂和肾功能指标比较 实验结束后,对照组BG、TC、TG、BUN、Scr和UAER均显著低于DN组和姜黄素组,而姜黄素组上述指标均显著低于DN组,差异均有统计学意义(P<0.05),见表2。
2.3 三组肾皮质匀浆中应激指标比较 对照组肾皮质匀浆中SOD活性显著高于DN组和姜黄素组,MDA水平显著低于DN组和姜黄素组,姜黄素组SOD活性显著高于DN组,MDA水平显著低于DN组,差异均有统计学意义(P<0.05),见表3。
2.4 三组肾脏病理学变化比较 HE染色结果显示,对照组大鼠肾小球毛细血管腔均匀一致,无狭窄;肾小管结构清晰,背靠背排列紧密,上皮细胞基底膜完整,排列整齐,间质未见炎性细胞浸润。DN组肾小球肥大、变形,系膜细胞增生,肾小管上皮变性,部分肾小管管腔出现扩张,间质可见大量炎性细胞浸润;姜黄素组肾小管变性明显减轻,炎性细胞浸润明显减少,见图1。
表1 各组体质量、肾质量比较
Tab.1 Comparison of body mass and kidney mass among each group

GroupsnBM(g)KM(g)KI(102)Controlgroup10349 21±14 421 63±0 212 14±0 25DNgroup10302 44±18 871)1 06±0 171)2 85±0 431)Curcumingroup10331 38±19 301)2)1 34±0 191)2)2 47±0 341)2)
Note:Compared with control group,1)P<0.05;compared with DN group,2)P<0.05.
表2 三组血糖、血脂和肾功能指标比较
Tab.2 Comparison of blood sugar,blood lipid and renal function among three groups
Note:Compared with control group,1)P<0.05;compared with DN group,2)P<0.05.
表3 三组肾皮质匀浆中SOD活性和MDA水平比较
Tab.3 Comparison of SOD activity and MDA level in renal cortex homogenate among three groups

GroupsCasesMDA(mmol/mg)SOD(U/mg)Controlgroup102 56±0 30523 12±56 64DNgroup104 02±0 621)332 64±42 891)Curcumingroup103 12±0 541)2)453 69±46 681)2)
Note:Compared with control group,1)P<0.05;compared with DN group,2)P<0.05.

图1 三组肾脏病理组织HE染色结果Fig.1 HE staining results of renal pathological tissue in three groupsNote:CON.Control group;DN.DN group;CUR.Curcumin group,proportion is 100 μm,magnification is 400 times.

图2 三组Nrf2和HO-1蛋白表达Fig.2 Expression of Nrf2 and HO-1 in three groupsNote:CON.control group;DN.DN group;CUR.Curcumin group.
表4 三组Nrf2和HO-1蛋白相对表达量
Tab.4 Expression relatively of Nrf2 and HO-1 in three groups
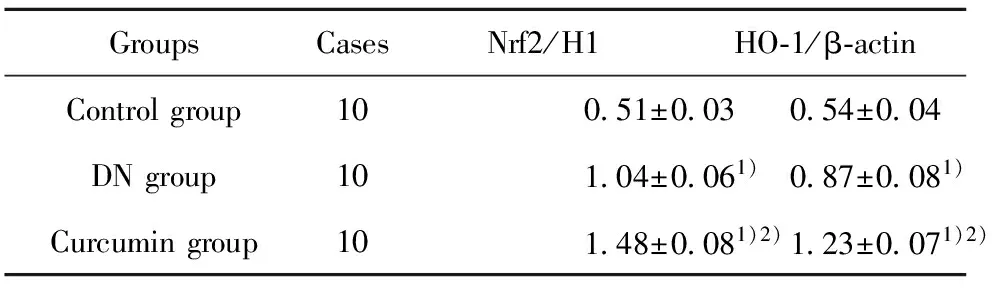
GroupsCasesNrf2/H1HO⁃1/β⁃actinControlgroup100 51±0 030 54±0 04DNgroup101 04±0 061)0 87±0 081)Curcumingroup101 48±0 081)2)1 23±0 071)2)
Note:Compared with control group,1)P<0.05;compared with DN group,2)P<0.05.
2.5 三组Nrf2和HO-1蛋白表达比较 Western blot结果显示对照组Nrf2和HO-1蛋白表达显著低于DN组和姜黄素组,而姜黄素组显著高于DN组,差异有统计学意义(P<0.05),见图2、表4。
3 讨论
DN也可以称为糖尿病肾小球硬化症,这与其病理改变有关。DN早期病理表现为肾小球基底膜增厚和肥大,晚期表现为ECM在肾小球内聚积,形成肾小球结节性病变,继而出现典型的肾小球硬化改变。现代医学治疗DN主要包括严格控制血压、血脂和血糖,限制蛋白质的摄入,抑制肾素-血管紧张素-醛固酮系统作用,减少蛋白尿排泄,终末期采用肾脏替代治疗。传统中医中药在DN的治疗中具有显著的优势,能够显著改善DN患者临床症状、调节血脂、降低血糖、减少尿蛋白以及改善肾功能,发挥多靶点整体调节作用。从分子水平出发,探讨中药有效成分对DN的改善作用及机制是目前研究的热点。本研究中姜黄素为黄酮类植物多酚,具有广泛的生物活性。采用高脂饲料联合低剂量STZ诱导2型糖尿病肾病大鼠模型,能够很好的模拟人类2型糖尿病肾病疾病的特征和病程进展。结果发现,姜黄素能够显著降低血糖指标BG、血脂指标TC和TG、肾重指数以及肾功能指标BUN、Scr、UAER,提高BM、KM,减轻肾小管变性和炎性细胞浸润程度,发挥肾脏保护作用。本研究结果与田华等[14]结果类似。
正常状态机体产生少量的ROS可以被机体内存在的抗氧化体系清除,使得ROS处于动态平衡,而当ROS产生过多或者抗氧化防御功能损伤时可引起机体氧化应激。高糖主要通过以下途径引起肾小球系膜细胞(Glomerular mesangial cells,MsC)生产ROS增多[15]:①高糖会引起MsC线粒体内膜电位差增加,造成超极化,呼吸链复合物中辅酶Q的电子传递能够还原氧分子,生成ROS;②高糖能够形成非酶糖基化,通过激活多元醇通路、蛋白激酶C以及糖酵解等相关还原型氧化酶,生成大量ROS;③高糖还能间接通过晚期糖基化终末产物诱导ROS产生。
Nrf2能够防御氧化应激反应,是细胞重要的转录因子,通过结合ARE上调Ⅱ相解毒酶和抗氧化蛋白表达,增加细胞抗氧化能力。Ma等[16]发现,无论是防御内源性或外源性氧化应激,Nrf2信号通路均发挥重要的作用。Yang等[17]发现,Nrf2信号通路激活能够降低2型糖尿病患者尿白蛋白排泄。Shang等[18]认为Nrf2信号通路对以氧化应激为主要发病机制的DN具有保护作用。正常生理状态下,Nrf2与kelch样环氧氯丙烷相关蛋白1(Kelch-like ech-associated protein-1,Keap1)形成二聚体,活性受到抑制。机体出现氧化应激时,Nrf2-Keap1二聚体解离,游离的Nrf2进入细胞核,从而与ARE结合,激活下游靶分子HO-1以及SOD等抗氧化酶表达,增强抗氧化能力,发挥抗氧化应激作用。此外,氧化应激还能促进Nrf2基因转录和蛋白合成。本研究结果发现,DN组大鼠血清MDA显著高于对照组,SOD显著低于对照组,说明DN会引起机体氧化应激。与对照组相比,DN组Nrf2和HO-1蛋白表达显著增加,说明氧化应激会激活Nrf2-ARE信号通路发挥抗氧化应激作用。而姜黄素组MDA显著低于DN组,SOD显著高于DN组,说明姜黄素治疗可以降低DN氧化应激反应。姜黄素组Nrf2和HO-1蛋白表达显著高于DN组,说明姜黄素可能通过激活Nrf2/ARE信号通路降低糖尿病大鼠氧化应激。
综上所述,本研究结果发现,姜黄素对2型糖尿病肾病大鼠具有肾脏保护作用,能够改善血脂和糖代谢,减轻肾小管变性和炎性细胞浸润程度,保护肾脏功能,延缓肾脏损伤。其可能通过激活Nrf2/ARE信号通路,降低糖尿病肾病大鼠氧化应激,发挥肾脏保护作用。正如前文所言,DN的发病机制复杂,DN的发病受到多种因素和多个环节共同调节,姜黄素是否通过其他途径发挥肾脏保护作用有待进一步明确。
[1] Shah AD,Langenberg C,Rapsomaniki E,etal.Type 2 diabetes and incidence of cardiovascular diseases:a cohort study in 1·9 million people[J].Lancet Diabetes Endocrinol,2015,3(2):105-113.
[2] Adler AI.Trevor orchard:fruitful contributions to diabetes epidemiology[J].Diabetes Care,2015,38(9):1634-1637.
[3] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志,2014,22(8):2-42.
[4] Dabhi B,Mistry KN.Oxidative stress and its association with TNF-α-308 G/C and IL-1α-889 C/T gene polymorphisms in patients with diabetes and diabetic nephropathy[J].Gene,2015,562(2):197-202.
[5] Tabur S,Korkmaz H,Eren MA,etal.Urotensin-II level and its association with oxidative stress in early diabetic nephropathy[J].J Diabetes Complications,2015,29(1):115-119.
[6] Jang M,Cho IH.Sulforaphane ameliorates 3-nitropropionic acid-induced striatal toxicity by activating the Keap1-Nrf2-ARE pathway and inhibiting the MAPKs and NF-κB pathways[J].Mol Neurobiol,2016,53(4):2619-2635.
[7] Izumi Y,Yamamoto N,Matsushima S,etal.Compensatory role of the Nrf2-ARE pathway against paraquat toxicity:Relevance of 26S proteasome activity[J].J Pharmacol Sci,2015,129(3):150-159.
[8] 赵 璐,孙俊波,金小琴.丙二醛通过抑制Nrf2/ARE促进肾小球系膜细胞凋亡[J].基础医学与临床,2015,35(1):69-73.
[9] Lang A,Salomon N,Wu JC,etal.Curcumin in combination with mesala mine induces remission in patients with mild-to-moderate ulcerative colitis in a randomized controlled trial[J].Clin Gastroenterol Hepatol,2015,13(8):1444-1449.
[10] 蒋 丽.姜黄素治疗急性百草枯中毒的临床研究[J].临床急诊杂志,2012,13(3):169-172.
[11] Brietzke E,Mansur RB,Zugman A,etal.Is there a role for curcumin in the treatment of bipolar disorder?[J].Med Hypotheses,2013,80(5):606-612.
[12] Stauffer RG,Mohammad M,Singh AT.Novel nanoscale delivery particles encapsulated with anticancer drugs,all-trans retinoic acid or curcumin,enhance apoptosis in lymphoma cells predo minantly expressing CD20 antigen[J].Anticancer Res,2015,35(12):6425-6429.
[13] Qu W,Xiao J,Zhang H,etal.B19,a novel monocarbonyl analogue of curcu min,induces human ovarian cancer cell apoptosis via activation of endoplasmic reticulum stress and the autophagy signaling pathway[J].Int J Biol Sci,2013,9(8):766-777.
[14] 田 华,母传贤,尤丽菊,等.姜黄素对糖尿病肾病大鼠肾脏的保护作用及其机制[J].吉林大学学报(医学版),2013,39(4):747-750,866.
[15] Zheng J,Inoguchi T,Sasaki S,etal.Phycocyanin and phycocyanobilin from Spirulina platensis protect against diabetic nephropathy by inhibiting oxidative stress[J].Am J Physiol Regul Integr Comp Physiol,2013,304(2):R110-120.
[16] Ma WW,Li CQ,Yu HL,etal.The oxysterol 27-hydroxycholesterol increases oxidative stress and regulate Nrf2 signaling pathway in astrocyte cells[J].Neurochem Res,2015,40(4):758-766.
[17] Yang H,Xu W,Zhou Z,etal.Curcumin attenuates urinary excretion of albumin in type II diabetic patients with enhancing nuclear factor erythroid-derived 2-like 2(Nrf2)system and repressing inflammatory signaling efficacies[J].Exp Clin Endocrinol Diabetes,2015,123(6):360-367.
[18] Shang G,Tang X,Gao P,etal.Sulforaphane attenuation of experimental diabetic nephropathy involves GSK-3 beta/Fyn/Nrf2 signaling pathway[J].J Nutr Biochem,2015,26(6):596-606.
[收稿2016-06-06 修回2016-08-11]
(编辑 许四平)
Protective effect of curcumin on type 2 diabetic nephropathy rats and mechanism research
WANGDao-Zhou,QIUZhi-Cheng,YANGYan,ZHANGDi-Hua.
DepartmentofRenalEndocrinology,TongrenPeople′sHospital,Tongren554300,China
Objective:To explore the protective effect of curcumin on type 2 diabetic nephropathy rats and the possible mechanism.Methods:30 Wistar rats were randomly divided into control group,the DN group and curcumin group,10 cases in each group,rats in DN and curcumin group were fed with high fat,after that they were used the streptozotocin injection to set up DN model.In addition,rats in curcumin group were given 200 mg/kg curcumin once a day,other two group were given sodium carboxymethylcellulose half-and-half.After 12 weeks,the 24 h urine were collected at the last delivery,the blood glucose(BG),total cholesterol(TC),triglyceride(TG),blood urea nitrogen(BUN),serum creatinine(Scr),microalbu minuria(mAlb) were tested,the urinary albumin excretion rate(UAER) was calculated.Furthermore,rats were sacrificed,kidney mass weighed,and the kidney index(KI) was calculated.Renal cortical was fixed with polymers cresol for hematoxylin-eosin(HE) staining,renal cortical was also made renal cortex homogenate and the SOD activity,MDA were detected,the expression of nuclear factor related factor 2(Nrf2) and heme oxygenase 1(HO-1) protein in the kidney tissues was detected with Western blot detection.Results:BG,TC,TG,KI,BUN,Scr,UAER,MDA of DN group and curcumin group were significantly higher than control group,and BM,KM,SOD was significantly lower than the control group,the amplitude raising or reducing in curcumin group were less than DN group,the difference had statistical significance(P<0.05);HE staining results showed that,compared with DN group,renal tubule degeneration in curcumin group was obviously reduced,inflammatory cells infiltration was decreased significantly;Western blot results showed that expression of Nrf2 and HO-1 protein in control group were significantly lower than DN group and curcumin group,and curcumin group was significantly higher than the DN group,the differences were statistically significant(P<0.05).Conclusion:Curcumin may play a role of kidney protection through the activation of Nrf2/ARE signaling pathway to reduce oxidative stress in diabetic nephropathy rats.
Curcumin;Type 2 diabetic nephropathy;Oxidative stress;Nrf2/ARE signaling pathways
10.3969/j.issn.1000-484X.2017.04.023
王道周(1967年-),男,副主任医师,主要从事肾脏病、内分泌及代谢性疾病方面的诊治工作,E-mail:wangdaozhou88@163.com。
R285.5
A
1000-484X(2017)04-0588-05
①遵义医学院附属医院肾病风湿科,遵义 563003。
②中山大学附属第一医院肾内科,广州 510080。

