晚期骨关节炎患者血清和关节液中基质金属蛋白酶-13和肿瘤坏死因子-α 水平的变化及其意义
符维广 许立新
晚期骨关节炎患者血清和关节液中基质金属蛋白酶-13和肿瘤坏死因子-α 水平的变化及其意义
符维广 许立新
目的比较两级骨关节炎血清与关节液中基质金属蛋白酶-13 ( MMP-13 ) 和肿瘤坏死因子-α ( TNF-α ) 的水平,探讨其与膝骨关节炎 WOMAC 指数之间的相关性。方法 选取 2015 年 9 月至 2016 年4 月,我院收治的 42 例 3 级与 4 级膝骨关节炎患者 ( 平均年龄 64±8.8 岁 ) 作为研究对象,所有患者均行全膝关节置换术。采用酶联免疫吸附法测量患者术前静脉血和术中膝关节液中 TNF-α 与 MMP-13 水平。对患者术前及术后 1 个月的膝关节功能进行 WOMAC 指数评估。结果 患者的血清 TNF-α 水平 ( 0.226±0.246 ) pg / ml显著高于关节液 ( 0.124±1.59 ) pg / ml ( P<0.05 ),关节液 MMP-13 水平 ( 4.31±1.24 ) pg / ml 显著高于血清( 1.089±1.519 ) pg / ml ( P<0.05 )。4 级膝骨关节炎患者的关节液 MMP-13 水平 ( 5.76±4.82 ) pg / ml 显著高于3 级膝骨关节炎患者 ( 2.95±2.45 ) pg / ml ( P<0.05 ),而 3 级膝骨关节炎患者的血清 MMP-13 水平 ( 1.128± 0.308 ) pg / ml 与 4 级膝骨关节炎患者 ( 1.038±0.204 ) pg / ml 相比,差异无统计学意义 ( P>0.05 )。4 级膝骨关节炎患者的血清 TNF-α 水平 ( 0.293±0.140 ) pg / ml 显著高于 3 级膝骨关节炎患者 ( 0.204±0.109 ) pg / ml 差异有统计学意义 ( P<0.05 ),而 3 级膝骨关节炎患者关节液 TNF-α 水平 ( 0.129±0.052 ) pg / ml 与 4 级膝骨关节炎患者 ( 0.118±0.014 ) pg / ml 相比,差异无统计学意义 ( P>0.05 )。关节液 MMP-13 水平与术后 WOMAC 评分呈正相关 ( P<0.05 )。结论 随着骨关节炎等级的增高,TNF-α 的全身水平会不断升高;而 MMP-13 水平的升高只发生在局部病灶,且与患者的术后 WOMAC 评分呈显著相关。
膝骨关节炎膝;基质金属蛋白酶-13;肿瘤坏死因子 α;膝关节
骨关节炎 ( osteoarthritis,OA ) 是一种常见的骨科疾病,多发于老年人,是由肥胖、劳损、创伤、关节先天性异常、关节畸形等因素引起的关节软骨退化损伤、关节边缘和软骨下骨反应性增生。近期的研究表明,软骨下骨和滑膜在该类疾病的发生机制中起了重要作用[1]。此外,关节周围及双侧致密骨岛也可引起软骨侵蚀,促进骨关节炎的进展[2]。不稳定或异常的胫股运动会影响关节软骨负荷,引发复杂的病理生理机制,导致软骨退化[3]。细胞外基质 ( ECM ) 可通过金属蛋白酶 ( MMPs ) 降解 ECM蛋白进行更新。MMPs 由巨噬细胞、成纤维细胞和软骨细胞接受白细胞介素-1β ( IL-1β ) 和肿瘤坏死因子-α ( TNF-α ) 的刺激分泌产生。研究显示,与对照组相比,骨关节炎患者软骨下骨,软骨及滑膜标本的 MMP1、3、9、13 水平显著升高,而软骨 MMPs分泌的增加可引起 ECM 的降解[4]。此外,关节软骨机械应力的增加也会引起 TNF-α 和 IL-1α、β、γ-干扰素 ( IFN-γ ) 等促炎因子的激活[5]。TNF-α 由M1 巨噬细胞分泌,可有效响应 IL-1 和细菌毒素 ( 如脂多糖 )[6]。Alaaeddine 等[7]的研究表明,与非关节炎患者相比,骨关节炎患者关节软骨细胞和滑膜细胞的 TNF-α 受体表达量显著升高。与骨关节炎患者的软骨细胞共培养会使正常人软骨细胞的 TNF-α 受体水平上调。MMP-13 和 TNF-α 是骨关节炎进展过程中的 2 个主要因素,本研究对 3 级和 4 级膝关节骨性关节炎患者的局部与全身 MMP-13、TNF-α 水平进行比较,以探讨其与骨关节炎 WOMAC 指数间的相关性。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:( 1 ) 2015 年 9 月至 2016 年 4 月,我院收治的晚期骨关节炎患者;( 2 ) 膝关节 X 线片、MRI 检查符合晚期骨关节炎的诊断标准者;( 3 ) 近 1 个月大多数时间有膝关节疼痛者;( 4 ) 有骨摩擦音者;( 5 ) 晨僵时间≥30 min 者;( 6 ) X 线示骨赘形成者;( 7 ) 关节液检查符合骨关节炎者;( 8 ) 患者年龄≥40 岁者。( 9 ) 有久坐不动的生活习惯者;( 10 ) 没有任何类型的运动创伤经历者;( 11 ) 签署知情同意书者。
2. 排除标准:( 1 ) 患有糖尿病者;( 2 ) 爱迪生氏病者;( 3 ) 服用可能影响细胞因子药物者;( 4 ) 合并有严重原发性疾病及精神病患者,如心、脑血管,肝、肾、内分泌系统及造血系统等;( 5 ) 有严重并发症及全身感染患者;( 6 ) 过敏体质患者;( 7 ) 资料不全者;( 8 ) 不能完成随访者。
二、资料来源
本研究共纳入 42 例 3 级与 4 级患者,其中 3 级18 例,女 16 例,男 2 例,平均年龄 ( 63±6.7 ) 岁;4 级 24 例,女 22 例,男 2 例,平均年龄 ( 64± 9.4 ) 岁。10 例并发高血压者,接受药物治疗以调节血压。所有患者于术前 2 天入院进行术前准备,避免术前住院期间的任何剧烈活动,术前 12 h 使用低分子肝素进行皮下注射,对所有患者提供相同饮食。
纳入研究的所有患者均告知本研究的目的及方法,并签署知情同意书。本研究获得医院伦理委员会批准。
三、标本采集与评价指标
所有患者均行双侧后交叉韧带保留,全膝关节置换术。每例均采用相同的方法对样品进行采集和存储。血液样品的采集与手术同步进行,术前于患者肘前静脉取 3 ml 静脉血备用。所有患者均安排在上午 8∶00 进行手术,最大拖延不超过 5 min。关节液样品于术中暴露膝关节腔后用注射器进行收集。样品采集后立即 1500 ( 有效离心半径 15.9 cm ) 转离心 10 min 并于 -80 ℃ 储存。采用酶联免疫吸附法( ELISA ) 对肿瘤坏死因子-α 和 MMP-13 的水平进行分析。
术前及术后 1 个月,对患者的膝关节功能进行 WOMAC 指数评估。WOMAC 指数共包括 24 个参数,包括疼痛 ( 评分范围:0~20 )、刚度 ( 评分范围:0~8 ) 和功能障碍 ( 评分范围:0~68 )[8]。分析 42 例术前与术后膝关节 WOMAC 评分与血清和关节液 TNF-α、MMP-13 水平间的相关性。分别比较 3 级和 4 级膝骨性关节炎患者之间血清和关节液 TNF-α、MMP-13 水平间的差异,并对所有患者血清和关节液间 TNF-α、MMP-13 的水平进行差异分析。
四、统计学处理
采用 SPSS 20.0 进行统计学分析。计数资料采用χ2检验或 Fisher 确切概率法检验,所有计量资料以表示。用配对样本 t 检验对术前及术后数据进行检验,用 student’s t 检验对 2 种不同等级骨关节炎患者 MMP-13、TNF-α 水平之间的差异进行分析。用 Pearson 相关系数对 WOMAC 评分与 TNF-α、MMP-13 之间的相关性进行分析。P 值<0.05 为差异有统计学意义。
结 果
一、患者血清与关节滑膜液 TNF-α、MMP-13平均水平
42 例的血清 TNF-α 平均为 ( 0.226±0.246 ) pg / ml 显著高于平均关节滑膜液 TNF-α ( 0.124 ± 1.59 ) pg / ml,差异有统计学意义 ( P<0.05 )。与此相反,所有患者血清 MMP-13 平均 ( 1.089±1.519 ) pg / ml 显著低于关节滑膜液 MMP-13 平均 ( 4.31±1.24 ) pg / ml,差异有统计学意义 ( P<0.05 ),( 表1 )。
表1 -42 例膝骨关节炎患者血清与关节滑膜液 TNF-α、MMP-13水平 (, pg / ml )Tab.1 Mean serum and knee syn-ovial fluid TNF-α and MMP-13 levels of 42 osteoarthritic patients (, pg / ml )

表1 -42 例膝骨关节炎患者血清与关节滑膜液 TNF-α、MMP-13水平 (, pg / ml )Tab.1 Mean serum and knee syn-ovial fluid TNF-α and MMP-13 levels of 42 osteoarthritic patients (, pg / ml )
项目 例数 血清 关节液 P 值T N F -α 4 2 0 . 2 2 6 ± 0 . 2 4 6 0 . 1 2 4 ± 1 . 5 9 0 . 0 1 1 M M P -1 3 4 2 1 . 0 8 9 ± 1 . 5 1 9 4 . 3 1 0 ± 1 . 2 4 <0 . 0 0 1
二、不同等级膝骨性关节炎患者血清和关节滑膜液 TNF-α、MMP-13 水平
表2 显示:3 级与 4 级膝骨关节炎患者的关节滑膜液 MMP-13 均显著高于血清 MMP-13 ( P<0.05 );而关节滑膜液 TNF-α 均显著低于血清 TNF-α ( P<0.05 );4 级膝骨关节炎患者的关节滑膜液 MMP-13 ( 5.76±4.82 ) pg / ml 显著高于 3 级膝骨关节炎患者( 2.95±2.45 ) pg / ml,( P<0.05 );3 级膝骨关节炎患者的血清 MMP-13 ( 1.128±0.308 ) pg / ml 与 4 级膝骨关节炎患者 ( 1.038±0.204 ) pg / ml 相比,差异无统计学意义 ( P>0.05 )。4 级膝骨关节炎患者的血清 TNF-α水平 ( 0.293±0.140 ) pg / ml 显著高于 3 级膝骨关节炎患者 ( 0.204±0.109 ) pg / ml,( P<0.05 ),而 3 级膝骨关节炎患者关节液 TNF-α ( 0.129±0.052 ) pg / ml与 4 级膝骨关节炎患者 ( 0.118±0.014 ) pg / ml 相比差异无统计学意义 ( P>0.05 ),( 表2 )。
表2 3 级与 4 -级膝骨性关节炎患者血清与关节滑膜液 TNF-α、MMP-13 水平 (, pg / ml )Tab.2 Mean serum and knee synovial fluid TNF--α and MMP-13 levels in grade 3 and grade 4 osteoarthritis patients (, pg / ml )

表2 3 级与 4 -级膝骨性关节炎患者血清与关节滑膜液 TNF-α、MMP-13 水平 (, pg / ml )Tab.2 Mean serum and knee synovial fluid TNF--α and MMP-13 levels in grade 3 and grade 4 osteoarthritis patients (, pg / ml )
注:P 值为血清与关节液比较结果Notice: P value was the result of comparison between serum and synovial fluid contents
分级 例数 参数 血清 关节液 P 值4 级 24 TNF-α 0.293±0.140 0.118±0.014 0.026 MMP-13 1.038±0.204 5.760±4.820 <0.001 3 级 18 TNF-α 0.204±0.109 0.129±0.052 0.015 MMP-13 1.128±0.308 2.950±2.450 0.006
三、膝关节 WOMAC 指数评分与 TNF-α、MMP-13 水平的相关性
术后患者的 WOMAC 评分 ( 40.2±14.5 ) 显著优于术前 ( 69.9±7.3 ),差异有统计学意义 ( P<0.05 )。Pearson 相关性分析显示,患者术前 WOMAC 评分( 69.9±7.3 ) 和术后 WOMAC 评分 ( 40.2±14.5 ) 与血清 TNF-α、关节滑膜液 TNF-α 以及血清 MMP-13水平差异无统计学意义 ( P>0.05 )。关节滑膜液MMP-13 水平与术前 WOMAC 评分差异无统计学意义( r=0.211,P>0.05 ),但与术后 WOMAC 评分差异有统计学意义 ( r=0.321,P<0.05 ),( 表3 )。
表3 术前和-术后膝关节 WOMAC 指数与 TNF-α、MMP-13 水平的相关性 (, n = 42 )Tab.3 Pre- and postoperative WOMAC index knee f-unction scores and their correlation with TNF-α and MMP-13 levels (, n = 42 )
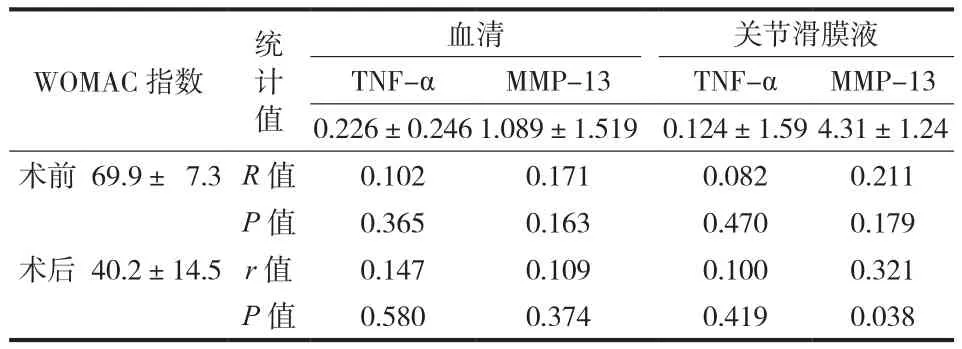
表3 术前和-术后膝关节 WOMAC 指数与 TNF-α、MMP-13 水平的相关性 (, n = 42 )Tab.3 Pre- and postoperative WOMAC index knee f-unction scores and their correlation with TNF-α and MMP-13 levels (, n = 42 )
WOMAC 指数统计值血清 关节滑膜液TNF-α MMP-13 TNF-α MMP-13 0.226±0.2461.089±1.519 0.124±1.594.31±1.24术前 69.9± 7.3R 值 0.102 0.171 0.082 0.211 P 值 0.365 0.163 0.470 0.179术后 40.2±14.5 r 值 0.147 0.109 0.100 0.321 P 值 0.580 0.374 0.419 0.038
讨 论
有研究表明,骨关节炎患者关节结构的改变是机械因素和生化途径相互作用的结果[1,3,9]。实验研究表明,骨性关节炎会引发持续的炎症反应并导致一系列物质的合成与分解[9]。最近的报道指出一些特异性的介质如 MMP-13、MMP-3、IL-1β,IFN-γ和 TNF-α 可用于解释骨关节炎发生的病理机制,同时这些因子可能是检测疾病程度的潜在指标[10]。另外,一种取自骨性关节炎患者滑膜的人滑膜细胞培养模型显示,炎性反应和破坏性反应是 IL-1 和TNF-α 联合驱动的结果[11]。
包括肥胖、昼夜节律、饮食、药物、样品的收集与储存、收集时间点、创伤和性别等在内的一些变量都可以影响炎性因子的水平[9,12]。本研究参考以上因素制订统一的标准对患者进行选择并对样本进行收集。本研究结果显示,可以在骨关节炎患者的关节滑液和血清中检测到 IL-1 和 TNF-α 水平,并且这些滑膜软骨细胞衍生因子的水平随疾病等级的不同而不同。一项对 10 例早期和 15 例晚期骨关节炎患者的研究显示,该疾病的早期和晚期表现出不同程度的炎症。特别是在晚期阶段,CD4+ T 细胞的浸润会导致促炎因子 TNF-α 和 IL-1β 的高表达[13]。Aktas 等[14]的研究指出,MMPs 对晚期骨关节炎的炎症进程与关节损伤至关重要,用羟甲基戊二酰辅酶A ( HMG-CoA ) 还原酶抑制剂阻断 MMPs 具有软骨保护和减缓疾病进展的作用。
本研究结果显示,随着骨关节炎级别的增加,TNF-α 的血清水平是升高的,而 MMP-13 的关节滑膜液水平也是升高的,这表明在骨关节炎的进展过程中,局部和全身的炎症反应是同时发生的。动物研究显示骨关节炎组的 TNF-α 和 MMP-13 水平要高于对照组[15]。绝大多数 1~2 级骨关节炎患者均采取保守治疗,血清和滑膜液样品的收集不能统一实现[16]。因此,本研究没有对 1~2 级与 3~4 级骨关节炎患者的 TNF-α 与 MMP-13 水平进行比较。3 级与 4 级骨关节炎患者的血清 TNF-α 水平均高于关节滑膜液,提示这两个阶段发生持续的系统性炎症反应。4 级骨关节炎患者关节滑膜液 MMP-13 水平和3 级骨关节炎患者血清 MMP-13 水平的升高表明该途径在全身和局部是同步发生的。4 级骨关节炎患者的血清 TNF-α 水平高于 3 级骨关节炎患者,3 级骨关节炎患者的关节滑膜液 TNF-α 水平高于 4 级骨关节炎患者,表明这些促炎因子在早期阶段局部升高,而在晚期则会系统性升高。因此,早期针对局部关节的抗炎治疗应该是有效的,而晚期的治疗则需全身给药。Rutgers 等认为只有静脉注射联合关节内注射 TNF-α 抑制剂才能有效保护软骨代谢[17-18]。与此相反,本研究结果显示发现血清和关节滑膜液中的 TNF-α 水平与术前及术后 WOMAC 指数差异无统计学意义,提示 TNF-α 不是惟一影响膝关节功能的因子。关节滑膜液 MMP-13 与骨关节炎的等级和术后 WOMAC 指数正相关,提示 MMP-13 可能是局部促进骨关节炎进展的一个重要因素。
综上所述,骨关节炎的系统性炎症与 TNF-α 水平相关,血清 TNF-α 水平与骨关节炎的等级也是一致的,但 TNF-α 对骨关节炎和膝关节功能并没有重大影响。随着骨关节炎病情的发展,关节滑膜液MMP-13 和血清 TNF-α 水平明显增加。关节滑膜液MMP-13 水平与 WOMAC 评分正相关。因此,在骨关节炎的早期阶段针对局部 MMP-13 与全身 TNF-α的检测与治疗至关重要。
[1] Atik OS. Is subchondral bone the crucial point for the pathogenesis and the treatment of osteoarthritis[J]? Eklem Hastalik Cerrahisi, 2014, 25(1):1.
[2] Atik OS, Tokgöz N. Do periarticular dense bone islands cause cartilage destruction[J]? Eklem Hastalik Cerrahisi, 2013, 24(1):39-40.
[3] Nishimura A, Hasegawa M, Kato K, et al. Risk factors for the incidence and progression of radiographic osteoarthritis of the knee among Japanese[J]. Int Orthop, 2011, 35(6):839-843.
[4] Miller RE, Miller RJ, Malfait AM. Osteoarthritis joint pain: the cytokine connection[J]. Cytokine, 2014, 70(2):185-193.
[5] MacFarlane RJ, Graham SM, Davies PS, et al. Antiinflammatory role and immunomodulation of mesenchymal stem cells in systemic joint diseases: potential for treatment[J]. Expert Opin Ther Targets, 2013, 17(3):243-254.
[6] Wang W, Kang W, Tang Q, et al. Cilostazol prevents the degradation of collagen type II in human chondrocytes[J]. Biochem Biophys Res Commun, 2014, 451(3):352-355.
[7] Alaaeddine N, Hilal G, Baddoura R, et al. CCL20 stimulates proinflammatory mediator synthesis in human fibroblast-like synoviocytes through a MAP kinase-dependent process with transcriptional and posttranscriptional control[J]. J Rheumatol, 2011, 38(9):1858-1865.
[8] Hermann J, Lipp RW, Dunzinger A, et al. Anti-TNF scintigraphy to assess TNF-α-associated joint inflammation in rheumatoid arthritis and osteoarthritis[J]. Clin Exp Rheumatol, 2014, 32(4):614.
[9] 李冰, 刘军, 肖瑜, 等. 促炎症因子与骨性关节炎关系的研究进展[J]. 天津医药, 2016, 44(3):281-285.
[10] Santangelo KS, Nuovo GJ, Bertone AL. In vivo reduction or blockade of interleukin-1β in primary osteoarthritis influences expression of mediators implicated in pathogenesis[J]. Osteoarthritis Cartilage, 2012, 20(12):1610-1618.
[11] 李冠, 甘丽娇, 钟妙荣. TNF-α 与 β1,4-GalT-I 在骨关节炎滑膜炎症过程中的关系研究[J]. 临床和实验医学杂志, 2016, (2):137-139.
[12] 谷艳超, 刘世清, 夏韶强, 等. 骨关节炎发病机制和治疗的研究进展[J]. 中国骨与关节杂志, 2016, 5(10):770-774.
[13] Benito MJ, Veale DJ, FitzGerald O, et al. Synovial tissue inflammation in early and late osteoarthritis[J]. Ann Rheum Dis, 2005, 64(9):1263-1267.
[14] Aktas E, Sener E, Gocun PU. Mechanically induced experimental knee osteoarthritis benefits from anti-inflammatory and immunomodulatory properties of simvastatin via inhibition of matrix metalloproteinase-3[J]. Orthop Trauma, 2011, 12(3):145-151.
[15] Yang Q, Wu S, Mao X, et al. Inhibition effect of curcumin on TNF-alpha and MMP-13 expression induced by advanced glycation end products in chondrocytes[J]. Pharmacology, 2013, 91(1-2):77-85.
[16] 任海亮, 马剑雄, 马信龙. 膝骨关节炎时关节滑液中炎症相关物质的表达[J]. 中国组织工程研究, 2015, 19(15):2336-2340.
[17] Rutgers M, Saris DB, Dhert WJ, et al. Cytokine profile of autologous conditioned serum for treatment of osteoarthritis, in vitro effects on cartilage metabolism and intra-articular levels after injection[J]. Arthritis Res Ther, 2010, 12(3):114.
[18] Zhang X, Zhu Y, Chen X, et al. Baicalein ameliorates inflammatory-related apoptotic and catabolic phenotypes in human chondrocytes[J]. Int Immunopharmacol, 2014, 21(2): 301-308.
( 本文编辑:李贵存 )
Variation and clinical significance of serum and knee synovial fluid matrix metalloproteinase-13 and tumor necrosis factor-alpha levels in patients with late-stage osteoarthritis
FU Wei-guang, XU Li-xin. Department of Orthopedics, No. 215 Hospital of Shaanxi Nuclear Industry, Xianyang, Shanxi, 712000, China
Objective To compare serum and synovial fluid levels of matrix metalloproteinase-13 ( MMP-13 ) and tumor necrosis factor-alpha ( TNF-α ) in 2 stages of osteoarthritis, and to investigate their correlation with Western Ontario and McMaster Universities Arthritis Index ( WOMAC ) scores. Methods Forty-two patients ( mean age: 64 ± 8.8 years ) with grade 3 or grade 4 knee osteoarthritis according to Kellgren-Lawrence criteria in our hospital from September 2015 to April 2016 were enrolled in the study and underwent total knee arthroplasty. TNF-α and MMP-13 levels were measured preoperatively from venous blood samples and intraoperatively from knee synovial fluid via enzyme-linked immunosorbent assay. Preoperative and 1-month postoperative knee functions were assessed by WOMAC. Results Mean serum TNF-α ( 0.226 ± 0.246 ) pg / ml was elevated compared to synovial levels ( 0.124 ± 1.59 ) pg / ml ( P < 0.05 ) and synovial MMP-13 ( 4.31 ± 1.24 ) pg / ml was elevated compared to serum levels ( 1.089 ± 1.519 ) pg / ml ( P < 0.05 ). Grade 4 synovial fluid MMP-13 ( 5.76 ± 4.82 ) pg / ml was significantly elevated compared to grade 3 ( 2.95 ± 2.45 ) pg / ml ( P < 0.05 ), whereas there was no significant difference in serum MMP-13 between grade 3 ( 1.128 ± 0.308 ) pg / ml and grade 4 ( 1.038 ± 0.204 ) pg / ml ( P > 0.05 ). Grade 4 serum TNF-α ( 0.293 ± 0.140 ) pg / ml was significantly elevated compared to grade 3 ( 0.204 ± 0.109 ) pg / ml ( P < 0.05 ), whereas there was no significant difference in synovial fluid TNF-α between grade 3 ( 0.129 ± 0.052 ) pg / ml and grade 4 ( 0.118 ± 0.014 ) pg / ml. Positive correlation was observed between synovial fluid MMP-13 levels and postoperative WOMAC scores ( P < 0.05 ). Conclusions Despite the systemic increase in TNF-α levels concordant with osteoarthritis grade, MMP-13 levels are elevated via local manner, with a significant correlation with WOMAC scores.
Osteoarthritis, knee; Matrix metalloproteinase 13; Tumor necrosis factor-alpha; Knee joint
10.3969/j.issn.2095-252X.2017.04.010
R684.3, Q51
712000 咸阳,陕西省核工业 215 医院
2016-07-29 )

