脂多糖对胰腺星状细胞Smad和ERK1/2信号通路相关蛋白表达的影响
张青 陈凯 卢美丽 许威 向晓辉 夏时海 冀润利
·论著·
脂多糖对胰腺星状细胞Smad和ERK1/2信号通路相关蛋白表达的影响
张青 陈凯 卢美丽 许威 向晓辉 夏时海 冀润利
目的 探讨脂多糖(LPS)干预对胰腺星状细胞(PSC)Smad和ERK1/2信号通路相关蛋白表达的影响。方法 体外培养大鼠PSC细胞株LTC-14,用不同浓度LPS和不同时间干预LTC-14细胞,采用蛋白质印迹法检测细胞Smad、ERK1/2通路相关蛋白以及α-平滑肌肌动(α-SMA)蛋白的表达。结果 0、1、5、10、20、50 mg/L LPS干预LTC-14细胞后,Smad3的蛋白表达量分别为0.15±0.02、0.37±0.02、0.44±0.01、0.46±0.02、0.37±0.01、0.24±0.03,Smad7蛋白表达量分别为0.79±0.05、0.84±0.02、0.55±0.03、0.45±0.03、0.34±0.02、0.92±0.07,p-ERK1/2蛋白表达量分别为0.48±0.05、0.74±0.03、0.72±0.04、0.89±0.02、0.81±0.02、0.72±0.03,p-cPLA2蛋白表达量分别为0.15±0.03、0.30±0.01、0.31±0.01、0.30±0.02、0.28±0.03、0.32±0.02,α-SMA蛋白表达量分别为0.56±0.06、0.62±0.06、0.54±0.04、1.03±0.11、1.39±0.08、1.28±0.10,均在LPS干预后发生显著变化(P值均<0.01);ERK1/2蛋白表达量分别为0.56±0.03、0.57±0.02、0.53±0.02、0.58±0.02、0.59±0.05、0.55±0.04,未随着LPS浓度的升高而发生显著变化。10 mg/L LPS干预0、1、3、6、9 h后,LTC-14细胞Smad3蛋白表达量分别为0.69±0.05、0.68±0.07、1.02±0.14、1.82±0.06、2.04±0.11,Smad7蛋白表达量分别为2.77±0.10、1.37±0.08、1.45±0.14、0.78±0.09、0.63±0.06,p-ERK1/2蛋白表达量分别为0.16±0.03、0.32±0.05、0.79±0.03、1.50±0.07、1.77±0.04, p-cPLA2蛋白表达量分别为0.15±0.04、0.32±0.06、0.63±0.04、0.95±0.04、1.49±0.10,α-SMA的蛋白表达量分别为0.84±0.03、1.26±0.21、1.81±0.19、4.28±0.26、4.37±0.15,均随着LPS干预时间的延长而发生显著变化(P值均<0.05或<0.01);ERK1/2蛋白表达量分别为0.75±0.03、0.72±0.02、0.80±0.04、0.74±0.03、0.85±0.09,不随LPS干预时间的延长而发生显著变化。结论 LPS呈时间-剂量依赖性上调α-SMA表达,并激活胞内Smad和ERK1/2炎症通路,这可能是CP发生的分子机制之一。
胰腺; 脂多糖类; 星型细胞; 信号传导
慢性胰腺炎(CP)是由多种原因所致的胰腺实质内腺泡和胰管的反复或持续性损伤,引起腺泡和胰岛细胞萎缩或消失,最终被纤维组织代替。CP临床表现多样,早期不易诊断。近年来大量研究显示CP患者胰腺星状细胞(pancreatic stellate cell, PSC)的活化程度与胰腺组织纤维化程度呈正相关, PSC 在胰腺慢性纤维化的进程中具有重要作用,是各种诱因作用的靶点,也是导致CP 纤维化的重要物质基础[1]。在CP起因的众多假说中,肠道屏障破坏造成的细菌易位、反复的炎症刺激是CP的主要成因之一。脂多糖(lipopolysaccharide, LPS)是细菌细胞壁的主要成分,也是主要的致炎因素,可以通过TGF-β1通路诱导多器官的炎症反应[2-3]。大鼠PSC中TGF-β1的分泌依赖于Smad和ERK1/2信号通路[4]。Smad3表达升高与PSC的激活有关[5],而Smad7高表达的小鼠,胰腺纤维化程度减轻[6];p-ERK1/2表达升高可以激活PSC[7],胞质型磷脂酶 A2(cytosolic phospholipase A2,cPLA2)作为ERK1/2通路的下游分子,是炎症反应的关键酶,在多种炎症反应中发挥作用[8]。由此推测LPS诱导PSC活化所发生的炎症反应可能有Smad和ERK1/2信号通路的参与。本研究应用LPS刺激PSC,观察其对Smad和ERK1/2信号通路相关蛋白表达的影响,探讨CP发生的分子机制。
材料和方法
一、细胞株及试剂
LTC-14细胞株是从大鼠胰腺分离出来的PSC,由德国Rostock大学医学院Robert Jaster教授惠赠[9];胎牛血清购自Gibco公司;青链霉素混合液购自Solarbio公司;IMDM培养基购自HyClone公司;LPS购自Sigma公司;胰酶消化液购自Gibco公司; ERK、β-actin单克隆一抗购自Proteintech公司; Smad3、Smad7抗体购自Abcam公司;p-ERK、p-cPLA2抗体购自Sigma公司;DMSO购自Sigma公司;BCA蛋白定量试剂盒购自北京碧云天生物技术有限责任公司;PVDF膜购自BD公司;蛋白Marker购自Solarbio公司;ECL发光液购自碧云天公司;显影胶片购自柯达公司;显影粉和定影粉购自天津世纪奥博公司。
二、细胞培养及分组
LTC-14细胞复苏后常规培养、传代。取对数生长期LTC-14细胞,待细胞70%融合时更换无血清培养液,分别加入0、1、5、10、20、50 mg/L LPS干预3 h,弃培养液,加入RIPA裂解液裂解细胞,提取蛋白;另取对数生长期LTC-14细胞,待细胞70%融合时更换无血清培养基,加入10 mg/L LPS分别干预0、1、3、6、9 h,弃去培养基,加入RIPA裂解液裂解细胞,提取蛋白。
三、蛋白质印迹法检测细胞相关通路的蛋白表达
取上述提取的蛋白,BCA定量后常规行蛋白质印迹法检测细胞α-SMA、Smad3、Smad7、p-ERK1/2、ERK、p-cPLA2蛋白表达,一抗工作浓度均为1∶1 000,内参GAPDH工作浓度为1∶5 000, HRP标记的二抗工作浓度为1∶5 000,最后用ECL化学发光显影。
四、统计学处理

结 果
一、LPS干预对LTC-14细胞 Smad3、Smad7表达的影响
LPS干预后LTC-14细胞Smad3蛋白表达量先随LPS剂量的增加而增加,在10 mg/L时达峰值,其后又逐渐下降;Smad7蛋白表达量先随LPS剂量增加而下降,在20 mg/L时达最低值,50 mg/L时又显著升高(表1,图1A)。LTC-14细胞Smad3蛋白表达量随10 μg/ml LPS干预时间的延长而增加;Smad7蛋白表达量随LPS干预时间的延长而减少(表2,图1B)。
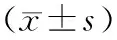
表1 不同浓度LPS干预后LTC-14细胞Smad3、Smad7蛋白表达量的变化
注:与0 mg/L组比较,aP<0.01
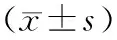
表2 10 mg/L LPS干预不同时间后LTC-14细胞Smad3、Smad7蛋白表达量的变化
注:与0 h组比较,aP<0.01

图1 0、1、5、10、20、50 mg/L LPS干预3 h后(1A)及10 mg/L LPS干预0、1、3、6、9 h后(1B) LTC-14细胞Smad3、Smad7蛋白的表达
二、LPS干预对LTC-14细胞ERK1/2信号通路的影响
LPS干预后LTC-14细胞p-ERK1/2、p-cPLA2蛋白表达量增加;而LPS干预对ERK1/2蛋白表达没有影响(表3,图2A)。10 mg/L LPS干预后LTC-14细胞p-ERK1/2、p-cPLA2蛋白表达量随干预时间的延长而增加,在9 h时达峰值;而干预时间的延长对ERK1/2的表达没有影响(表4,图2B)。
三、LPS干预对LTC-14细胞α-SMA表达的影响
0、1、5、10、20、50 mg/L LPS干预后LTC-14细胞α-SMA蛋白表达量分别为0.56±0.06、0.62±0.06、0.54±0.04、1.03±0.11、1.39±0.08、1.28±0.10,≥10 mg/L LPS干预后LTC-14细胞α-SMA蛋白表达量显著高于未干预细胞,差异均有统计学意义(P值均<0.01,图3A)。
10 μg/ml LPS干预0、1、3、6、9 h后LTC-14细胞α-SMA蛋白表达量分别为0.84±0.03、1.26±0.21、1.81±0.19、4.28±0.26、4.37±0.15,随干预时间的延长逐渐升高,6 h时达峰值(图3B),干预时间≥3 h时的表达量显著高于未干预细胞,差异均有统计学意义(P值均<0.01)。
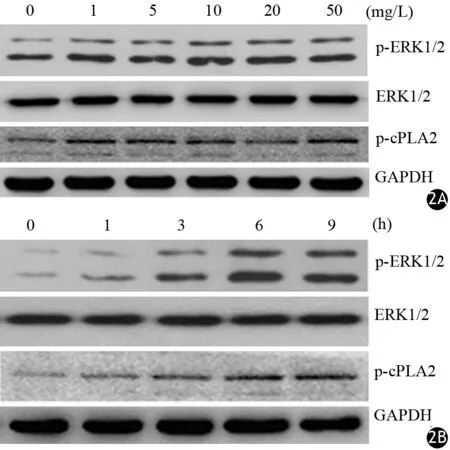
图2 0、1、5、10、20、50 mg/L LPS干预3 h后(2A)及10 mg/L LPS干预0、1、3、6、9 h后(2B ) LTC-14细胞 p-ERK1/2、ERK1/2、p-cPLA2蛋白的表达
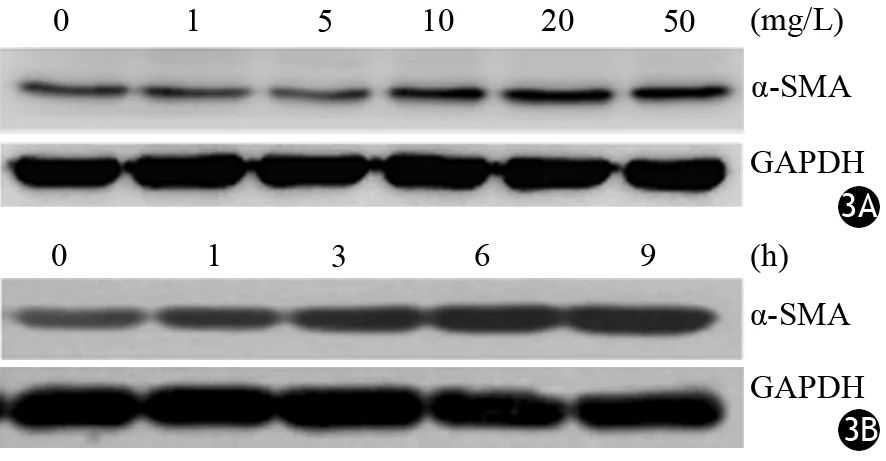
图3 0、1、5、10、20、50 μg/ml LPS干预3 h后(3A)及10 μg/ml LPS干预0、1、3、6、9 h后(3B) LTC-14细胞α-SMA蛋白的表达
CP的临床表现主要为腹痛、脂肪泻和糖尿病,严重影响患者的生活质量[10]。CP确诊后20~25年的病死率为50%,并有4%的患者可发展为胰腺癌[11]。然而由于其发病机制尚不明确,目前尚无针对CP的有效药物,因此研究CP的发病机制迫在眉睫。
肠道细菌易位学说是解释胰腺炎发病机制的理论之一,该学说认为,正常情况下肠道内的细菌由于
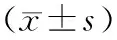
表3 不同LPS浓度干预后LTC-14细胞ERK1/2通路相关蛋白表达量的变化
注:与0 mg/L组比较,aP<0.01
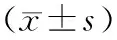
表4 10 mg/L LPS干预不同时间后LTC-14细胞ERK1/2通路相关蛋白表达量的变化
注:与0 h组比较,aP<0.05,bP<0.01
受到肠黏膜屏障的阻碍而难以易位到肠外组织,但在细菌过度生长、肠黏膜破坏的情况下,细菌可突破肠黏膜屏障而发生易位,易位的细菌除本身刺激细胞产生致炎因子外,革兰阴性细菌死亡或被吞噬后释放LPS进一步刺激机体免疫系统产生大量炎性因子,最终引发多脏器损伤[12]。
LPS引起的炎症反应有TGF-β1信号通路的参与。作为TGF-β1的核心信号通路,Smad通路与LPS引起的炎症反应关系密切[2-3]。大量研究表明,Smad通路在CP纤维化进程中也发挥重要作用[5-6],但其在细菌易位方面的研究还未见报道。为此,本研究用LPS模拟肠道细菌突破肠黏膜屏障,采用不同LPS浓度及不同时间干预LTC-14细胞。结果显示,随着LPS刺激浓度的增加,Smad3表达逐渐升高,在10 mg/L时达峰值,其后逐渐降低;而Smad7蛋白的变化正好与其相反,LPS作用拐点的出现可能与高剂量LPS诱发了胞内的其他应激反应有关。而随着LPS干预时间的延长,Smad3表达逐渐升高,Smad7表达逐渐降低,表明Smad通路被持续活化,且活化程度不断提高。提示当有适量的细菌反复刺激时,胰腺产生的炎症反应会逐渐增强,这与细菌易位假说相呼应,可能是CP发生的病理基础。
细胞外信号调节激酶(ERK)为丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的主要成员,至少包括ERK1和ERK2两个亚型。ERK通路参与应激、细菌产物和炎症递质等引起的细胞反应。研究证实,用细胞因子干预大鼠PSC可激活ERK通路,增加CX3CL1的释放;而阻断ERK1/2通路可抑制CX3CL1的分泌,表明PSC通过ERK1/2通路促进CP的发生[7]。在大鼠雪旺细胞实验中,LPS可以显著激活ERK1/2通路,进而诱导TNF-α的产生[13]。最近研究发现,LPS触发的炎性环境可抑制BMP-9的表达,并激活ERK1/2信号通路[14]。cPLA2作为ERK1/2通路的下游分子,是炎症反应的关键酶,cPLA2水解胞膜磷脂酸释放花生四烯酸(arachidonic acid,AA),AA 在环氧化酶2(cycloxygenase,COX)和脂氧化酶(lypoxygenase,LOX)进一步催化下生成前列腺素、 血栓素、白三烯以及ROS等物质,广泛参与炎症反应与氧化应激过程[8]。本研究结果显示,LPS干预PSC后可上调p-ERK1/2及其下游分子p-cPLA2的表达,并随着LPS干预时间的延长而逐渐升高;然而LPS干预并不影响ERK1/2蛋白的表达,表明LPS对ERK1/2通路的激活仅起到一个类似分子开关的作用,但激活程度不随LPS浓度的增加而变化,而是随着LPS干预时间的延长逐渐加大,与Smad通路效果类似。
PSC的活化在CP的发生和发展过程中起着关键的作用,PSC活化所致的胰腺慢性纤维化是CP和胰腺癌共同的病理经过,活化的PSC已经有望成为CP和胰腺癌治疗的一个新靶标[15-16]。有研究证明,Smad通路和ERK1/2通路都参与PSC的活化。在二丁基二氯化物(dibutyltin dichloride,DBTC)所致的大鼠CP中,Smad7表达显著降低,同时TGF-β1和α-SMA表达明显升高,PSC被广泛激活[17]。最近研究发现,ERK1蛋白在PSC的活化中发挥重要作用[18],而α-SMA 表达是PSC激活的标志[19]。为了更直接地反映LPS对PSC的影响,本研究同样检测了α-SMA的表达变化。结果显示,低剂量LPS干预对PSC的α-SMA表达没有影响,中剂量LPS干预使α-SMA的表达逐渐升高,而高剂量LPS干预后α-SMA的表达未继续增加,表明中剂量LPS干预才能活化PSC,且随着LPS干预时间的延长而逐渐增加,与胰腺Smad通路和ERK1/2通路的效果类似。由此推测,PSC中LPS所致α-SMA的表达变化可能是通过Smad通路和ERK1/2通路实现的。
[1] Masamune A, Watanabe T, Kikuta K, et al. Roles of pancreatic stellate cells in pancreatic inflammation and fibrosis[J]. Clin Gastroenterol Hepatol, 2009,7(11 Suppl):S48-S54. DOI: 10.1016/j.cgh.2009.07.038.
[2] 郦佳慧, 吕开阳, 李恒宇, 等. LPS诱导的肝脏急性期反应在Smad3基因敲除小鼠中被抑制[C]. 中华医学会烧伤外科学分会2009年学术年会论文集,2009:83-84.
[3] Mu E, Ding R, An X, et al. Heparin attenuates lipopolysaccharide-induced acute lung injury by inhibiting nitric oxide synthase and TGF-β/Smad signaling pathway[J].Thromb Res,2012,129(4):479-485. DOI: 10.1016/j.thromres.2011.10.003.
[4] Aoki H, Ohnishi H, Hama K, et al. Autocrine loop between TGF-beta1 and IL-1beta through Smad3- and ERK-dependent pathways in rat pancreatic stellate cells[J]. Am J Physiol Cell Physiol, 2006,290(4):C1100-C1108. DOI: 10.1152/ajpcell.00465.2005.
[5] 陈凯, 荣亚梅, 曹卫丽, 等. 氧化苦参碱对TGF-β1刺激的胰腺星状细胞Smad通路相关因子表达的影响[J].世界华人消化杂志,2015,23(12):1883-1889.
[6] He J, Sun X, Qian KQ, et al. Protection of cerulein-induced pancreatic fibrosis by pancreas-specific expression of Smad7[J]. Biochim Biophys Acta, 2009,1792(1):56-60. DOI: 10.1016/j.bbadis.2008.10.010.
[7] Uchida M, Ito T, Nakamura T, et al. ERK pathway and sheddases play an essential role in ethanol-induced CX3CL1 release in pancreatic stellate cells[J]. Lab Invest, 2013,93(1):41-53. DOI: 10.1038/labinvest.2012.156.
[8] Hu R, Zhou J, Luo C, et al. Glial scar and neuroregeneration: histological, functional, and magnetic resonance imaging analysis in chronic spinal cord injury[J]. J Neurosurg Spine, 2010,13(2):169-180. DOI: 10.3171/2010.3.SPINE09190.
[9] Tsang SW, Zhang H, Lin C, et al. Rhein, a natural anthraquinone derivative, attenuates the activation of pancreatic stellate cells and ameliorates pancreatic fibrosis in mice with experimental chronic pancreatitis[J]. PLoS One, 2013,8(12):e82201. DOI: 10.1371/journal.pone.0082201.
[10] Zhang SK, Tsui NC, Li DH, et al. Expression of transforming growth factor beta1/Sma- and Mad-related proteins in rat with chronic pancreatitis induced by dibutyltin dichloride[J]. Pancreas, 2010,39(2):252-253. DOI: 10.1097/MPA.0b013e3181baeef2.
[11] Shimosegawa T, Kume K, Satoh K. Chronic pancreatitis and pancreatic cancer: prediction and mechanism[J]. Clin Gastroenterol Hepatol, 2009,7(11 Suppl):S23-S28. DOI: 10.1016/j.cgh.2009.07.042.
[12] Moody FG, Haley-Russell D, Muncy DM. Intestinal transit and bacterial translocation in obstructive pancreatitis[J]. Dig Dis Sci, 1995,40(8):1798-1804.
[13] 邵晓轶, 秦永伟, 王海波, 等. ERK在LPS诱导大鼠雪旺氏细胞TNF-α表达中的作用[J].中华微生物学和免疫学杂志,2007,27(6):485-489. DOI: 10.3760/j:issn:0254-5101.2007.06.001.
[14] Daigang L, Jining Q, Jinlai L, et al. LPS-stimulated inflammation inhibits BMP-9-induced osteoblastic differentiation through crosstalk between BMP/MAPK and Smad signaling[J]. Exp Cell Res, 2016,341(1):54-60. DOI: 10.1016/j.yexcr.2016.01.009.
[15] Algül H, Treiber M, Lesina M, et al. Mechanisms of disease: chronic inflammation and cancer in the pancreas-a potential role for pancreatic stellate cells?[J]. Nat Clin Pract Gastroenterol Hepatol, 2007, 4(8): 454-462. DOI: 10.1038/ncpgasthep 0881.
[16] Watari N, Hotta Y, Mabuchi Y. Morphological studies on a vitamin A-storing cell and its complex with macrophage observed in mouse pancreatic tissues following excess vitamin A administration[J]. Okajimas Folia Anat Jpn, 1982,58(4-6):837-858.
[17] Hou XJ, Jin ZD, Jiang F, et al. Expression of Smad7 and Smad ubiquitin regulatory factor 2 in a rat model of chronic pancreatitis[J]. J Dig Dis, 2015,16(7):408-415. DOI: 10.1111/1751-2980.12253.
[18] Yuantai W, Tiancai W, Qiu Z. PD98059 inhibits expression of pERK1 protein and collagen alpha1(I) mRNA in rat pancreatic stellate cells activated by platelet-derived growth factor[J]. Indian J Gastroenterol, 2005,24(3):100-103.
[19] 王兴鹏, 张汝玲, 龚自华, 等. 胰腺星状细胞在大鼠胰腺纤维化形成中的作用[J].中华消化杂志,2003,23(8):466-469.DOI:10.3760.j.issn:0254-1432.2003.08.005.
(本文编辑:屠振兴)
The influence of LPS on the protein expression of related molecules in Smads and ERK1/2 signal pathway in LTC-14 cells
ZhangQing,ChenKai,LuMeili,XuWei,XiangXiaohui,XiaShihai,JiRunli.
DepartmentofGastrointerology,TianjinXiqingHospital,Tianjin300162,China
Objective To explore the influence of LPS treatment on related molecules in Smads and ERK1/2 signal pathway in pancreatic stellate cell line LTC-14. Methods LTC-14 cells were cultured in vitro, and were treated with LPS at different dose in different time points. Protein expressions of related molecules in Smads pathway and ERK1/2 pathway and α-SMA in LTC-14 Cells were examined by Western blot. Results On Treated LTC-14 cells by 0, 1, 5, 10, 20 and 50 mg/L LPS,protein expressions of Smad3 were 0.15±0.02, 0.37±0.02, 0.44±0.01, 0.46±0.02, 0.372±0.01 and 0.24±0.03; expressions of Smad7 were 0.79±0.05, 0.84±0.02, 0.55±0.03, 0.45±0.03, 0.34±0.02 and 0.92±0.07; p-ERK1/2 levels were 0.48±0.05, 0.74±0.03, 0.72±0.04, 0.89±0.02, 0.81±0.02 and 0.72±0.03; p-cPLA2 levels were 0.15±0.03, 0.30±0.01, 0.31±0.01, 0.30±0.02, 0.28±0.03 and 0.32±0.02; α-SMA levels were 0.56±0.06, 0.62±0.06, 0.54±0.04, 1.03±0.11, 1.39±0.08 and 1.28±0.10. The changes of protein expressions before and after LPS treatment were obvious (allP<0.01). The protein expressions of ERK1/2 were 0.56±0.03, 0.57±0.02, 0.53±0.02, 0.58±0.02, 0.59±0.05 and 0.55±0.04, which did not change obviously along with increased LPS dosages. LTC-14 cells treated with 10 mg/L LPS for 0, 1, 3, 6 and 9 h,the expressions of Smad3 were 0.69±0.05, 0.68±0.07, 1.02±0.14, 1.82±0.0 and 2.04±0.11,those of Smad7 were 2.77±0.10, 1.37±0.08, 1.45±0.14, 0.78±0.09 and 0.63±0.06,those of p-ERK1/2 were 0.16±0.03, 0.32±0.05, 0.79±0.03, 1.50±0.07 and 1.77±0.04,those of p-cPLA2 were 0.15±0.04, 0.32±0.06, 0.63±0.04, 0.95±0.04 and 1.49±0.10,those of α-SMA were 0.84±0.03, 1.26±0.21, 1.81±0.19, 4.28±0.26 and 4.37±0.15, all of which changed obviously as the treatment time increased (P<0.05 or 0.01). The expressions of ERK1/2 were 0.75±0.03, 0.72±0.02, 0.80±0.04, 0.74±0.03 and 0.85±0.09, which did not change obviously as the treatment time increased. Conclusions LPS could upregulate the expression of α-SMA in a time- and dose-dependent way, and activate intracellular Smads and ERK1/2 inflammatory pathways, which may be the potential molecular mechanism of the development of chronic pancreatitis.
Pancreas; Lipopolysaccharides; Astrocytes; Signal transductionFund program: Subject Foundation of Tianjin Xiqing Hospital(xqlx201401, xqlx201406); Seed-foundation of Affiliated Hospital of Logistics University of PAP(FYM201522); Startup Project of Doctor Scientific Research of Logistics University of PAP(WHB201515)
10.3760/cma.j.issn.1674-1935.2017.02.005
300162 天津,天津市西青医院消化内科(张青);武警后勤学院附属医院消化二科/肝胆胰脾中心(陈凯、卢美丽、许威、向晓辉、夏时海、冀润利)
冀润利, Email: base_19901s@163.com
天津市西青医院院级课题(xqlx201401,xqlx201406);武警后勤学院附属医院种子基金(FYM201522);武警后勤学院博士启动金(WHB201515)
2016-09-06)

