脱氢表雄酮在卵巢储备功能减退患者中的应用研究进展
许晓璐,刘芸
(1.福建中医药大学研究生院,福州 350108;2.南京军区福州总医院妇产科生殖中心,福州 350001)
脱氢表雄酮在卵巢储备功能减退患者中的应用研究进展
许晓璐1,刘芸2*
(1.福建中医药大学研究生院,福州 350108;2.南京军区福州总医院妇产科生殖中心,福州 350001)
卵巢储备功能减退(DOR)、卵巢低反应(POR)是辅助生殖技术(ART)治疗过程中的难点。近年有研究报道,对于辅助生殖技术治疗中卵巢功能减退和卵巢低反应的妇女通过各种类型雄激素包括睾酮和脱氢表雄酮(DHEA)补充的预治疗可增加获卵数,改善胚胎质量,提高妊娠率和活产率,但有部分研究持反对意见,认为添加雄激素未能改善卵巢储备功能减退患者体外受精治疗的结局。本文对近年来DHEA在DOR患者中的应用研究进展做一个综述。
辅助生殖技术; 卵巢储备功能减退; 卵巢低反应; 脱氢表雄酮
(JReprodMed2017,26(4):382-386)
妇女延迟生育成为人口的发展趋势,寻求生育治疗的高龄妇女人数显著增加。年龄>35岁目前是临床上公认的女性生殖衰老的预测指标之一,2015年美国妇产科医师学会(ACOG)新定的“卵巢储备检测”临床实践指南中指出,有生育要求、年龄>35岁,但半年内未孕的女性,是卵巢储备功能减退(DOR)的高危人群,有必要进行积极的卵巢功能检测及采取干预治疗措施[1]。DOR以及控制性促排卵(COH)过程中卵巢低反应(POR),给辅助生殖技术(ART)带来了巨大的挑战。近年有研究报道对于ART治疗中DOR和POR的妇女通过脱氢表雄酮(DHEA)补充的预治疗可改善临床结局,也有部分研究持反对意见,本文对DHEA在DOR患者中的应用研究进展做一综述。
一、卵巢储备功能和卵巢反应性
卵巢储备功能是指卵巢内存留卵泡的数量和质量,反映女性的生育能力。卵巢内存留的可募集卵泡数量减少、卵母细胞质量下降,导致生育能力降低或出现过早绝经的倾向,称为DOR。目前国际上没有一个统一的DOR诊断标准,在进行IVF-ET治疗过程中DOR表现为POR,即COH过程中卵巢对外源性Gn刺激反应低下的病理状态,临床表现为所需Gn剂量增加,获卵数少,卵母细胞质量下降,胚胎着床率低,流产率增加,分娩率下降[2]。2011年欧洲人类生殖和胚胎学会(ESHRE)和美国生殖医学会(ASRM)讨论并制定了一个有关POR的诊断共识即博洛尼亚共识[3]:满足以下3条中的2条即可诊断为POR:(1)高龄(≥40岁)或存在卵巢反应不良的其他危险因素;(2)前次IVF周期卵巢低反应,常规方案获卵数≤3个;(3)卵巢储备下降[窦卵泡计数(AFC)<5~7个或抗苗勒氏管激素(AMH)<0.5~1.1 mg/L]。研究报道雄激素缺乏是DOR的表现之一[4],使用雄激素(A)预处理有利于患者助孕治疗结局的改善,近年来应用DHEA预处理DOR患者逐渐受到关注。
二、DHEA的生理作用
DHEA是人体血循环中含量最丰富的甾体物质,是甾体激素合成必需的底物,成年女性DHEA 70%~90%来源于肾上腺皮质网状带,10%~30%来自卵巢,大脑中也可合成少部分DHEA[5]。在下丘脑-垂体-肾上腺神经内分泌轴调控下由肾上腺皮质网状带中的细胞色素P450为主酶催化胆固醇合成,DHEA合成后主要以DHEA硫酸酯(DHEA-S)的形式进入血循环中,到达外周靶器官细胞内,在酶的作用下转换为DHEA,后者在类固醇激素代谢酶作用下转化为睾酮、雄烯二酮、雌酮、双氢睾酮和雌二醇进一步发挥作用[6]。类固醇激素合成见图1。大部分雄烯二酮来自DHEA,只有极小的部分来自17α-OH孕酮,所以体内几乎所有雌激素和雄激素均来自DHEA[7]。
类固醇激素代谢酶多存在于内质网中,少数在线粒体中,DHEA转化成类固醇激素大部分在内质网内完成,少数在线粒体内完成[8]。DHEA最早由Butenandt于1931年分离提取出来,其受体尚未明确,但其转化为雄激素或雌激素后通过雄激素受体(AR)或雌激素受体(ER)发挥作用已被证实[9],也有研究表明DHEA可直接作用于AR和ER[10-11]。育龄期女性体内DHEA水平随年龄增长明显下降[12-14],其分泌无负反馈调节机制,当血清DHEA水平降低机体缺乏DHEA时,只有予外源性补充治疗[15-16]。DHEA的生理功能和在卵巢中的作用至今仍未完全阐明,作为雄激素前体,其可提高卵泡内雄激素浓度,后者在卵泡发育过程中起重要作用[17],但具体机制尚不明确。研究表明DHEA在妇科疾病、内分泌疾病、风湿免疫性疾病及皮肤病治疗中有一定应用价值[18]。
三、DHEA在生殖医学中的应用
2012年一项对全球45个国家的196个IVF中心的调查[19]指出,有超过四分之一(25.8%)的生殖中心在进入IVF周期前联合使用DHEA并且有一定的效果。DHEA在美国作为非处方药(OTC)类保健品,在欧洲部分国家只能作为处方药[20],DHEA的安全性、常规口服剂量及使用时间尚未明确。Cochrane数据库2015年收录的一篇研究[21]指出目前仍没有足够证据指导临床常规在DOR患者中应用DHEA。应用DHEA后机体会发生何种变化?结论并未统一。
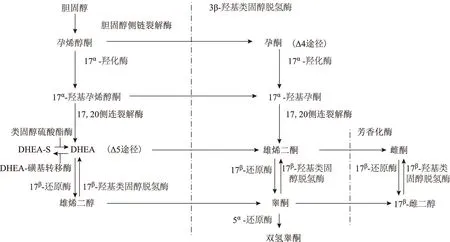
图1 类固醇激素合成示意图
1. 甾体激素水平的变化
根据“双细胞-双促性腺激素”学说,DHEA是甾体激素合成必需的底物[22],如果DHEA异常低下,可导致甾体激素合成不足。理论上DOR患者补充DHEA后甾体激素合成增加,但是机体存在复杂调控机制,具体如何变化仍无定论。Casson等[23]首次报道了使用DHEA后5例POR患者促排周期中雌激素峰值增加2倍,Yeung等[24]对原发性卵巢功能不全(OI)患者进行的研究结果显示DHEA组血清E2,T及DHEA-S水平均显著高于安慰剂组,但是Wiser等[25]对POR患者的RCT研究及安锦霞等[26]对DOR患者的随机对照研究结果显示口服DHEA组与对照组相比血清E2水平无统计学差异。另有Weissman等[27]自身前后对照研究显示服用DHEA后Gn第5天血清P及HCG日血清P均升高,前后周期早晚卵泡期血清P水平无统计学差异,而聂明月等[28]自身前后对照研究显示前后周期HCG日P水平无统计学差异。
2. AMH,AFC,FSH的变化
FSH、AMH及AFC是预测卵巢储备功能的指标,目前认为AMH 结合AFC 是评价卵巢储备功能灵敏度和特异度最好的2个指标[29]。DOR患者应用DHEA后AMH、AFC、FSH是否发生变化?如何变化?变化机制如何?Gleicher等[30]研究结果显示口服DHEA后AMH水平显著提高,升高水平与口服时间呈正相关,年龄<38岁者升高更明显,其中行IVF治疗获妊娠者较未获妊娠者血清AMH增加更显著,作者提出血清AMH水平可作为口服DHEA后预测卵巢储备功能改善及妊娠机会增大的指标。Yeung等[24]研究显示口服DHEA组AFC显著增加,但血清AMH和FSH与对照组比较无统计学差异。胡蓉等[31]自身前后对照研究结果显示DOR患者经DHEA 辅助治疗后AFC显著增加,宋晖等[32]自身前后对照研究显示口服DHEA后FSH值下降,AFC增加,与聂明月等[28]及张平等[33]自身前后对照研究中FSH及AFC变化得出相同结论。
3.Gn总量及Gn天数的变化
临床上DOR患者COH过程中所需Gn总量较大,Gn天数较长,若服用DHEA后卵巢反应性改善,则所需Gn量减少,Gn天数缩短,但是现有研究尚未得出一致结论。安锦霞等[26]、聂明月等[28]及宋晖等[32]研究均提示DHEA组Gn用量有降低趋势,Gn天数有减少趋势,但无统计学差异。董娟等[34]Meta分析结果显示DHEA组与对照组比较Gn总用量减少。
4.获卵数及受精率的变化
DOR或POR患者行IVF/ICSI治疗获卵数少,卵母细胞质量差,受精率低,服用DHEA可否增加获卵数,提高受精率?Casson等[23]研究显示POR患者口服DHEA后周期获卵数增加1倍。Barad等[35]自身对照研究显示DHEA治疗后周期获卵数、受精率较前一周期显著增加,宋晖等[32]研究显示DHEA组与对照组比较获卵数显著增加,受精率呈升高趋势但无统计学差异,与聂明月等[28]及胡蓉等[31]研究结论相似。安锦霞等[26]研究提示DHEA组IVF受精率高于对照组,但是Weissman等[27]研究结果提示成熟卵母细胞(MII)数及获卵数在自身前后对照及DHEA组与对照组之间无统计学差异。
5.胚胎数,优质胚胎率,临床妊娠率,活产率,流产率的变化
Barad等[35]及聂明月等[28]研究提示DOR患者服用DHEA后可移植胚胎数及胚胎评分显著增加。Gleicher等[36]研究采用胚胎植入前遗传学筛查(PGS)方法筛查染色体的研究结果显示DHEA能显著减少胚胎染色体非整倍体的数目和比例,短期应用DHEA(4~12周)降低非整倍体性效应最显著。Wiser等[25]研究显示口服DHEA后胚胎质量有所提高,活产率显著增加。张平等[33]研究提示DHEA提高IVF-ET妊娠率,降低流产率。胡蓉等[31]研究显示口服DHEA后临床妊娠率显著提高,但周期取消率及流产率无统计学差异,与安锦霞等[26]及宋晖等[32]研究结果基本相似。
四、展望
目前面对DOR患者卵母细胞质量差、胚胎质量差的问题临床仍没有很好的解决方法,可喻为不孕症治疗过程中的Cancer,近年来DHEA在生殖领域的应用不断增多,其有效性仍存在争议。从理论上说,应用DHEA有助于DOR患者获卵数的增加,ART治疗过程中应用DHEA预治疗后临床妊娠率似乎未见提高,其是否提高卵母细胞质量以及口服DHEA后机体的变化机制有待进一步研究。随着有生育需求的DOR患者的增加,临床亟需多中心大样本的前瞻性随机对照研究来指导DHEA在DOR患者中的应用。
[1] Committee on Gynecologic Practice. Committee opinion no.618:ovarian reserve testing[J].Obstet Gynecol,2015,125:268-273.
[2] Practice Committee of the American Society for Reoroductive Medicine. Aging and infertility in women[J].Fertil Steril,2006,86(5 Suppl 1):S248-S252.
[3] Ferranretti AP,La Marca A,Fauser BC,et al. ESHRE consensus on the definition of ’poor response’to ovarian stimulation for in vitro fertilization:the Bologna criteria [J].Hum Reprod,2011,26:1616-1624.
[4] Weghofer A,Kim A,Barad DH,et al. The impact of androgen metabolism and FMR1 genotypes on pregnancy potential in women with dehydroepiandrosterone (DHEA) supplementation[J].Hum Reprod;2012,27:3287-3293.
[5] Baulieu EE.Neurosteroids:a novel function of the brain[J].Psychoneuroendocrinology,1998,23:963-987.
[6] Callies F,Arlt W,Siekmann L,et al. Influence of oral dehydroepiandrosterone(DHEA) on urinary steroid metabolites in males and females[J]. Steroids,2000,65:98-102.
[7] Miller WL.Androgen biosynthesis from cholesterol to DHEA[J].Mol Cell Endocrinol,2002,198:7-14.
[8] Miller WL.Androgen synthesis in adrenarche[J].Rev Endocr Metab Disord,2009,10:3-17.
[9] Labrie F,Bélanger A,Luu-The V,et al.DHEA and the intracrine formation of androgens and estrogens in peripheral target tissues:its role during aging[J]. Steroids,1998,63:322-328.
[10] Tan J,Sharief Y,Hamil KG,et al.Dehydroepiandrosterone activates mutant androgen receptors expressed in the androgen-dependent human prostate cancer xenograft CWR22 and LNCaP cells[J].Mol Endocrinol,1997,11:450-459.
[11] Martin C,Ross M,Chapman KE,et al.CYP7B generates a selective estrogen receptor agonist in human prostate[J].J Clin Endocrinol Metab,2004,89:2928-2935.
[12] Vermeulen A,Deslypene JP,Schelfhout W,et al. Adrenocortical function in old age:response to acute adrenocorticotropin stimulation[J].J Clin Endocrinol Metab,1982,54:187-191.
[13] Walker ML,Anderson DC,Herndon JG,et al. Ovarian aging in squirrel monkeys (Saimiri sciureus)[J].Reproduction,2009,138:793-799.
[14] Gleicher N,Barad DH. Dehydroepiandrosterone(DHEA)supplementation in diminished ovarian reserve (DOR)[J].Reprod Biol Endocrinol,2011,9:67.
[15] 施安国.药物对内源性脱氢表雄酮及其磺基衍生物的影响[J].上海医学,2003,26:771-773.
[16] 魏代敏,郁琦.脱氢表雄酮在绝经后妇女中的作用[J].协和医学杂志,2013,4:58-62.
[17] Hyman JH,Margalioth EJ,Rabinowitz R,et al.DHEA supplementation may improve IVF outcome in poor responders:a proposed mechanism[J].Eur J Obstet Gynecol Reprod Biol,2013,168:49-53.
[18] Rutkowski K,Sowa P,Rutkowska-Talipska J,et al.Dehydroepiandrosterone (DHEA):hypes and hopes[J].Drugs,2014,74:1195-1207.
[19] Artini PG,Simi G,Ruggiero M,et al. DHEA supplementation improves follicular microenviroment in poor responder patients[J].Gynecol Endocrinol,2012,28:669-673.
[20] Yakin K,Urman B.DHEA as a miracle drug in the treatment of poor responders;hype or hope?[J].Hum Reprod;2011,26:1941-1944.
[21] Nagels HE,Rishworth JR,Siristatidis CS,et al.Androgens (dehydroepiandrosterone or testosterone) for women undergoing assisted reproduction[J].Cochrane Database Syst Rev,2015,26:CD009749.
[22] McNatty KP,Makris A,Reinhold VN,et al. Metabolism of androstenedione by human ovarian tissues in vitro with particular reference to reductase and aromatase activity[J].Steroids,1979,34:429-443.
[23] Casson PR,Lindsay MS,Pisarska MD,et al. Dehydroepiandrosterone supplementation augments ovarian stimulation in poor responders:a case series[J].Hum Reprod,2000,15:2129-2132.
[24] Yeung TY,Li RW,Lee VC,et al.A randomized double-blinded placebo-controlled trial on the effect of dehydroepiandrosterone for 16 weeks on ovarian response markers in women with primary ovarian insufficiency[J].J Clin Endocrinol Metab,2013,98:380-388.
[25] Wiser A,Gonen O,Ghetler Y,et al.Addition of dehydroepiandrosterone (DHEA) for poor-responder patients before and during IVF treatment improves the pregnancy rate:a randomized prospective study[J].Hum Reprod,2010,25:2496-2500.
[26] 安锦霞,王琰,倪亚莉,等.脱氢表雄酮(DHEA)预治疗在体外受精-胚胎移植周期中的应用[J].生殖与避孕,2013,33:89-92.
[27] Weissman A,Horowitz E,Ravhon A,et al. Dehydroepi and rosterone supplementation increases baseline follicular phase progesterone levels[J/OL].Gynecol Endocrinol,2011,27:1014-1017.
[28] 聂明月,杨晓葵,王树玉.脱氢表雄酮对卵巢储备功能降低患者体外受精-胚胎移植结局的影响[J].中国优生与遗传杂志,2014,10:114-116.
[29] 武学清,孔蕊,田莉,等.卵巢低反应专家共识[J].生殖与避孕,2015,35:71-79.
[30] Gleicher N,Weghofer A,Barad DH. Improvement in diminished ovarian reserve after dehydroepiandrosterone supplementation[J].Reprod Biomed Online,2010,21:360-365.
[31] 胡蓉,宋学茹,岳天孚,等.脱氢表雄酮对卵巢储备功能降低患者体IVF-ET结果的影响[J].中国计划生育学杂志,2012,20:832-835.
[32] 宋晖,武雁,田国华,等.脱氢表雄酮预处理对卵巢低反应患者体外受精-胚胎移植结果的影响[J].生殖医学杂志,2015,24:622-625.
[33] 张平,赵静,王蕴颖,等. 脱氢表雄酮对卵巢储备低下患者体外受精-胚胎移植的影响[J].实用临床医药杂志,2014,18:57-59.
[34] 董娟,徐望明,董兰,等. IVF-ET前使用脱氢表雄酮对卵巢储备功能低下患者妊娠结局影响的系统评估[J]. 生殖医学杂志,2015,24:436-443.
[35] Barad D,Gleicher N. Effect of dehydroepiandrosterone on oocyte and embryo yields,embryo grade and cell number in IVF[J].Hum Reprod,2006,21:2845-2849.
[36] Gleicher N,Weghofer A,Barad DH.Dehydroepiandrosterone(DHEA) reduces embryo aneuploidy:direct evidence from preimplantation genetic screening(PGS)[J].Reprod Biol Endocrinol,2010,8:140.
[编辑:郭永]
Research progress of dehydroepiandrosterone supplementation in patients with diminished ovarian reserve
XUXiao-lu1,LIUYun2*
1.GraduateSchoolofFujianUniversityofTraditionalChineseMedicine,Fuzhou350108 2.ReproductiveMedicalCenter,DepartmentofObstetricsandGynecology,FuzhouGeneralHospitalofNanjingMilitaryCommand,Fuzhou350001
Treatment of diminished ovarian reserve (DOR) and poor ovarian response (POR) is difficulty in the process of the assisted reproductive technology (ART). In recent years,some studies reported that pretreatment of various types of androgen including testosterone and dehydroepiandrosterone (DHEA) can increase the number of retrieved oocytes,and improve embryo quality,pregnancy rate and live birth rate in ART treatment of women with DOR or POR. However,some studies have objections that administration of androgen fails to improve ovarian reserve and the clinical outcome in the patients undergone IVF treatment. Research progress of DHEA supplementation in patients with DOR is reviewed in this paper.
Assisted reproductive technology; Diminished ovarian reserve; Poor ovarian response; Dehydroepiandrosterone
10.3969/j.issn.1004-3845.2017.04.019
2016-06-19;
2016-11-03
许晓璐,女,福建漳州人,硕士研究生,妇产科专业. (*
,Email:liuyunfj@126.com)

