混合细胞样本不同嵌合比例检测的参考标准
邱咏,陈大洋,夏军,朱珠,谢林,史千玉,刘萍,董洁,陈芳,蒋慧
(深圳华大基因,深圳 518083)
混合细胞样本不同嵌合比例检测的参考标准
邱咏,陈大洋,夏军,朱珠,谢林,史千玉,刘萍*,董洁,陈芳,蒋慧
(深圳华大基因,深圳 518083)
目的 制定一个标准的嵌合比例检测曲线,以用于植入前筛查(PGS)中更加精准地选择健康的胚胎进行移植,进而提高临床妊娠率及降低出生缺陷率。 方法 选用购买的5株商业化的CNV细胞系及2株正常男女性外周血细胞系,配置100%、70%、60%、40%、20%、0%的6个梯度嵌合比例;本批样本采用华大基因开发的胚胎植入前检测试剂盒(Embro-seq PGS kit)进行WGA扩增和文库构建,采用BGISEQ-500测序仪进行全基因组低深度测序,采用自主开发的CNV分析软件进行数据分析。 结果 5株细胞系的相应CNV在6个嵌合梯度的平均拷贝率分别是0.98、0.89、0.83、0.76、0.73和0.57。 结论 本研究绘制了一个不同嵌合比例的拷贝率曲线,为临床PGS检测中胚胎的嵌合性评估提供了一种相对准确的参考方法,进而可根据具体情况选择更加健康的胚胎进行移植以提高临床妊娠率及降低出生缺陷发生率。
植入前胚胎移植; 嵌合胚胎; 嵌合曲线; 混合细胞系
(JReprodMed2017,26(4):328-330)
在辅助生殖技术中,染色体非整倍性是引起移植失败的重要原因[1-2]。目前新一代的植入前胚胎筛查技术(PGS)比较基因组杂交和新一代测序技术都能同时检测胚胎的24条染色体的非整倍性情况[3-9]。另外,在PGS中也经常发现染色体嵌合现象[10]。
囊胚活检时通常取3~10个外滋养层细胞,由于外滋养层细胞间的染色体核型异质现象,所以PGS检测的细胞样本中可能会有嵌合现象。然而,不同比例的嵌合的临床意义不同,高比例的嵌合异常通常不建议进行移植。2016年的植入前胚胎诊断(PGD)指南定义20%以下的嵌合为正常核型,而80%以上的嵌合认为是非整倍体,建议实验室对20%~80%之间的嵌合度进行检测[11]。但目前尚无准确评估胚胎嵌合性的检测技术。
本研究的目的是通过正常及异常核型的细胞系按不同比例混合,制定一个标准的嵌合比例检测曲线,以期用于PGS中更加精准地检测胚胎的嵌合性,进而选择健康的胚胎进行移植,提高临床妊娠率及降低出生缺陷率。
材料与方法
一、材料
选用购买的5株商业化的异常细胞系(Coriell Institute,美国),已知核型分别是del(7)-25.3M、del(10)-14.1M、del(13)-18.3M、del(15)-4.9M、del(17)-5.8M;以及2株正常核型男女性外周血细胞系,核型分别是46,XX和46,XY。
二、方法
1.嵌合胚胎模拟:用显微操作仪(Eppendorf,美国),按比例挑选一定数量的异常核型细胞和正常核型细胞进行混合,模拟的细胞嵌合比例分别是10:0、7:3、6:4、4:6、2:8和0:10;每一个混合比例的总细胞数为10,配置100%、70%、60%、40%、20%、0%的6个梯度的嵌合比例(图1)。
图1 不同嵌合比例混合细胞样本检测流程图
2.WGA扩增和文库构建:本批样本采用华大基因开发的胚胎植入前检测试剂盒(Embro-seq PGS kit)进行WGA扩增和文库构建[12-13]。
3.NGS测序和信息分析:本实验采用华大自主开发的BGISEQ-500测序仪进行全基因组低深度测序,并采用自主开发的Embro-seq PGS kit 配套CNV分析软件进行数据分析[12-13]。
结 果
结合不同的模拟嵌合度,计算每个样本已知CNV的拷贝率:(1)细胞系del(7)-25.3M:嵌合比例从100%到0%,目标CNV的拷贝率分别是0.98、0.92、0.86、0.78、0.74、0.50;(2)细胞系del(10)-14.1M:嵌合比例从100%到0%,目标CNV的拷贝率分别是0.97、0.88、0.83、0.79、0.69、0.56;(3)细胞系del(13)-18.3M:嵌合比例从100%到0%,目标CNV的拷贝率分别是0.93、0.88、0.82、0.73、0.70、0.54;(4)细胞系del(15)-4.9M:嵌合比例从100%到0%,目标CNV的拷贝率分别是1.00、0.81、0.72、0.72、0.69、0.62;(5)细胞系del(17)-5.8M:嵌合比例从100%到0%,目标CNV的拷贝率分别是1.01、0.84、0.77、0.67、0.68、0.54(表1)。
综上所述,5个细胞系嵌合比例从100%到0%,相对应目标CNV的平均拷贝率分别是0.98、0.89、0.83、0.76、0.73、0.57。
讨 论
嵌合胚胎中同时存在整倍性细胞和非整倍性细胞,嵌合胚胎对表型的影响往往取决于三个方面:嵌合程度、所嵌合的染色体类型、嵌合细胞的分布[14]。本研究针对嵌合程度的检测绘制了一个不同嵌合比例和拷贝率之间的相关曲线,6个不同嵌合比例样本的拷贝率有明显逐渐递减的趋势,相邻梯度间可明显区分,为PGS检测中胚胎的嵌合性评估提供了一种相对准确的参考方法。
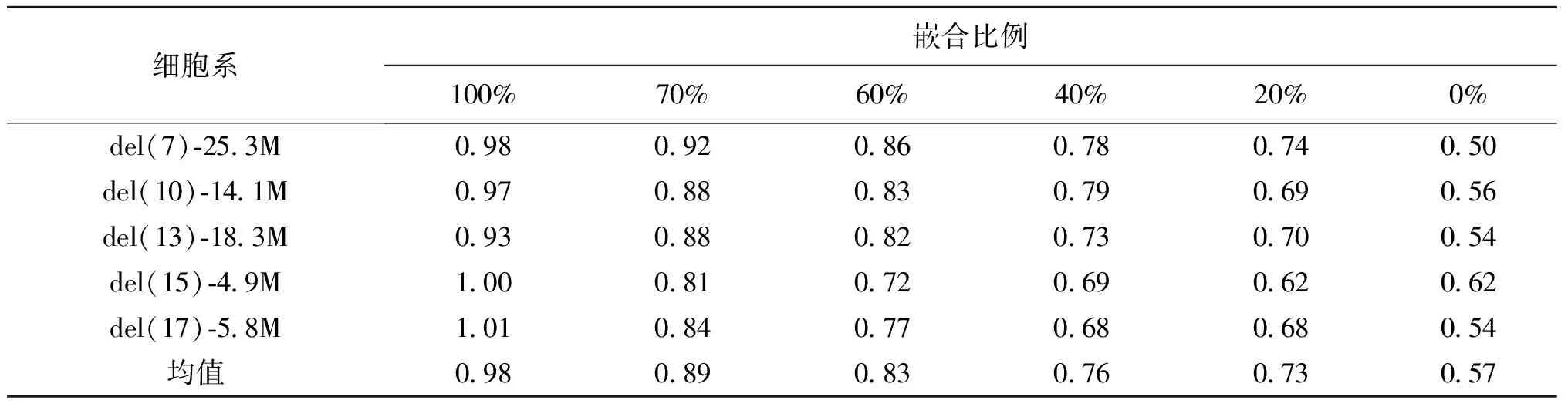
表1 不同比例嵌合度对应CNV的拷贝率
按照2016年的PGD指南定义,20%以下的嵌合可认为是正常核型可进行移植,而80%以上的嵌合则认为是非整倍体不建议移植,对20%~80%之间的嵌合度需结合实际情况考虑[11]。Greco等[15]收集了18个IVF家系,该18个家系胚胎的共同点是,所有胚胎均为非整倍性或嵌合胚胎,嵌合程度各不相同,在获得受试者的知情同意后,选择一些状态较好、嵌合程度低(小于50%)的胚胎进行植入,18个家系中,6个家系出生正常核型的胎儿。该研究表明,在一些较极端的情况下如多个IVF周期均无完全正常的胚胎可用时,可以考虑嵌合胚胎进行移植。
综上所述,虽然胚胎嵌合对移植后及胚胎发育的潜在影响尚不明确,但临床上一般不考虑移植嵌合胚胎,通常认为嵌合胚胎会降低IVF的成功率。本研究提供了一个检测胚胎嵌合程度的方法,若在极端情况下需要移植嵌合胚胎,应综合考虑胚胎嵌合类型和嵌合程度等因素进行选择,同等嵌合类型的条件下,优选选择嵌合程度低的胚胎进行移植。本研究只是细胞系混合的模拟样本,但我们已收集了一些临床样本进行检测,正在追踪收集临床结果进行验证。
[1] Munné S. Preimplantation genetic diagnosis and human implantation-a review[J]. Placenta,2003,24(Suppl B):S70-76.
[2] Farfalli VI,Magli MC,Ferraretti AP,et al. Role of aneuploidy on embryo implantation[J]. Gynecol Obstet Invest,2007,64:161-165.
[3] Munné S. Preimplantation genetic diagnosis for aneuploidy and translocations using array comparative genomic hybridization[J]. Curr Genomics,2012,13:463-470.
[4] Handyside AH. 24-chromosome copy number analysis:a comparison of available technologies[J]. Fertil Steril,2013,100:595-602.
[5] Wang L,Wang X,Zhang J,et al. Detection of chromosomal aneuploidy in human preimplantation embryos by next-generation sequencing[J]. Biol Reprod,2014,90:95.
[6] Wang L,Cram DS,Shen J,et al. Validation of copy number variation sequencing for detecting chromosome imbalances in human preimplantation embryos[J]. Biol Reprod,2014,91:37.
[7] Fiorentino F,Biricik A,Bono S,et al. Development and validation of a next-generation sequencing-based protocol for 24-chromosome aneuploidy screening of embryos[J]. Fertil Steril,2014,101:1375-1382.
[8] Huang J,Yan L,Fan W,et al. Validation of multiple annealing and looping-based amplification cycle sequencing for 24-chromosome aneuploidy screening of cleavage-stage embryos[J]. Fertil Steril,2014,102:1685-1691.
[9] Yin X,Tan K,Vajta G,et al. Massively parallel sequencing for chromosomal abnormality testing in trophectoderm cells of human blastocysts[J]. Biol Reprod,2013,88:69.
[10] Fragouli E,Alfarawati S,Daphnis DD,et al. Cytogenetic analysis of human blastocysts with the use of FISH,CGH and aCGH:scientific data and technical evaluation[J]. Hum Reprod,2011,26:480-490.
[11] PGDIS position statement on chromosome mosaicism and preimplantation aneuploidy testing at the blastocyst stage[C].Abstracts of the 15thInternational Conference on Preimplantation Genetic Diagnosis. (www.pgdis.org);RBMO,2016.
[12] http://www.seq500.com/portal/Seq-500.shtml.
[13] Fehlmann T,Reinheimer S,Geng C,et al. cPAS-based sequencing on the BGISEQ-500 to explore small non-coding RNAs[J]. Clin Epigenetics,2016,8:123.
[14] Novik V,Moulton EB,Sisson ME,et al. The accuracy of chromosomal microarray testing for identification of embryonic mosaicism in human blastocysts[J]. Mol Cytogenet,2014,7:18.
[15] Greco E,Minasi MG,Fiorentino F. Healthy babies after intrauterine transfer of mosaic aneuploid blastocysts[J]. N Engl J Med,2015,373:2089-2090.
[编辑:罗宏志]
Development of reference curve for different chimeric ratio by using mixed cell samples
QIUYong,CHENDa-yang,XIAJun,ZHUZhu,XIELin,SHIQian-yu,LIUPing*,DONGJie,CHENFang,JIANGHui
BeijingGenomicsInstituteinShenzhen,Shenzhen518083
Objective:To develop a standard curve of chimeric ratio for accurately selecting healthy embryos in preimplantation genetic screening (PGS) to improve clinical pregnancy rate and reduce the birth defect rate.Methods:The samples with six gradient chiming ratio of 100%,70%,60%,40%,20%,0% was configured by using 5 strains of commercial CNV cell lines and 2 strains of male and female normal peripheral blood cell lines. These samples were subjected to WGA amplification and library construction with BGI’s kit (Embro-seq PGS Kit) developed by the Beijing Genomics Institute. Whole genome sequencing was performed with BGISEQ-500 sequencer. Data were analyzed by self-developed CNV analysis software.Results:The average copy rates of the corresponding CNVs in the 6 samples with different gradient chimeric ratio were 0.98,0.89,0.83,0.76,0.73 and 0.57,respectivelyConclusions:A standard curve of chimeric ratio is developed,which can provide a relatively accurate reference method for assessment of embryo chimeric ratio in PGS. Therefore,the more healthy embryos can be chosen for transplantation in order to improve the clinical pregnancy rate and reduce the incidence of birth defects.
Preimplantation genetic screening; Chimeric embryo; Chimeric curve; Mixed cell lines
10.3969/j.issn.1004-3845.2017.04.007
2017-01-31;
2017-02-06
邱咏,女,湖北黄石人,硕士,生物化学与分子生物学专业.(*
)

