广西地区梅毒螺旋体阿奇霉素耐药基因23SrRNA流行病学研究
朱邦勇 李 伟 段家俊 张 杰 韦江平 周志光 黄 耿 唐中书 陈羽建 曹 娟 甘 泉 黄寅杰
·论著·
广西地区梅毒螺旋体阿奇霉素耐药基因23SrRNA流行病学研究
朱邦勇 李 伟 段家俊 张 杰 韦江平 周志光 黄 耿 唐中书 陈羽建 曹 娟 甘 泉 黄寅杰
目的: 了解广西地区梅毒螺旋体耐阿奇霉素基因23SrRNA突变的流行状况。方法: 采集广西不同地区性病门诊疑似早期梅毒患者300例组织液,先进行PCR检测梅毒螺旋体DNA,阳性标本再进行巢式PCR检测Mbo II酶切23SrRNA基因。结果: 梅毒DNA阳性215例,其中耐药检测有效菌株数为190株,阿奇霉素23SrRNA基因突变耐药菌株数为173株,耐药率91.1%(173/190)。结论:广西地区梅毒螺旋体阿奇霉素耐药率高。
梅毒螺旋体; 阿奇霉素; 耐药
梅毒是由苍白螺旋体感染引起的慢性传染性疾病,其主要传播途径是通过性接触、血液和母婴传播,该疾病已成为全球的公共卫生问题。有效治疗梅毒是控制其传播的重要途径,梅毒的一线治疗药物是青霉素,对青霉素过敏的患者,可用阿奇霉素治疗梅毒,近年来随着阿奇霉素治疗梅毒耐药病例越来越多,在使用阿奇霉素治疗梅毒方面应引起足够的重视,本文为了解广西地区梅毒螺旋体对阿奇霉素的耐药中23SrRNA突变基因的情况,及时掌握本地区耐药特点和相关因素,为今后进一步研究提供一些依据,现报道如下。
1 材料与方法
1.1 对象 从2012年1月至2016年7月,在广西南宁市、玉林市、柳州市和防城港市的性病门诊临床怀疑为早期梅毒患者共300例,其中男248例,女53例,年龄17~81岁,平均(37.5±15.28)岁。采集患者生殖器溃疡、扁平湿疣、湿丘疹或黏膜斑的组织液(采集时先用无菌生理盐水清洁皮损,再挤压皮损表面并用钝刀刮取组织液,避免出现血液),编号并放入-40℃冰箱中冷冻后转到广西皮肤病防治研究所性病中心实验室-85℃冰箱中保存待用。每个患者都需进行流行病学资料调查。
1.2 材料 PCR试剂: DNA提取试剂盒为美国Qiagen公司QIAamp®DNA mini Kit。DNA聚合酶和dDTPs为美国Promega公司GoTaq®Flexi系列产品。Mbo II限制性内切酶为美国New England BioLab公司产品。PCR扩增引物由上海英俊生物技术有限公司合成。阳性对照标本由中国疾病预防控制中心性病控制中心参比实验室冻存的Nichols标准株,阴性对照标本为TRUST和TPPA均阴性的生殖器疱疹患者的溃疡皮损DNA提取液。
1.3 方法 TP 23SrRNA基因扩增:采用巢式PCR方法。外侧扩增23SrRNA基因约1593 bp可变区,外引物23SrRNA-F1:5’-GTACCGCAAACCGACACAG-3’和23SrRNA-R1:5’-GCGCGAACACCTCTTTTTAC-3’, 将2 μL DNA模板加入50 μL PCR反应体系(上下游引物各0.5 μmol/L,dNTPs 0.2 μmol/L,1×Buffer,MgCl21.5 mmol/L,DNA聚合酶2 U及去离子水)。PCR反应条件为94℃ 3 min预变性后,于95℃ 45 s,63℃ 1 min 30 s,72℃ 1 min 30 s,共40个循环,72℃延伸10 min。将反应产物10 μL加入内引物反应体系,内侧扩增1593 bp可变区中的628 bp区域,使用内引物23SrRNA-F2:5’-GTACCGCAAACCGACACAG-3’和23SrRNA-R2:5’-AGTCAAACCGCCCACCTAC-3’,扩增体系及条件同上。将10 μL的巢式PCR扩增产物和100 bp的DNA Marker注入2%琼脂糖凝胶电泳100 V,60 min,目的片段628 bp左右。
巢式PCR扩增产物Mbo II酶切反应:将50 μL酶切体系(PCR扩增产物10 μL,1×BSA, 1×Buffer,Mbo II限制性内切酶5 U/μL去离子水)在隔热式电热恒温培养箱中37℃,16 h。然后将5 μL的酶切产物和100 bp的DNA Marker注入3%的高分辨率琼脂糖凝胶电泳100 V,75 min。酶切产物在凝胶成像电泳系统中进行测序分析。电泳条带若出现628 bp左右的单一条带则菌株无23SrRNA基因突变,若出现188 bp和440 bp双条带则菌株发生突变。
2 结果
2.1 阿奇霉素耐药检测结果 从收集的300例临床标本中发现PCR检测结果阳性标本215例,检出率为71.7%。阳性标本中,出现25份经Mbo II酶切后无目的条带出现,另外发现23SrRNA基因突变的菌株达到173例,耐药率达到91.1%,PCR扩增结果和Mbo II酶切反应结果见图1、2。
2.2 耐药结果与相关流行病学因素的关系 男152例,耐药率为90.1%(137/152),女38例,耐药率为94.7%(36/38);年龄17~85岁,平均(37.2±13.96)岁;已婚人群109例,耐药率为87.2%(95/109),未婚人群81例,耐药率为96.3%(78/81);高中及以上学历人群130例,耐药率为91.5%(119/130),初中及以下人群60例,耐药率为90.0%(54/60);既往有性病史的72例,耐药率为88.9%(64/72),既往无性病史的118例,耐药率为92.4%(109/118);有过阿奇霉素用药情况的有75例,耐药率95.9%(70/75),无阿奇霉素用药情况的有115例,耐药率89.6%(103/115);有过商业性行为的162例,耐药率为91.4%(148/162),无商业性行为的28例, 耐药率为89.3%(25/28);合并感染HIV的患者6例,耐药率为83.3%(5/6),无并感染HIV的患者184例,耐药率为91.3%(168/184)。以上各项指标的阿奇霉素耐药率差异均无统计学意义。仅发现有过大环内酯类药物用药情况的有158例,耐药率93.7%,明显高于无大环内酯类药物使用者的耐药率78.1%,有统计学意义(P<0.05),见表1。
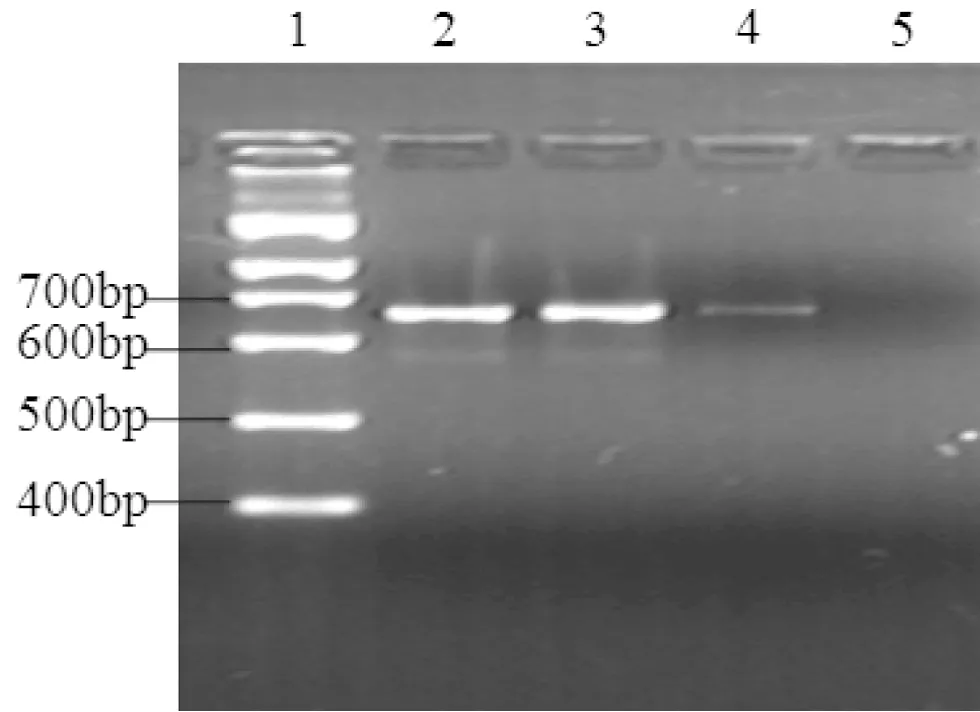
1:100 bp DNA标准参照物;2:Nichols标准株,628 bp+;3~4:临床株,628 bp+;5:阴性对照
图1 23SrRNA基因巢式PCR扩增产物电泳图
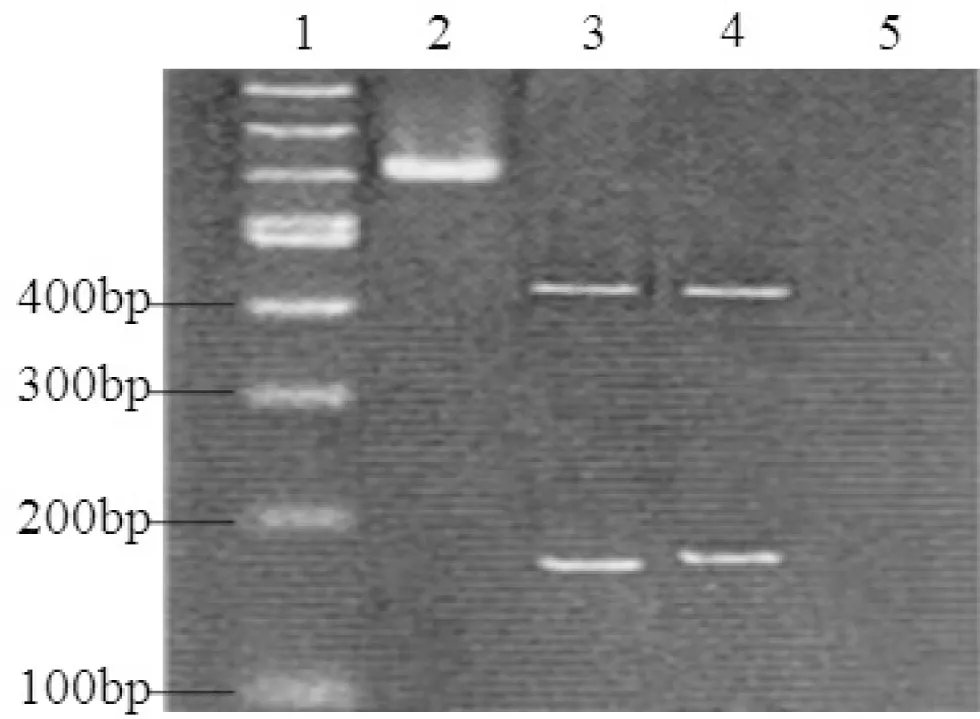
1:100 bp DNA标准参照物;2:Nichols标准株,628 bp+(未突变);3~4:临床株,440 bp+,188 bp+(突变);5:阴性对照
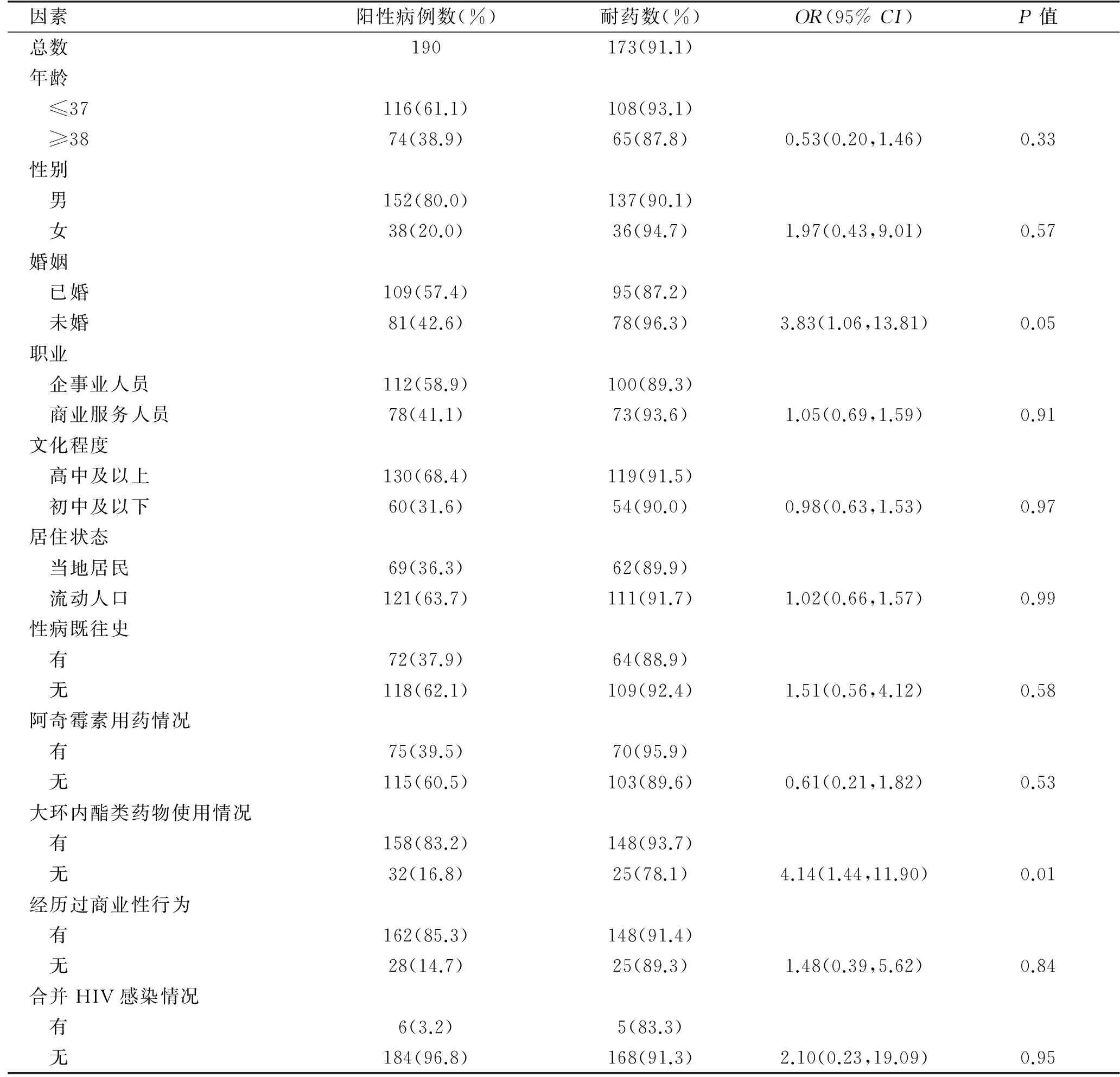
图2 Mbo II酶切23SrRNA基因巢式PCR扩增产物电泳图
3 讨论
梅毒是世界范围内最常见的性传播疾病之一。近年来,国内梅毒的发病率不断上升,甚至在部分人群(如男性同性恋者)中发生暴发现象。梅毒对人类的危害性和致病性一直备受关注,该疾病不仅可以明显促进HIV的感染和传播[1],而且还可以引起严重的并发症,以及由于感染的孕妇没有得到及时治疗而引起不良结局,主要包括自然流产、围产期死亡、出生低体重(包括早熟)和新生儿梅毒(先天梅毒)等[2]。
青霉素被公认为治疗梅毒最有效的药物。然而,在梅毒的控制中青霉素治疗存在一定的挑战,主要包括青霉素过敏的患者无法使用青霉素治疗,干预场所的就地治疗和性伴治疗的可行性差,以及由于需要注射而存在医源性感染的可能。近年来,阿奇霉素在梅毒治疗中的应用愈来愈受到广泛的重视,主要是因为:阿奇霉素口服治疗(特别是单剂量治疗)比较方便,可行性高和依从性好[3];阿奇霉素治疗梅毒具有与青霉素相当的疗效[4];同时可以控制其他性传播疾病,如衣原体感染和淋病等[5];以及阿奇霉素治疗的成本效益较高[6]。但是在英美等发达国家已经发现阿奇霉素治疗失败的病例,并且发现对阿奇霉素耐药的梅毒螺旋体的比例相对高,超过60%以上[7,8], 我们从广西部分地区收集的190例阳性标本中,研究发现23SrRNA基因突变的菌株比例很高,耐药率达到91.1%。与国内其他耐药监测结果基本相近,如南京耐药率达到93.8%、上海和山东的耐药率高达100%[9-11]。从流行病学调查了解到性别、年龄、婚姻状况、学历、既往性病史、行为学方面等因素对早期梅毒患者的阿奇霉素耐药率差异均无统计学意义;仅发现大环内酯类药物用药情况的耐药率93.7%,明显高于无大环内酯类药物使用者的耐药率78.1%。这可能平时常规感染性疾病使用大环内酯类药物比较广泛有很大的关系,以及梅毒螺旋体在大环内酯类药物的选择压力下发生耐药性突变[12]。因此在广西针对梅毒患者,应避免使用阿奇梅毒进行临床治疗和易感人群高危暴露后的预防性治疗,以减少治疗及预防失败的可能。
[1] Galvin SR, Cohen MS. The role of sexually transmitted diseases in HIV transmission[J]. Nature Review Microbiol,2004,2:33-42.
[2] World Health Organization. Action for the global elimination of congenital syphilis: rationale and strategy[M],2006.17.
[3] Kingston M, Carlin E. Treatment of sexually transmitted infections with single-dose therapy: a double-edged sword[J]. Drugs,2002,62:871-878.
[4] Riedner G, Rusizoka M, Toddet J, et al. Single-dose azithromycin versus penicillin G benzathine for the treatment of early syphilis[J]. New England J Medicine,2005,353:1236-1244.
[5] Swanston WH, Prabhakar P, Barrowet L, et al. Single dose (direct observed) azithromycin therapy for neisseria gonorrhoeae and chlamydia trachomatis in STD clinic attenders with genital discharge in trinidad and tobago[J]. West Indian Medical Journal,2001,50:198-202.
[6] Blandford JM, Gift TL. The cost-effectiveness of single-dose azithromycin for treatment of incubating syphilis[J]. Sexually Transmitted Dis,2003,30:502-508.
[7] Tipple C, McClure MO, Taylor GP. High prevalence of macrolide resistant Treponema pallidum strains in a London centre[J]. Sex Transm Infect,2011,87:486-488.
[8] Mitchell SJ, Engelman J, Kent CK, et al. Azithromycin-resistant syphilis infection: San francisco, california, 2000-2004[J]. Clin Infect Dis,2006,42:337-345.
[9] Chen XS, Yin YP, Wei WH, et al. High prevalence of azithromycin resistance to Treponema pallidum in geographically different areas in China[J]. Clin Microbiol Infect,2013,19(10):975-979.
[10] Martin IE, Gu W, Yang Y, et al. Macrolide resistance and molecular types of treponema pallidumcausing primary syphilis in Shanghai China[J]. Clin Infect Dis,2009,49(4):515-521.
[11] Li Z, Hou J, Zheng R, et al. Two mutations associated with macrolide resistance in treponema pallidum in shandong, China[J]. J Clin Microbiol,2013,51(12):4270-4271.
[12] Marra CM, Colina AP, Godornes C, et al. Antibiotic selection may contribute to increases in macrolide-resistant Treponema pallidum[J]. J Infect Dis,2006,194(12):1771-1773.
(收稿:2016-09-23 修回:2016-10-21)
Epidemiology of azithromycin resistant gene 23SrRNA of treponema pallidum in Guangxi
ZHUBangyong,LIWei,DUANJiajun,ZHANGJie,WEIJiangping,ZHOUZhiguang,HUANGGeng,TANGZhongshu,CHENYujian,CAOJuan,GANQuan,HUANGYinjie.
InstituteofDermatology,GuangxiAutonomousRegion,Nanning530003,ChinaCorrespondingauthor:LIWei,E-mail:lw17611981@163.com
Objective: To understand the epidemic status of azithromycin resistant gene 23SrRNA of treponema pallidum in Guangxi. Methods: The treponema pallidum DNA in interstitial fluids from 300 patients with early syphilis in different regions of Guangxi STD clinic were detected by PCR firstly, and then, the Mbo II enzyme 23SrRNA gene in positive samples were detected by nested PCR. Results: The treponema pallidum DNA in 215 patients were detected. Of these 190 strains were effective strains in resistance tests. Out of 190 strains, 173 strains were positive in Mbo II enzyme 23SrRNA gene mutation and the resistance rate of azithromycin was 91.1%. Conclusion: The resistance rate of azithromycin is high in Guangxi.
treponema pallidum; azithromycin; drug resistance
广西医疗卫生适宜技术研究与开发项目(编号:S201539)
广西壮族自治区皮肤病防治研究所,南宁,530003
李伟,E-mail: lw17611981@163.com

