苯并硫杂蒽衍生物对人宫颈癌细胞作用的拉曼光谱研究
徐 宁,董莹莹,魏船河,徐 玲(浙江工业大学 药学院,浙江 杭州 310014)
苯并硫杂蒽衍生物对人宫颈癌细胞作用的拉曼光谱研究
徐 宁,董莹莹,魏船河,徐 玲
(浙江工业大学 药学院,浙江 杭州 310014)
苯并硫杂蒽衍生物是一种可特异性与细胞核内DNA结合诱导人宫颈癌细胞(Hela细胞)凋亡的靶向小分子化合物.为了理解该靶向小分子化合物对Hela细胞的作用机制,从分子水平区分经小分子处理和未经处理的Hela细胞,将苯并硫杂蒽衍生物和HeLa细胞共培养24 h后观察细胞的拉曼光谱变化.结果表明:苯并硫杂蒽衍生物作用24 h后,HeLa细胞代表蛋白质的主链和侧链、核酸、脂类的拉曼谱带都发生了一定的改变,经不同浓度苯并硫杂蒽衍生物处理的细胞拉曼光谱间有显著区别,其中1.6 μmol/L组尤其明显.
苯并硫杂蒽衍生物;人宫颈癌细胞;拉曼光谱
Hela细胞是人宫颈癌细胞株,已被广泛运用于抗肿瘤化合物的筛选.苯并硫杂蒽类分子在其母体结构引入烷氨基侧链后,是一类水溶性好、细胞毒性低和抗肿瘤活性强的小分子化合物,具有靶向细胞核内DNA,诱导肿瘤细胞包括Hela细胞凋亡的作用[1].虽然当前用来研究细胞凋亡分子机制的主要手段是流式细胞术和激光扫描共聚焦荧光显微镜,但该方法制备样本过程繁琐,需要荧光标记抗体或荧光标记探针并长时间与细胞反应,因此在细胞凋亡或其他细胞的行为等分子机制研究中的应用受到一定的限制.而拉曼光谱分析由于它的非破坏性、高度敏感性等优点,在提供分子生化信息组成、相互作用和细胞中的结构生理条件等方面,已经成为一个有用的工具.拉曼光谱也是分析生物材料中蛋白质、核酸、脂类以及碳水化合物等大分子结构变化的有力手段.拉曼光谱特征峰的强度、峰宽和位置可提供分子振动、转动等信息,反映分子中不同的化学键或官能团[2].
为了探究拉曼光谱区分苯并硫杂蒽衍生物处理与未处理Hela细胞的可行性,在分子层面上探讨其对Hela细胞诱导凋亡的作用机理,为抗癌药物的筛选提供一种新方法和新思路,笔者对苯并硫杂蒽衍生物处理24 h后的Hela细胞进行了拉曼光谱特性研究.
1 材 料
1.1 化合物及细胞来源
苯并硫杂蒽衍生物由浙江工业大学张文教授实验室合成赠送,分子量424.10;细胞培养基RPMI-1640购自吉泰生物科技有限公司;胎牛血清购自浙江天杭生物科技有限公司.
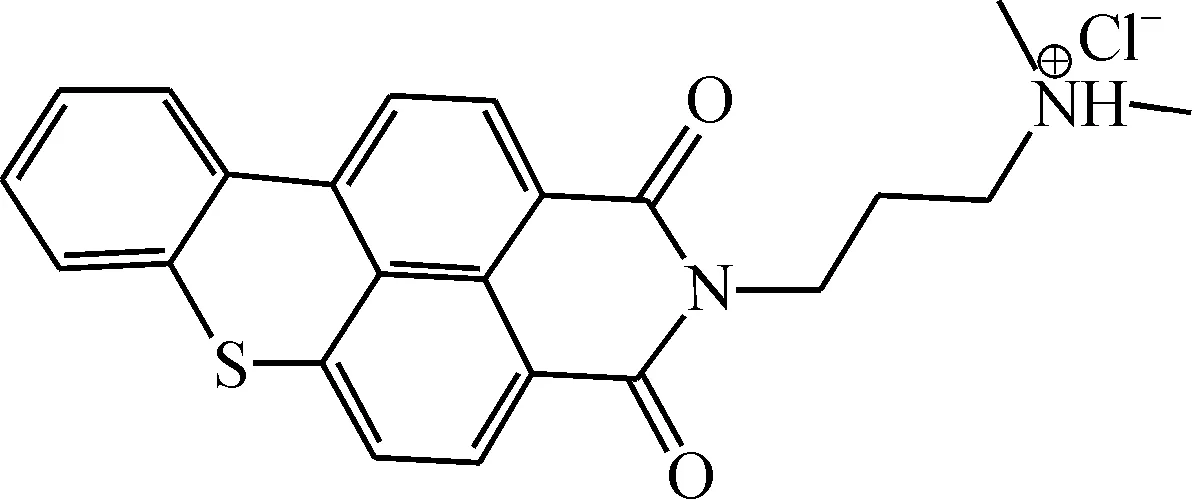
N-(N′-N′-二甲胺基丙基)苯并[k,l]硫杂蒽-3,4-二甲酰亚胺盐酸盐(N-(3-(dimethylamino)propyl)benzo[k,l]thioxanthene-3,4-dicarboximidehydrochloride),化学式C23H21N2O2ClS+,由浙江工业大学化学生物学实验室合成,结构式为
1.2 显微共聚焦拉曼光谱仪
Renishawinvia Reflex型拉曼光谱仪自带显微镜,使用标准阵列CCD探测器,Ar+为光源.WiRE 3.2软件获取光谱.
2 方 法
2.1 细胞培养
Hela细胞接种至装有1640培养基(含体积分数为10%的胎牛血清(Fetal Bovine Serum,FBS))的培养瓶中,于37 ℃、体积分数5%的CO2、相对湿度95%的培养箱内培养.对数生长期的细胞用质量分数为0.25%的胰酶消化为单个细胞并转移至六孔板,每孔接种5×105个细胞爬片.24 h后每孔分别加入0.4,0.8,1.6,4.0 μmol/L的苯并硫杂蒽衍生物,同时设置不加任何化合物的空白对照组.培养24 h后吸去上清,用PBS缓冲液洗涤两次,加入体积分数为75%的酒精固定爬片细胞30 min,-20 ℃保存待测.
2.2 苯并硫杂蒽衍生物溶液的制备
取4.5 mg苯并硫杂蒽衍生物溶解于1 059 μL二甲基亚砜(DMSO)中,超声微热使样品完全溶解,得到10 mmol/L的化合物储存液,-20 ℃保存.处理细胞时,将苯并硫杂蒽衍生物用DMSO稀释至所需浓度.
2.3 拉曼光谱检测与数据分析
激发波长514 nm,物镜50×,功率25 mW,曝光10 s,累积2次,扫描范围为400~3 200 cm-1.将固定有细胞的载玻片置于镜下,调整焦距将聚焦点对于细胞处.选取形态正常的Hela细胞,取细胞内任意三点获取光谱并进行平均,每个浓度组重复选择10个以上细胞检测.
实验所得的数据使用Labspec 5或wire 3.2软件进行处理(光滑、去基底、归一化等).origin软件画图.所有光谱扣除苯并硫杂蒽衍生物所产生的荧光本底.
3 结果与分析
3.1 扫描区域以及拉曼光谱原始图
酒精固定好的Hela细胞爬片经显微拉曼光谱检测,对照组和经1.6 μmol/L苯并硫杂蒽衍生物作用24 h后的实验组Hela细胞的显微图像及拉曼光谱如图1所示.
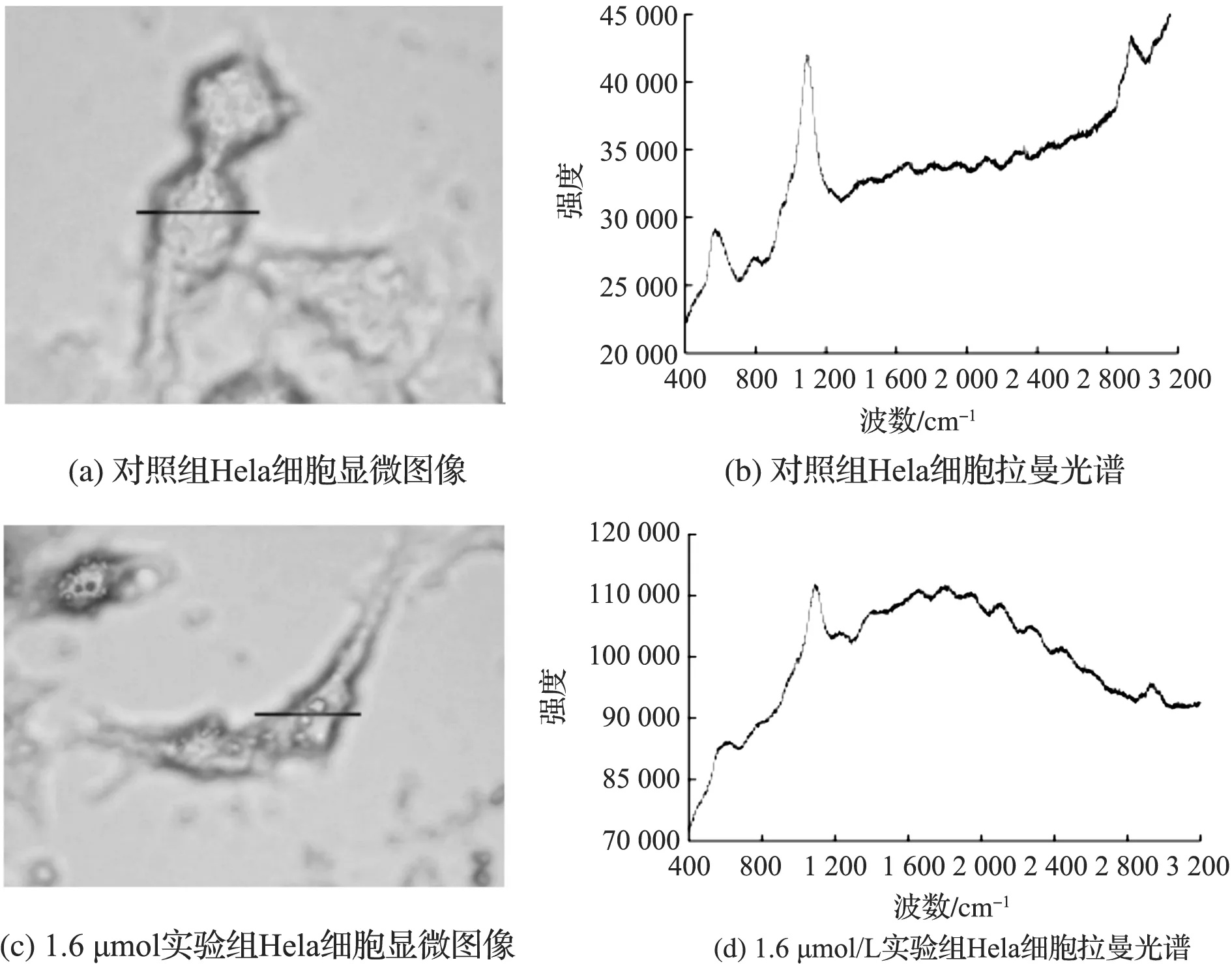
图1 Hela细胞显微图像及其拉曼原始谱图Fig.1 The Hela cells and their Raman original spectrum
3.2 拉曼光谱数据的处理
Wire软件可自动或手动调平所得拉曼光谱基线,以利于互相比较.在检测时,由于宇宙射线等原因造成原始拉曼光谱出现鬼峰,都用软件去除,结果如图2所示.

1—原始拉曼光谱;2—调基线;3—去除鬼峰图2 拉曼原始谱预处理Fig.2 The Raman spectrum preprocessing
3.3 400~1 800 cm-1拉曼光谱峰的解析
3.3.1 不同浓度苯并硫杂蒽衍生物处理后的Hela细胞拉曼光谱
由于细胞在1 800 cm-1之后有很长一段拉曼光谱无反应区,这一部分的拉曼光谱随着苯并硫杂蒽衍生物浓度的增加,荧光本底以及干涉条纹的干扰明显增强.因此我们截取了400~1 800 cm-1部分进行分析,这一区域丰富的拉曼峰代表核酸、蛋白质以及脂类的信息.不同浓度苯并硫杂蒽衍生物处理后的Hela细胞拉曼光谱如图3所示.
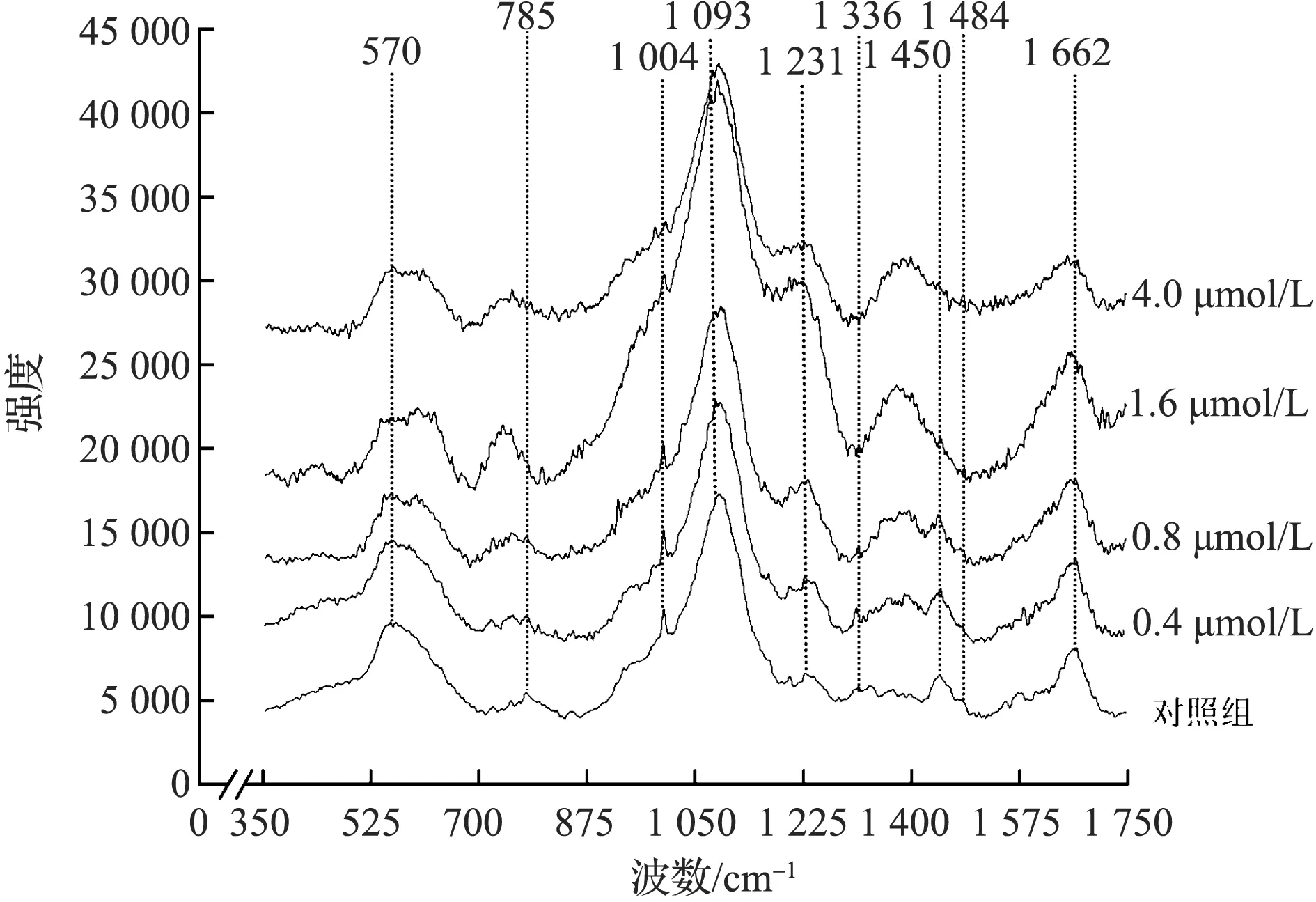
图3 不同组别Hela细胞拉曼光谱(514 nm, 350~1 750 cm-1)Fig.3 The Raman spectrum of different groups(514 nm,350~1 750 cm-1)
3.3.2 拉曼峰归属
Hela细胞的拉曼光谱峰归属见表1.

表1 HeLa细胞的拉曼光谱峰归属Table 1 The Raman spectra peaks assigment of Hela cells
3.3.3 谱带分析
1) 核 酸
2) 氨基酸与蛋白质
如图4所示,570 cm-1的谱线未发生移动,但强度降低.根据既往文献,相同分子振动能量结构产生不同的散色光,不同浓度的化合物可改变色氨酸的分子振动能量结构[13],提示高浓度的苯并硫杂蒽衍生物破坏了Hela细胞的部分分子振动能量结构.在1 004 cm-1的位置上呈现的尖锐强峰代表苯丙氨酸的单基取代苯基环,经苯并硫杂蒽衍生物作用后未发生频移,说明Hela细胞中苯丙氨酸对苯并硫杂蒽衍生物不敏感.
位于1 231 cm-1的拉曼谱峰归属于酰胺III β-折叠结构,1 662 cm-1的拉曼谱峰归属于酰胺I无规则卷曲结构.加入苯并硫杂蒽衍生物后,两个谱峰的位置未发生明显变化,但强度增加,尤其是加入1.6 μmol/L的苯并硫杂蒽衍生物后谱峰的强度最高.说明经苯并硫杂蒽衍生物处理后,细胞内蛋白质二级结构无规则卷曲结构和β-折叠结构比例上升,1.6 μmol/L组的改变效果最明显.1 484 cm-1的谱峰属于酰胺II,苯并硫杂蒽衍生物处理后谱峰强度下降,当浓度达到1.6 μmol/L时,此谱峰消失,说明高浓度的苯并硫杂蒽衍生物破坏了蛋白质酰胺II结构.
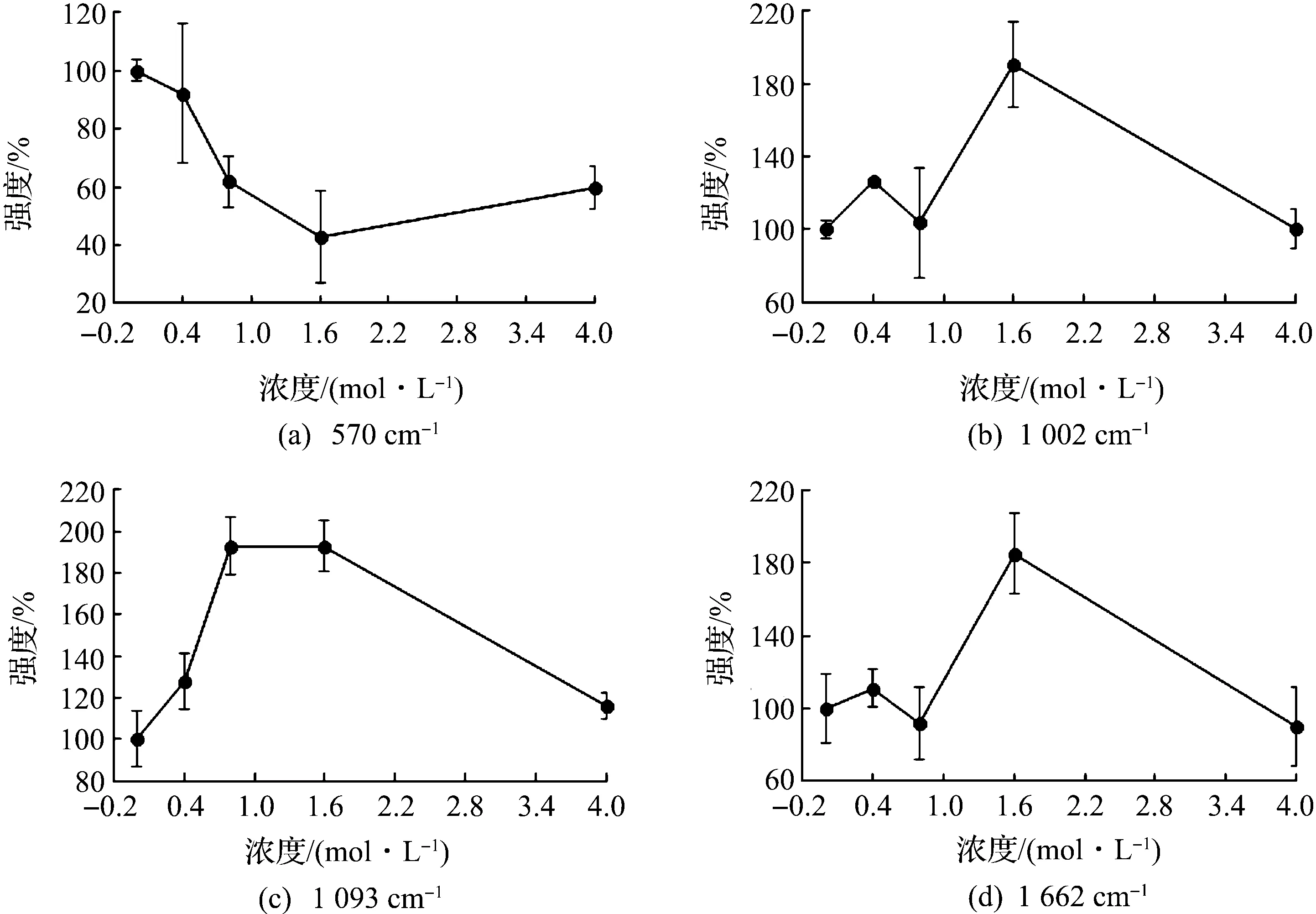
图4 苯并硫杂蒽衍生物浓度对拉曼峰强度的影响Fig.4 The influence of Benzothioxanthene derivatives concentration on Raman peak intensity
和对照组相比,低浓度处理组细胞中1 336 cm-1(色氨酸)的谱线发生蓝移,当苯并硫杂蒽衍生物浓度增加时,谱线消失,说明该小分子破坏了色氨酸的结构.
综上所述,苯并硫杂蒽衍生物作用于Hela细胞后,拉曼光谱所展示的细胞凋亡过程主要体现在细胞内DNA结构的变化,而细胞内部分蛋白质含量的增加大多是因为细胞凋亡过程中细胞质中的生物化学过程、细胞容积和细胞膜发生相应的变化导致的[14].
4 结 论
当前拉曼光谱在医学上已被用于对各种细胞,尤其是肿瘤细胞的研究.一方面,从细胞测定的拉曼光谱可以推测发生改变的基团,分子相互作用的位置与模式等;另一方面,由于拉曼光谱对物质分子结构、构象以及它们所处的环境很敏感,可从分子水平深入地研究其构象变化和相互作用的过程.不同浓度组苯并硫杂蒽衍生物作用于Hela细胞后,细胞中蛋白质的主链、侧链、核酸和脂类的谱带都发生了一定的改变,谱带变化复杂.其中经1.6 μmol/L苯并硫杂蒽衍生物处理的Hela细胞变化最为明显.应用拉曼光谱研究苯并硫杂蒽衍生物对细胞的影响操作方便,样品无需特殊处理,有助于我们理解探讨化合物与肿瘤细胞的凋亡作用的分子机理,更可望发展为一种新的筛选化合物活性的有效方法.
[1] ZHANG W, CHEN M, LING W Y, et al. Formation and stabilization of the telomeric antiparallel G-quadruplex and inhibition of telomerase by novel benzothioxanthene derivatives with anti-tumor activity[J]. Scientific reports,2015,5:13693.
[2] DEPCIUCH J, KAZNOWSKA E, ZAWLIK I, et al. Application of Raman spectroscopy and infrared spectroscopy in the identification of breast cancer[J]. Applied spectroscopy,2016,70(2):251-263.
[3] HU S F, FENG Y Y, ZHANG D S, et al. Raman spectral changes of Artemisinin-induced Raji cells apoptosis[J]. Vibrational spectroscopy,2015,81:83-89.
[4] FARHANE Z, BONNIER F, CASEY A, et al. Cellular discrimination using in vitro Raman micro spectroscopy: the role of the nucleolus[J]. Analyst,2015,140(17):5908-5919.
[5] LIANG L, HUANG D, WANG H, et al. In situ surface-enhanced Raman scattering spectroscopy exploring molecular changes of drug-treated cancer cell nucleus[J]. Analytical chemistry,2015,87(4):2504-2510.
[6] EL-MASHTOLY S F, YOSEF H K, PETERSEN D, et al. Label-free Raman spectroscopic imaging monitors the integral physiologically relevant drug responses in cancer cells[J]. Analytical chemistry,2015,87(14):7297-7304.
[7] SCHULZA H G, KONOROV S O, PIRET J M, et al. Label-free imaging of mammalian cell nucleoli by Raman microspectroscopy[J]. Analyst,2013,138(12):3416-3423.
[8] ZHU J, ZHOU J, GUO J, et al. Surface-enhanced Raman spectroscopy investigation on human breast cancer cells[J]. Chemistry central journal,2013,7(1):37.
[9] MARRO M, NIEVA C, SANZ-PAMPLONA R, et al. Molecular monitoring of epithelial-to-mesenchymal transition in breast cancer cells by means of Raman spectroscopy[J]. Biochimica et biophysicaacta (BBA)-Molecular cell research,2014,1843(9):1785-1795.
[10] HUEFNER A, KUAN W L, BARKER R A, et al. Intracellular SERS nanoprobes for distinction of different neuronal cell types[J]. Nano letters,2013,13(6):2463-2470.
[11] BRAUCHLE E, NOOR S, HOLTORF E, et al. Raman spectroscopy as an analytical tool for melanoma research[J]. Clinical and experimental dermatology,2014,39(5):636-645.
[12] MOVASAGHI Z, REHMAN S, REHMAN I U. Ramanspectroscopy of biological tissues[J]. Applied spectroscopy reviews,2007,42(5):493-541.
[13] QI J, LIU B L, LI Y T, et al. Raman spectroscopic study on Hela cells irradiated by X rays of different doses[J]. Chinese optics letters,2009,7(8):734-737.
[14] FARHANE Z, BONNIER F, CASEY A, et al. Raman micro spectroscopy forinvitrodrug screening: subcellular localisation and interactions of doxorubicin[J]. Analyst,2015,140(12):4212-4223.
[15] NAUMANN D. Infrared and NIR Raman spectroscopy in medical microbiology[J]. The international society for optical engineering,1998,3257:245-257.
(责任编辑:朱小惠)
Raman spectra analysis of Hela cell treated by benzothioxanthene derivatives
XU Ning, DONG Yingying, WEI Chuanhe, XU Ling
(College of Pharmacy, Zhejiang University of Technology, Hangzhou 310014, China)
Benzothioxanthene derivatives could bind specifically to the nucleus DNA and induced apoptosis of human cervical cancer cells (Hela cells). In order to explore the mechanism of interaction, a method is established to distinguish HeLa cells which is either treated or untreated by benzothioxanthene derivatives. Changes in Raman spectrum of HeLa cells were observed after 24 hours treated by benzothioxanthene derivatives. Results indicated that after 24h treated by benzothioxanthene derivatives, Raman spectrum of HeLa cells have changed, including the bands of protein backbone, side chain, nucleic acids and lipids. There are significant differences in Raman spectra of cells of different groups, especially the spectrum of the group of 1.6 μmol/L.
benzothioxanthene derivatives; human cervical cancer cells; Raman spectra
2016-03-05
浙江省科技计划分析测试项目(2014C37075)
徐 宁(1973—),女,浙江湖州人,副研究员,博士,研究方向为光子生物学,E-mail:xuning@zjut.edu.cn.
O657.3
A
1006-4303(2017)02-0206-04

