miR-320a靶向FOXQ1抑制结肠癌细胞增殖和侵袭的分子机制
汤增秋,熊小亮
(南昌大学医学院病理学与病理生理学教研室,江西南昌330006)
miR-320a靶向FOXQ1抑制结肠癌细胞增殖和侵袭的分子机制
汤增秋,熊小亮
(南昌大学医学院病理学与病理生理学教研室,江西南昌330006)
目的探讨miR-320a在人结肠癌细胞中的生物学行为,并初步阐明miR-320a对癌基因FOXQ1的靶向调控机制。方法采用qRT-PCR检测结肠癌细胞中miR-320a和FOXQ1的表达;用miR-320a mimics转染结肠癌细胞株HTC-116;采用CCK-8法、克隆形成试验检测miR-320a对结肠癌细胞增殖的影响,采用Transwell小室分析miR-320a对结肠癌细胞侵袭能力的影响;双荧光素酶报告基因和Western Bloting验证miR-320a对FOXQ1的靶向调控作用。结果QRT-PCR结果显示miR-320a mimics明显上调miR-320a在HCT-116细胞中的表达;CCK-8法和克隆形成试验显示上调miR-320a表达显著抑制结肠癌细胞增殖;Transwell试验表明上调miR-320a可抑制HCT-116结肠癌细胞侵袭;蛋白印迹实验显示上调miR-320a降低FOXQ1蛋白在结肠癌细胞中的表达,双荧光素酶报告基因试验进一步确认miR-320a可以调控FOXQ1的表达。结论过表达miR-320a可以抑制结肠癌细胞增殖、侵袭,这种抑制作用是通过靶向调控FOXQ1来实现的。
miR-320a;结肠癌;FOXQ1
结肠癌属常见的消化道恶性肿瘤,其在我国的发生率仍然呈明显的增高趋势[1]。过去30年来,结肠癌患者的5年生存率有所提高[2],据统计,结肠癌5年生存率为74%,根治手术率为85%[3]。然而,至今为止,结肠癌的发病机制尚不明确,影响结肠癌发生发展的分子机制仍有待阐明。
miRNAs是19~24核苷酸长度的小片段非编码RNA,通过直接靶向作用mRNA的3’UTR端抑制靶基因的转录或促进靶基因的降解[4]。许多研究表明,多种miRNAs在大肠癌中异常表达[5-8],参与调节大肠癌细胞的生物学行为[9,10],这其中包括miR-320家族成员[11]。miR-320a是新近发现的miRNA,其在结肠癌中的表达及其调控的靶基因罕见报道。近年研究发现,miR-320a在结肠癌组织和结肠癌细胞系中表达下调[12],通过上调miR-320a的表达可以抑制结肠癌细胞的增殖和转移[13,14],但其作用的机制尚不清楚。
FOXQ1属于叉头框转录因子家族的成员,在细胞生长、代谢、凋亡及癌变等生物学过程中发挥重要作用[15,16]。研究显示,FOXQ1与人类肿瘤关系密切,在结直肠癌[17,18]、乳腺癌[19]、卵巢癌[20]、肺癌[21]、肝癌[22]等不同肿瘤中都出现高表达,并增强肿瘤的生长、迁移[17,19,20,23].在结直肠癌细胞实验中发现可能存在几种不同的调控FOXQ1表达的方式,例如Wnt信号通路[18,24]、TGF-β[24]、miR-342[25],FOXQ1的激活进一步影响其下游靶基因如Fra-1[26]、p21[27]、Twist1[28],从而促进肿瘤血管生成、肿瘤再生、肿瘤微环境改变以及上皮-间质转化。上述研究表明,FOXQ1在结直肠癌中受到多种因子的调控,但是在结肠癌中,miR-320a是否是FOXQ1另一个调控因子,尚不清楚。
生物信息学软件提示,miR-320a在FOXQ1 3’端非翻译区存在潜在结合位点。因此,我们首次提出miR-320a在结肠癌中下调FOXQ1表达的假设,并通过实验验证了这一假设。
1 材料与方法
1.1 材料McCoy’s 5A培养基(武汉博士德公司),胎牛血清(北京全式金公司),Lipo2000脂质体转染试剂(美国Invitrogen公司),双荧光素酶报告系统(美国Promega公司),Transwell小室(美国Corning公司),结晶紫(上海高创公司),FOXQ1(美国Abcam公司)。
1.2 方法
1.2.1 HCT116结肠癌细胞株的培养及传代实验选用人HCT116细胞株,人HCT116细胞株为南昌大学第一附属医院科研中心提供。HCT116细胞株用含10%胎牛血清及1%青霉素和1%链霉素双抗的McCoys’5A培养基于37℃、5%CO2的细胞培养箱中培养。当细胞融合度约80%-90%时,用EDTA胰酶进行消化,适时加入血清终止消化,常规传代培养,实验时选对数期生长的细胞。
1.2.2 细胞转染人miR-320a mimics及阴性对照小干扰RNA购于上海吉马公司。按照脂质体2000试剂使用说明操作,将miR-320a mimics转染miR-320a低表达的HCT116细胞,并设立NC转染的细胞为对照组,转染后6h更换为完全培养基。
1.2.3 QRT-PCR检测标本中miR-320a表达常规TRIzol试剂抽提总RNA,使用cDNA合成试剂盒进行逆转录反应。使用qPCR SuperMix进行实时定量PCR反应,U6和GAPDH分别作为检测miR-320a和FOXQ1的指标。用目的基因表达量=2-△△Ct公式计算各样本中miR-320a和FOXQ1的相对表达量。
1.2.4 Western blot检测miRNA转染后靶基因蛋白表达分别提取处理后各组细胞的总蛋白,并用10%SDS-PAGE电泳进行蛋白分离。通过湿法转印将蛋白转移到硝化纤维膜上,接着用5%的脱脂奶粉将膜封闭。按试剂盒说明书配置FOXQ1的一抗和二抗,先加入一抗4℃水平摇床过夜,然后加入二抗水平摇床反应60min。用化学发光试剂盒行化学发光显色。
1.2.5 CCK-8法检测细胞增殖转染24h后,取HCT116细胞接种于96孔板。每孔加入溶液,在37℃的培养箱中培养48h,用CCK-8法测细胞活力。
1.2.6 平板克隆形成实验取对数生长期HCT116细胞,制备成单细胞悬液后计数,调整成103个细胞接种于6cm2培养皿中,约2周后用甲醇固定并用1g/L结晶紫染色,计数肉眼可见的克隆形成数,克隆形成率=(克隆数/接种细胞数)×100%。
1.2.7 Transwell实验检测细胞迁移及侵袭能力转染后的细胞培养24h后,常规消化细胞制成单细胞悬液。将细胞接种于Transwell小室中,上室加入200μl无血清的McCoy’5A培养基,下室加入含10%FBS的McCoy’5A培养基500μl,于37℃、5% CO2培养箱中培养24h后,结晶紫染色,在显微镜下观察穿膜细胞,并计数取平均值。
1.2.8 荧光素酶报告基因试验利用引物和聚合酶链式反应扩增与miR-320a有潜在结合位点的FOXQ1 3’非翻译区序列。通过1%琼脂糖凝胶电泳分离并回收PCR产物,后将FOXQ1 3’UTR片段植入psiCHECK-2质粒中构建构建psiCHECK-2-FOXQ1-3’UTR表达载体,并验证重组克隆片段的序列信息。将细胞均匀接种于96孔板中(每1个孔2×104个细胞/100μl),第2d分别转染miR-320a mimics及阴性对照。转染48h后,细胞经双蒸水稀释后,弃去培养基,每孔加入80μl的细胞裂解液,振荡裂解细胞1h,12,000r/min离心1min沉淀杂质。吸出上清液,加入不透明96孔板中,并依次加入萤火虫荧光素酶和海肾荧光素酶底物。使用酶标仪检测荧光强度,记录并分析数据。
1.2.9 统计学分析实验所得数据采用均值±标准差(x±s)表示,使用SPSS 17.0统计学软件进行统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-320a对结肠癌细胞增殖的影响转染24h后,采用qRT-PCR检测miR-320a表达,结果提示miR-320a mimics显著提升了HCT116细胞中miR-320a的水平,见图1a。CCK-8法和克隆形成实验,结果分别显示转染miR-320a mimics后的HCT116细胞活力明显下降,且其细胞克隆数较阴性对照组也明显减少,两组之间的差异具有统计学意义(P<0.5)。以上实验结果提示,miR-320a mimics抑制了结肠癌细胞增殖。综上,实验结果表明上调miR-320a的表达显著抑制结肠癌细胞增殖。
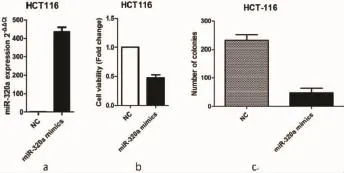
图1 上调miR-320a显著抑制结肠癌细胞HCT116的增殖
2.2 miR-320a对结肠癌细胞侵袭能力的影响转染后48h,Transwell小室检测细胞侵袭能力。结果显示,上调miR-320a的水平HCT116细胞穿膜细胞数在侵袭实验中明显降低,见图2。上述结果差异有统计学意义(P<0.05)。
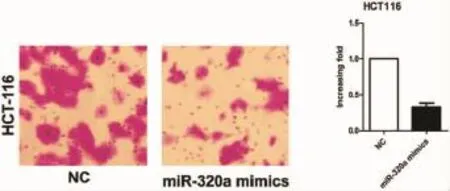
图2 过表达miR-320a抑制结肠癌细胞HCT116的侵袭(荧光× 200)
2.3 miR-320a在结肠癌细胞中与FOXQ1之间的相互关系为了验证FOXQ1是否是miR-320a的直接靶基因,行双荧光素酶报告基因实验。实验结果显示,与对照组相比,miR-320a mimics组荧光酶活性降低,两组之间差异有统计学意义(P<0.05),见图3a。进一步,Western blot实验表明miR-320a可在转录后水平调控FOXQ1的表达,见图3b。上述结果提示,在结肠癌细胞中,FOXQ1是miR-320a的直接靶标。
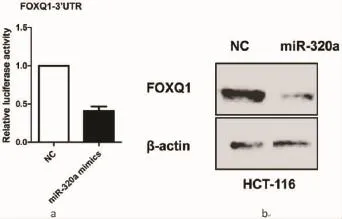
图3 miR-320a靶向调控FOXQ1的表达
3 讨论
研究显示miR-320a在包括结肠癌在内的多种癌症中表达下调[26],也有一些实验探究了miR-320a在结肠癌中的潜在功能。例如,Zhang Y等[27]发现发生肝转移的结肠癌患者中miR-320a的表达水平明显降低,miR-320a通过直接结合于神经菌毛素1的3’UTR抑制结肠癌细胞肝转移的迁移和侵袭能力。Hur K等[13]人多次实验验证后,也认为miR-320a可以作为检测结肠癌患者癌细胞远处转移的生物学指标。Sun JY等[28]人报道了miR-320a还可以靶向作用β-catenin抑制结肠癌细胞的增殖。这些研究显示,miR-320a可以多通路多角度地抑制结肠癌的发展进程。
本研究中,我们发现过表达miR-320a可以抑制HCT116结肠癌细胞的增殖和侵袭。实验结果与前人的研究结果一致,进一步证实了miR-320a在结肠癌中的生物学功能。但是在miR-320a调控机制上,本研究结果首次显示miR-320a通过靶向癌基因FOXQ1抑制结肠癌的发生发展。
FOXQ1基因定位在6p25.3,作为一类转录调控因子,可通过识别并结合相关下游靶基因的近端或远端顺式作用元件,实现对众多下游靶基因表达水平的正向或负向调控。研究人员已经证明,FOXQ1可能在人类肿瘤发生中起作用,尤其是在消化道肿瘤中的作用已成为近年研究的热点。Kaneda H等[17]发现FOXQ1在结直肠癌中高表达,促进肿瘤形成、生成、血管生成和抗凋亡。Peng X等[24]也证实,FOXQ1在结直肠癌中过表达,并与结直肠癌临床分期和淋巴结转移密切相关。此外,研究人员还发现FOXQ1作为下游靶基因被多种分子调控。在结直肠癌中,FOXQ1被发现是Wnt信号通路的新靶基因[18],也可以靶向作用TGF-β信号因子[24]。此外,有研究报道提示某些miRNA可以直接靶向FOXQ1影响肿瘤细胞的生物学过程。最近的一项研究显示,在结直肠癌中,miR-342是FOXQ1的调控因子,过表达或抑制miR-342水平能调控FOXQ1基因的表达,促进结直肠癌细胞表型的变化[29]。生物学信息分析提示,miR-320a与FOXQ1存在潜在的结合位点,因此,我们筛选出miR-320a做进一步的研究。本研究中,通过双荧光素酶报告基因实验证明,miR-320a直接与FOXQ1的3’非编码区结合抑制FOXQ1的转录,通过蛋白印剂实验证明,miR-320a可以抑制FOXQ1的蛋白表达。我们的研究结果显示miR-320a通过靶向FOXQ1抑制结肠癌细胞增殖和侵袭,为miR-320a在肠癌中的作用增添了新的机制。
总之,本实验发现miR-320a可以抑制结肠癌细胞的增殖和侵袭,其抑制作用是通过靶向癌基因FOXQ1来实现的,阐明了miR-320a通过FOXQ1介导抑制结肠癌发生发展,为结肠癌发病机制和诊断治疗的研究提供了新的思路和实验基础。
[1]崔国平,蔺建章,郭强,等.D3手术治疗进展期右半结肠癌临床分析[J].河北医药,2010,32(6):697-698.
[2]Agüero F,Murta-Nascimento C,Gallén M,AndreuGarcía M,et al. Colorectal cancer survival:results from a hospitalbased cancer registry[J].Rev Esp Enferm Dig,2012,104:572-577.
[3]狄彩虹,李响,郎刚,等.红细胞在结肠癌免疫治疗中的研究进展[J].中国实用医药,2010,5(34):232-233.
[4]Bartel DP.Micrornas:Genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281-297.
[5]Michael MZ,O'Connor SM,Van Holst Pellekaan NG,et al.Reduced accumulation of specific micro R NAs in colorectal neoplasia [J].Mol Cancer Res,2003,1(12):882-891.
[6]Arndt GM,Dossey L,Cullen LM,et al.Characterization of global microRNA expression reveals oncogenic potential of miR-145 in metastatic colorectal cancer[J].BMC Cancer,2009,9:374.
[7]Giráldez MD,Lozano JJ,Ramírez G,et al.Circulating microRNAs as biomarkers of colorectal cancer:results from a genome-wide profiling and validation study[J].Clin Gastroenterol Hepatol,2013,11(6):681-688.
[8]Bandrés E,Cubedo E,Agirre X,et al.Identification by Real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues[J].Mol Cancer,2006,5:29.
[9]Borralho PM,Kren BT,Castro RE,et al.MicroRNA-143 reduces viability and increases sensitivity to 5-fluorouracil in HCT116 human colorectal cancer cells[J].FEBS J,2009,276(22):6689-6700.
[10]Kong W,Yang H,He L,et al.MicroRNA-155 is regulated by the transforming growth factorβ/Smad pathway and contributes to epithelial cell plasticity by targeting RhoA[J].Mol Cell Biol,2008,28 (22):6773-6784.
[11]万璐颖,邓军,张凌,等.微小RNA-320在肿瘤中的研究进展[J].肿瘤防治研究,2015,42(3):311-314.
[12]Fang Z,Tang J,Bai Y,et al.Plasma levels of microRNA-24,microRNA-320a,and microRNA-423-5p are potential biomarkers for colorectal carcinomal[J].J Exp Clin Cancer Res,2015,34(1).
[13]Hur K,Toiyama Y,Schetter AJ,et al.Identification of a Metastasis-Specific MicroRNA Signature in Human Colorectal Cancer[J].J Natl Cancer Inst,2015,107(3):u492.
[14]Tadano T,Kakuta Y,Hamada S,et al.MicroRNA-320 family is downregulated in colorectal adenoma and affects tumor proliferation by targeting CDK6[J].World J Gastrointest Oncol,2016,8(7):532.
[15]Feuerborn A,Srivastava PK,Kuffer S,et al.The forkhead factor FOXQ1 influences epithelial differentiation[J].Cell Physiol,2011,226:710-719.
[16]Jonsson H,Peng SL.Forkhead transcription factors in immunology [J].Cell Mol Life Sci,2005,62:397-409.
[17]Kaneda H,Arao T,Tanaka K,et al.FOXQ1 is overexpressed in colorectal cancer and ehances turmorigenicity and tumor growth[J]. Cancer Res,2010,70(5):2053-63.
[18]Christensen J,Bentz S,Sengstag T,et al.FOXQ1,a novel target of the Wnt pathway and a new marker for activiation of Wnt signaling in solid tumor[J].PLoS One,2013,8(3):e60051.
[19]Qiao Y,Jiang X,Lee ST,et al.FOXQ1 regulates epithelial-mesenchymal transition in human cancers[J].Cancer Res,2011,71(8):3076-3086.
[20]Min Gao,Ie-Ming Shih,Tian-Li Wang.The Role of Forkhead Box Q1 Transcription Factor in Ovarian Epithelial Carcinomas[J].Mol Sci,2012,13,13881-13893.
[21]Feng J,Zhang X,Zhu H,et al.FOXQ1 overexpression influences poor prognosis in nonsmall cell lung cancer,associates with the phenomenon of emt[J].PLoS One,2012;7:e39937.
[22]Wang W,He S,Ji J,et al.The prognostic significance of FOXQ1 oncogene overexpression in human hepatocellular carcinoma[J]. Pathol Res Pract,2013,209:353-358.
[23]Abba M,Patil N,Rasheed K,et al.Unraveling the Role of FOXQ1 in Colorectal Cancer Metastasis[J].Mol Cancer Res,2013,11(9):1017-1028.
[24]Peng X,Luo Z,Kang Q,et al.FOXQ1 mediates the crosstalk between TGF-βand Wnt signaling pathways in the progression of colorectal cancer[J].Cancer Biol Ther,2015,16(7):1099-1109.
[25]郑极,唐慧,白璇,等.利用微阵列芯片技术探究基因FOXQ1与大肠癌的关系[J].世界华人消化杂志,2016,24(6):915-922.
[26]汤增秋,熊小亮.miR-320a与肿瘤相关性的研究进展[J].实验与检验医学,2016,34(6):737-741.
[27]Zhang Y,He X,Liu Y,et al.microRNA-320a inhibits tumor invasion by targeting neuropilin 1 and is associated with liver metastasis in colorectal cancer[J].Oncol Rep,2015,33(4):2093.
[28]Sun JY,Huang Y,Li JP,et al.MicroRNA-320a suppresses human colon cancer cell proliferation by directly targetingβ-catenin[J]. Biochem Biophys Res Commun,2012,20,420(4):787-792.
[29]Weng W,Okugawa Y,Toden S,et al.FOXM1 and FOXQ1 Are Promising Prognostic Biomarkers and Novel Targets of Tumor-Suppressive miR-342 in Human Colorectal Cancer[J].Clin Cancer Res,2016,22(19):4947-4957.
miR-320a inhibits cell proliferation and invasion in colon cancer by targeting FOXQ1
TANG Zengqiu,XIONG Xiaoliang. Department of Pathology and Pathophysiology,Medical College of Nanchang University,Nanchang 330006,China.
Objective To investigate the effect of miR-320a on colon cancer biological process,and clarify whether FOXQ1 is a direct target of miR-320a in HCT116 cells.Methods The expression of miR-320a and FOXQ1 was detected by Real-time PCR in colon cancer cells.The HTC-116 colon cancer cell line was transfected with miR-320a mimics.The CCK8 and colony formation assay were used to evaluate the cell proliferation.Transwell chamber was utilized to analyze the effects of miR-320a on invasion of HCT116 cells.Western blot and dual luciferase reporter experiments were employed to examine the regulation of miR-320a on FOXQ1.Results The result of Real-time PCR analysis indicated that miR-320a mimics significantly increased miR-320a levels in HCT-116 cells.The CCK8 and colony formation assay results showed miR-320a inhibited the HCT-116 cell proliferation.Up-regulation of miR-320a impaired the invasive abilities of HCT-116 cells.The Western blot results showed miR-320a reduced FOXQ1 protein level and double-luciferase reporter experiments,confirming that miR-320a could directly regulate FOXQ1 expression in colon cancer cells further.Conclusion miR-320a inhibited cell proliferation,migration and invasion by directly targeting FOXQ1.
miR-320a;FOXQ1;Colon cancer
R735.3+5,Q522
A
1674-1129(2017)02-0167-04
10.3969/j.issn.1674-1129.2017.02.009
2017-02-13;
2017-02-14)
汤增秋,男,1988年生,南昌大学医学院病理学与病理生理学在读研究生,主要研究法医病理学与法医DNA。
熊小亮,男,1970年生,副教授,硕士研究生导师,主要研究病理学与病理生理学。

