响应面法优化瑞士乳杆菌产蛋白酶培养条件
庞丰平,霍乃蕊
(1.山西农业大学食品科学与工程学院,山西晋中 030801;2.山西农业大学动物科技学院,山西晋中 030801)
响应面法优化瑞士乳杆菌产蛋白酶培养条件
庞丰平1,霍乃蕊2*
(1.山西农业大学食品科学与工程学院,山西晋中 030801;2.山西农业大学动物科技学院,山西晋中 030801)
为充分应用乳酸菌的产蛋白酶特性,本研究采用响应面分析法对瑞士乳杆菌产蛋白酶的培养条件进行优化。首先通过Plackett-Burman试验从7种因素中筛选发酵温度、发酵时间、起始pH为影响瑞士乳杆菌产蛋白酶的重要因素。进一步通过响应面分析得出最优产酶条件:发酵温度36℃、发酵时间16h、起始pH 6.65,瑞士乳杆菌的产蛋白酶活力为16.81U/mL和22.59U/mL,提高了34.4%,与预测结果接近,表明培养条件的优化有效,该发酵液为瑞士乳杆菌和所产蛋白酶的同步固定化研究提供了原料,也为瑞士乳杆菌产蛋白酶的应用研究奠定了基础。
瑞士乳杆菌;培养条件;蛋白酶
乳酸菌是世界公认级和安全级的益生菌,用于食品加工的历史久远。蛋白酶是一种催化蛋白质中肽键水解的酶,微生物是蛋白酶的主要来源之一,多由细菌和霉菌生产。
不同种属的乳酸菌菌株所分泌的蛋白酶分子量差异很大,介于30~200kDa,最适温度范围一般为40~50℃,最适pH接近中性(pH 5~8)[1,2]。乳酸菌蛋白酶可以分为PrtP(L.lactis和L.paracasei),PrtH(L.helveticus),PrtR(L.rhamnosus),PrtS(St.thermophilus)和PrtB(L.bulgaricus)5种,瑞士乳杆菌蛋白酶属于PrtH。不同种属的乳酸菌表达的细胞壁蛋白酶的类型不同,通常乳酸菌只分泌一种细胞壁蛋白酶,而瑞士乳杆菌却表达两种[3]。与传统发酵剂相比,瑞士乳杆菌有较强的蛋白水解活性,可用于制备多种活性肽。
目前提高乳酸菌蛋白酶活力的有效途径之一便是优化产酶培养条件。单因素试验或正交试验对培养条件优化时,得不到整个区域各因素的最佳组合和最优值[4],而响应面法则可以。嗜酸乳杆菌产细胞壁蛋白酶的培养条件优化时,将单因素试验结果、正交试验结果以及响应面法优化结果进行比较,证实响应面法结果是最优的[5]。借助响应面分析软件能快速、可靠地进行优化实验安排和统计分析[6]。本研究利用响应面法对瑞士乳杆菌产蛋白酶的液体发酵培养条件进行优化,为瑞士乳杆菌蛋白酶的进一步利用奠定基础。
1 材料与方法
1.1 材料、试剂与仪器
瑞士乳杆菌(Lactobacillus helveticus) 中国菌种保藏中心;MRS肉汤 北京奥博星生物技术有限责任公司;乳酸、乳酸钠、磷酸氢二钠、磷酸二氢钠、硼酸钠、无水碳酸钠、三氯醋酸、酪素、L-酪氨酸等其他试剂均为分析纯。
722可见光分光光度计 上海精密科学仪器有限公司;PHS-3C型精密pH计 上海雷磁分析仪器厂;HF160WHeal Force二氧化碳培养箱,台式高速冷冻离心机 香港力康生物医疗科技控股集团;HFsafe-1200LC 上海力申科学仪器有限公司;Lambda 850紫外可见分光光度计 美国Perkin Elmer公司。
1.2 方法
1.2.1 培养方法
将瑞士乳杆菌冻干粉接入MRS液体培养基中,37℃培养24h,连续转接活化2代,以1%(V/V)接种量接入三角瓶中进行增殖培养,按需将菌体培养液取出。
1.2.2 粗酶液制备
将菌液按3%的接种量接种于新鲜的MRS肉汤培养基中,厌氧培养36h。取8mL发酵液于10mL离心管中,4℃,5000r/min离心10min,取上清液作为测定蛋白酶活力所需粗酶液[7]。
1.2.3 蛋白酶活力的测定
参照GB/T 23527-2009《蛋白酶制剂》中蛋白酶活力的测定,采用福林法,每个样品做3个平行,取平均值[8]。
1.2.4 优化方法
采用Plackett-Burman设计法从培养时间、温度等7个影响因素中确定3个最主要因素,然后以响应面分析法(Design Expert)对此3个因素进行优化。
2 结果与分析
2.1 L-酪氨酸标准曲线

图1 L-酪氨酸标准曲线Fig.1 L-tyrosine standard curve
由图1可得线性回归方程为:y=0.01205x-0.0185,R2=0.99779,可信度较高,可以应用。
2.2 Plackett-Burman设计法筛选重要因素
结合瑞士乳杆菌发酵特性和已有的研究成果[9],对影响瑞士乳杆菌产酶的7个因素X1~X7进行两水平,高水平取低水平的1.25倍,Plackett-Burman试验因素水平表见表1。X1菌龄(h)的-1和1水平分别为16和20;X2培养温度(℃)的两水平分别为30和37.5;X3接种量(%)的两水平分别为2和2.5;X4培养体积(mL)的两水平分别为40和50;X5培养时间(h)的两水平分别为20和25;X6初始pH的两水平分别为6和7.5;X7生长因子(%)的两水平分别为5和6.25。以每毫升酶液的蛋白酶活力作为响应值Y,Plackett-Burman试验设计与结果见表2。
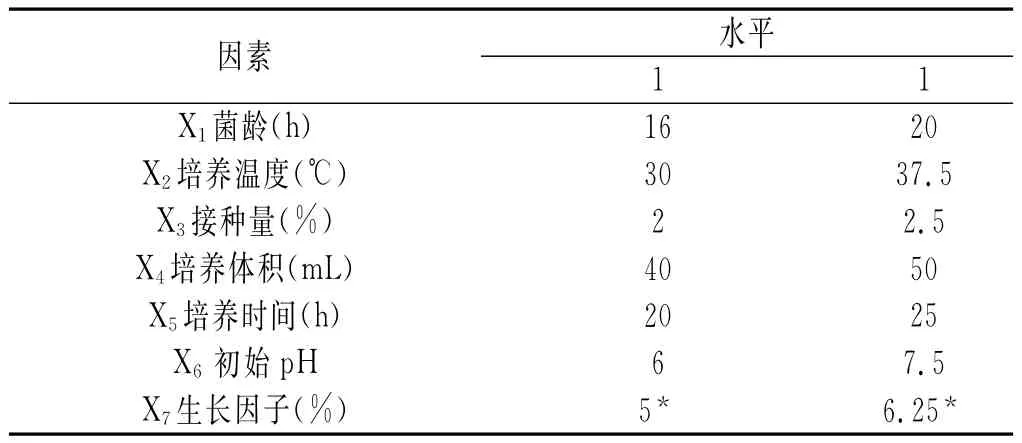
表1 Plackett-Burman试验因素水平表Table 1 Factors and levels of Plackett-Burman experiment

表2 Plackett-Burman试验设计与结果Table 2Design and test results of Plackett-Burman
对表2中的结果进行t检验,分析各因素的主效应,见表3。

表3 各因素影响的主效应分析Table 3 Main effect analysis of various influence factors
由表3可知,7种培养条件对瑞士乳杆菌产蛋白酶影响的显著性排列为:培养温度>培养时间>起始pH>菌龄>培养体积>接种量>生长因子。其中,培养温度、培养时间、起始pH影响最为显著,故作为响应面优化的因素。
2.3 响应面优化
根据Box-Behnken中心组合设计原理[10],设计三因素三水平共15个试验点的响应面分析试验,其中12个是析因点,3个零点重复,用以估计试验误差,以每毫升酶液的蛋白酶活力为响应值Y。培养温度的3个水平分别为30,37,45℃;培养时间的3个水平分别为12,16,24h;初始pH的3个水平分别为6,7.5,9,试验设计及结果见表4。
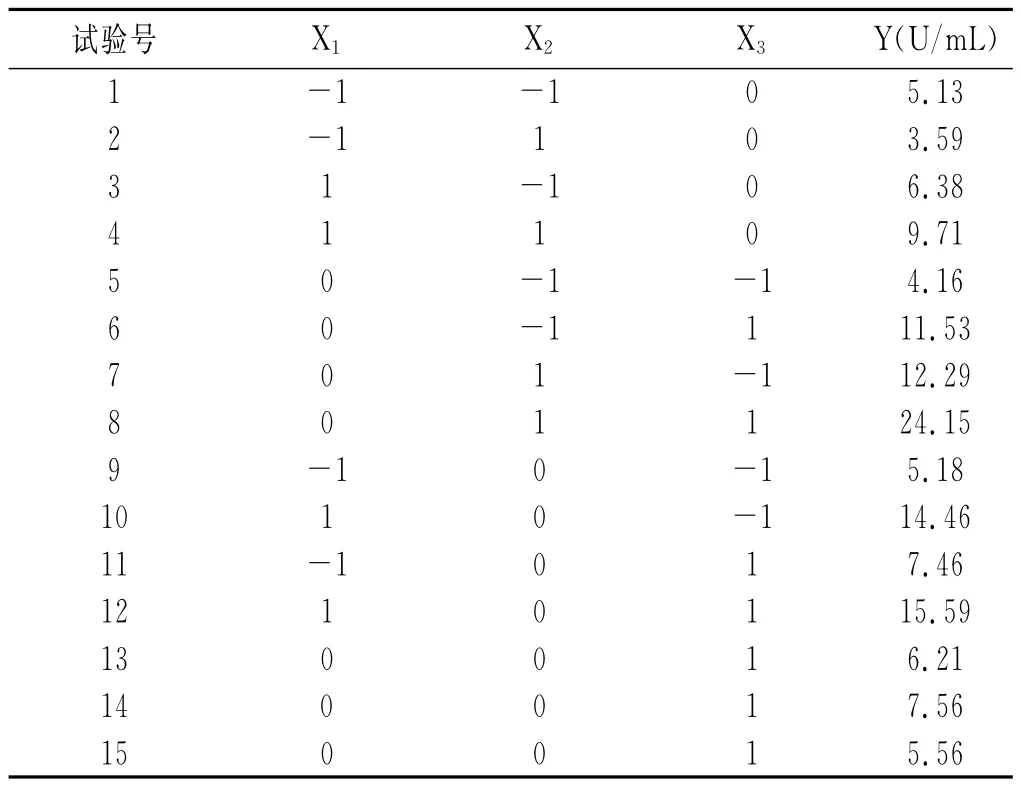
表4 Box-Behnken试验设计与结果Table 4 Experimental design and results of Box-Behnken
根据表4的试验结果,通过响应面软件处理确定回归方程:Y=28.39+1.36X1+2.12X2+1.23X3+0.49X1X2+0.83X1X3+2.31X2X3-9.74X12-3.78X22-2.61X32。

表5 回归方程的方差分析Table 5 Analysis for the variance of regression equation
由表5可知,二次项对响应值的影响极显著,模型P<0.05,差异显著,失拟项反映的是实验数据与模型不相符的情况,P=0.5203>0.05,失拟项不显著,因此模型选择正确。

表6 模型的可信度分析Table 6 Reliability analysis of the model
由表6可知,复相关系数R2=0.9460,说明模型可解释94.60%,即实验所得的酶活力变化,表明方程拟合较好。Y的变异系数CV表示实验的精确度,CV值越高,实验的可靠性越低,本实验中CV=1.9327,较低,说明试验操作可信。
响应面分析图见图2~图4。

图2 x1,x2对Y值预测响应面图和等高线图Fig.2 Response surface plot and contour plot of Y=(x1,x2)

图3 x1,x3对Y值预测响应面图和等高线图Fig.3 Response surface plot and contour plot of Y=(x1,x3)

图4 x2,x3对Y值预测响应面图和等高线图Fig.4 Response surface plot and contour plot of Y=(x2,x3)
由图2~图4响应面的分析可知,3个因素均有最优值,即培养温度36℃,发酵时间16h,起始pH 6.65,在此点预测的酶活力为24.73U/mL。在其余培养基成分和培养条件不变的情况下,在初始发酵条件和优化发酵条件下进行验证实验,培养1天后,酶活力分别为16.81U/mL和22.59U/mL,条件优化后酶活力提高了34.4%,与预测结果接近,说明培养条件的优化有效。
3 讨论
本研究通过二水平设计的Plackett-Burman试验分析了7种因素对瑞士乳杆菌产蛋白酶活力的影响,利用响应面法对瑞士乳杆菌产蛋白酶的培养条件进行了优化,在该优化培养条件下,酶活力达22.59U/mL,较初始培养条件提高了34.4%,增幅较大。张重阳等[11]仅对瑞士乳杆菌产蛋白酶的培养和提取条件进行了研究,并没有得出较为准确细致的培养条件。张莹等[12]利用正交试验对瑞士乳杆菌的产蛋白酶发酵条件进行了优化研究,优化后的产蛋白酶活力特别低,只有62.136U/mL。响应面法优化瑞士乳杆菌的产蛋白酶培养条件,其产蛋白酶特性进一步提高,为瑞士乳杆菌蛋白酶的开发和研究提供了依据,此发酵液也可用于瑞士乳杆菌及其蛋白酶固定化的研究。由于瑞士乳杆菌有较强的蛋白水解活性,也可研究制备多种活性肽。食源性降血压多肽具有作用温和、安全性高及生物功能多样性等特点,这为通过非药物治疗和缓解高血压提拱了新途径,满足了高血压人群居高不下且难以治愈的客观需求,也可以将其制品作为功能因子添加剂添加到食品中。
[1]Xing G Y,Pan D D,Tong M,et al.Purification and characterization of cell-envelope proteinase from Lactobacillus casei DI-1[J].African Journal of Biotechnology,2012,11(84):15060-15067.
[2]李敏,潘道东.嗜酸乳杆菌细胞壁蛋白酶的提取优化[J].食品科学,2011(23):260-265.
[3]Savijoki K,Ingmer H,Varmanen P.Proteolytic systems of lactic acid bacteria[J].Applied Microbiology and Biotechnology,2006,71(4):394-406.
[4]何国庆.食品酶学[M].北京:化学工业出版社,2006.
[5]任晓芬,潘道东,曾小群,等.嗜酸乳杆菌产胞壁蛋白酶的培养及发酵条件优化[J].中国食品学报,2014(14):146-153.
[6]欧宏宇,贾士儒.SAS软件在微生物培养条件优化中的应用[J].天津轻工业学院学报,2001,36(1):14-17.
[7]李爱芬,孙祖莉,陈敏,等.海产品中蛋白酶产生菌的选育及产酶条件研究[J].海洋科学,2003,27(9):41-43.
[8]张咚咚,安家彦,韩鹏军,等.传统发酵乳中高产蛋白酶乳酸菌的筛选及鉴定[J].食品科技,2013,38(8):5-8.
[9]张丹丹,郭宇星,周慧敏,等.瑞士乳杆菌的益生特性[J].食品与发酵工业,2014,40(5):32-36.
[10]徐梦辰,丁轲,吕莹,等.山药蛋白酶解条件及其响应面法的优化[J].中国粮油学报,2015(12):27-32.
[11]张重阳,潘道东.瑞士乳杆菌产蛋白酶的培养和提取条件的研究[J].食品科学,2006,27(10):416-418.
[12]张莹,陈庆森.瑞士乳杆菌高活力蛋白酶发酵条件的优化[J].食品科学,2007,28(9):356-359.
Optimization of Culture Conditions of Protease Produced by Lactobacillus helveticus Using Response Surface Methodology
PANG Feng-ping1,HUO Nai-rui2*
(1.College of Food Science and Engineering,Shanxi Agricultural University,Jinzhong 030801,China;2.College of Animal Science and Technology,Shanxi Agricultural University,Jinzhong 030801,China)
In order to make full application of protease properties of lactic acid bacteria,optimize the culture conditions of Lactobacillus helveticus produced protease using response surface methodology.Firstly,screen seven factors by Plackett-Burman experiment.The fermentation temperature,fermentation time,initial pH are important factors affecting the yield of Lactobacillus helveticus produced protease.Use response surface methodology to obtain the optimum conditions for enzyme production:fermentation temperature of 36℃,fermentation time of 16h,initial pH of 6.65,the protease activity produced by Lactobacillus helveticus is 16.81U/mL and 22.59U/mL,improved by 34.4%,and it is close to the forecasted results,indicating that the optimization of culture conditions is effective,the fermentation broth has provided materials for Lactobacillus helveticus and immobilized and simultaneous research of protease,it has also laid a foundation for the applicaticn of Lactobacillus helveticus produced protease production.
Lactobacillus helveticus;culture conditions;protease
TS201.56
A
10.3969/j.issn.1000-9973.2017.04.002
1000-9973(2017)04-0004-05
2016-10-16 *通讯作者
山西省人社厅留学人员科技活动择优资助项目(2014年度);山西省回国留学人员项目(2014-042)
庞丰平(1991-),男,山西临汾人,硕士,研究方向:食品生物技术;霍乃蕊(1972-),女,山西平遥人,教授,博士,主要从事生物技术与食品安全方面的教学与科研工作。

