微生物同步利用葡萄糖和木糖代谢工程概述
李燕军,赵 岩,黄龙辉,李 娟,谢希贤,陈 宁
(1.代谢控制发酵技术国家地方联合工程实验室,天津 300457;2.天津市氨基酸高效绿色制造工程实验室,天津 300457; 3.天津科技大学 生物工程学院,天津 300457)
微生物同步利用葡萄糖和木糖代谢工程概述
李燕军1,2,3,赵 岩1,2,3,黄龙辉1,2,3,李 娟1,2,3,谢希贤1,2,3,陈 宁1,2,3
(1.代谢控制发酵技术国家地方联合工程实验室,天津 300457;2.天津市氨基酸高效绿色制造工程实验室,天津 300457; 3.天津科技大学 生物工程学院,天津 300457)
现阶段,随着资源枯竭和环境污染问题的日益突出,利用农业废弃物等木质纤维素原料发酵生产生物产品、生物能源和生物材料已经成为学术界和社会的共识.微生物同步利用葡萄糖和木糖是木质纤维素生物炼制的重要内容,同时也有利于提高芳香族氨基酸等产品的发酵性能.然而,由于碳分解代谢物阻遏(葡萄糖效应)的存在,大多数微生物并不具备这种特性,迫切需要采用代谢工程手段构建高效同步利用葡萄糖和木糖的菌株.首先对微生物同步利用葡萄糖和木糖的意义进行了说明,然后阐述了氨基酸和核苷生产菌大肠杆菌、枯草芽孢杆菌和谷氨酸棒杆菌葡萄糖效应的分子机制和破除策略,同时介绍了一些能够同步代谢葡萄糖和木糖的工程菌株的实际应用.
木糖;氨基酸;大肠杆菌;枯草芽孢杆菌;谷氨酸棒杆菌;碳分解代谢物阻遏
随着石化资源的过度消耗和越来越严重的环境污染问题,绿色、可再生资源的开发利用已经成为人类面临的紧迫任务,也是未来制约我国社会经济发展的重要因素.当今,发酵工业为关乎国计民生的重要支柱产业之一,而我国已发展成为发酵生产氨基酸、有机酸等产品的“世界工厂”;然而其原料主要是粮食来源的淀粉糖,对我国的粮食安全构成了潜在的威胁[1].因此,开发以农业废弃物为代表的木质纤维素资源作为发酵原料具有重要的战略意义.与粮食原料相比,木质纤维素具有异质性,由纤维素(40%~50%)、半纤维素(25%~30%)和木质素(10%~20%)三部分构成;纤维素和半纤维素水解后产生可发酵的己糖(主要是葡萄糖)和戊糖(主要是木糖),其中己糖约占2/3,戊糖约占1/3[2].木糖可占半纤维素水解液的90%,为木质纤维素水解液中含量仅次于葡萄糖的一种单糖[3].另外,随着环境污染压力的增大,造纸行业需要清洁生产,将会产生大量的半纤维素水解液来取代传统的造纸黑液,为发酵工业提供木糖原料[4].
1 同步利用葡萄糖和木糖的意义
在长期适应自然的进化过程中,微生物对不同碳源的利用形成了不同的优先级,通常葡萄糖为最适碳源,当环境中缺乏葡萄糖时,微生物也可以利用其他碳源(如木糖)存活下来.这种微生物优先利用葡萄糖的现象叫做碳分解代谢物阻遏(Carbon catabolite repression, CCR),也叫“葡萄糖效应(Glucose effect)”.然而在发酵生产实践中,我们希望微生物同步代谢葡萄糖和木糖.在木质纤维素水解液的利用过程中,虽然有时我们只关注总可发酵糖到目标产品的最大转化率,但是微生物对葡萄糖和木糖的相继利用使得发酵周期延长,发酵过程控制变得异常复杂.由于葡萄糖分子对纤维素酶具有很强的反馈抑制作用,科学家们将木质纤维素的酶解和发酵过程偶联起来,开发了同步糖化发酵(Simultaneous saccharification and fermentation, SSF)工艺,其特点是维持葡萄糖消耗和产生速率的动态平衡,解除酶解抑制的同时大大降低了操作成本.但是,由于CCR的存在,水解液中的木糖不断累积,若在葡萄糖耗尽时实现木糖的利用,则破坏了SSF的连续性,使糖化和发酵的偶联失去意义.一条解决该问题的途径是应用解除CCR、能够同步利用葡萄糖和木糖的菌株,开发同步糖化与共发酵(Simultaneous saccharification and co-fermentation, SSCF)工艺.
除了在木质纤维素利用方面的应用,微生物同步代谢葡萄糖和木糖在氨基酸、核苷和衍生物的发酵中具有重要意义.当前,从自然界分离的可以天然代谢木糖的微生物主要包括细菌、酵母和丝状真菌.如图1所示,酵母和一些真菌通过木糖还原酶-木糖醇脱氢酶途径(XR-XDH pathway)代谢木糖:进入细胞内的木糖首先在依赖于NADPH的木糖还原酶(Xylose reductase,XR)的作用下转化为木糖醇,随后通过NAD+依赖型木糖醇脱氢酶(Xylitol dehydrogenase,XDH)形成木酮糖,最后再经过木酮糖激酶(Xylulose kinase,XK)催化形成木酮糖-5-磷酸,由此进入戊糖磷酸途径(Pentose phosphate pathway, HMP)[5-6].然而,在常见的细菌如大肠杆菌中,木糖直接经过木糖异构酶(Xylose isomerase,XI)作用形成木酮糖而不需要辅酶参与,并随后在XK催化下形成木酮糖-5-磷酸进入HMP.由于存在辅酶不平衡的问题,真菌的木糖代谢效率较低;细菌的木糖代谢途径不需要辅酶参与,木糖在XI一种酶作用下即可转化为木酮糖,木糖代谢效率较高,该途径被称为木糖异构酶途径(XI pathway).HMP是除糖酵解(Embden-Meyerhof-Parnas pathway,EMP)外细胞内第二重要糖分解代谢途径,为细胞的合成代谢提供多种原料.许多产品的合成需要EMP和HMP两条中心代谢途径的协调进行.在葡萄糖培养基中适量添加木糖,增强胞内HMP,可能有利于微生物合成芳香族氨基酸(色氨酸、苯丙氨酸和酪氨酸)、组氨酸与核苷(腺苷、肌苷、鸟苷、胞苷和尿苷)以及某些维生素(维生素K、叶酸和核黄素等B族维生素)(图1).芳香族氨基酸的合成需要经过莽草酸途径,以来源于HMP途径的赤藓糖-4-磷酸(Erythrose-4-phosphate,E4P)和来源于EMP的磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP)作为共同初始底物[7].利用木糖除了容易生成E4P外,还可以减少PTS系统转运葡萄糖过程对PEP的消耗.Li和Frost[8]构建的重组菌,以木糖与葡萄糖的混合糖为碳源时,莽草酸产量比单独利用葡萄糖时要高.无论是野生菌还是基因工程菌(目前代谢工程改造策略以葡萄糖出发),如果只以木糖作为培养基,预期不会取得理想的发酵效果.因为木糖本身不是很好的碳源,Buschke等[4]研究发现在木糖发酵过程中产生的CO2量明显高于以葡萄糖为碳源时产生的CO2量,其生物量和戊二胺产量却低于后者,他们认为这可能是由于木糖代谢中间产物5-磷酸-木酮糖绕开了NADPH的主要合成途径,直接进入磷酸戊糖途径的非氧化阶段,为了维持NADPH的供给水平,大量的代谢流进入TCA所致.葡萄糖能够成功进入HMP氧化阶段,为同步利用葡萄糖和木糖(直接进入非氧化阶段)提供可能[9].此时,葡萄糖提供菌体生长和代谢所需的能量与还原力,木糖提供某些产物合成的前体物,预期会比单独利用某种碳源取得更好的效果.该策略已经成功应用于木糖醇的生产[10].
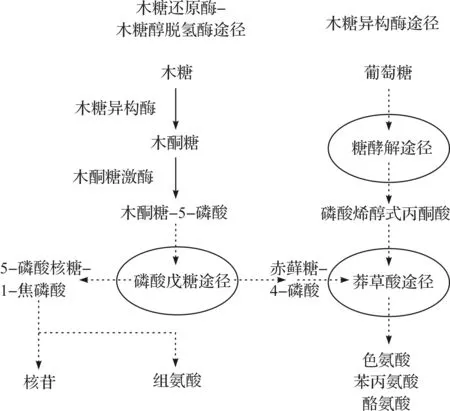
图1 微生物同步利用葡萄糖和木糖合成多种氨基酸和核苷产品 Fig.1 Microbial production of several amino acids and nucleosides through simultaneous utilization of glucose and xylose
2 碳分解代谢物阻遏CCR机制
目前,发酵生产氨基酸的菌种主要为大肠杆菌和谷氨酸棒杆菌,核苷类生产菌种主要为枯草芽孢杆菌(表1).大肠杆菌为革兰氏阴性菌,枯草芽孢杆菌和谷氨酸棒杆菌为革兰氏阳性菌,它们利用木糖都受到CCR调控,但具体机制有所差异.概括起来,细菌CCR调控木糖利用的机制包括以下3个方面:
1) 诱导物排阻(Inducer exclusion):当培养基中存在葡萄糖时,木糖向胞内转运受到抑制.
2) 木糖转运蛋白和木糖降解酶(XI和XK)的表达受阻遏调控:葡萄糖在转录水平负调控这些蛋白的表达;当培养基中缺乏葡萄糖、存在木糖时,木糖转运蛋白和XI、XK的转录被激活.
3) 木糖降解酶同时受到辅助蛋白的调控,在革兰氏阴性菌中,代谢物基因激活蛋白(Catabolite activator protein,CAP;也叫cAMP receptor protein,CRP)复合物激活木糖降解酶基因的转录;在革兰氏阳性菌中,代谢物控制蛋白(Catabolite control protein,CcpA)辅阻遏基因转录.
在大肠杆菌(Esherichiacoli)中,以上3种CCR调控机制都存在.1) 大肠杆菌木糖转运蛋白包括低亲和力的XylE和高亲和力的XylFGH,xylF编码周质木糖结合蛋白,xylG编码ATP酶,xylH编码透性酶[11].当木糖存在时,与转录因子XylR结合,激活xylE,xylFGH和xylAB的转录[12],然而当葡萄糖存在时,这些操纵子的转录受到抑制,可能是阻断了木糖的诱导作用.2) 大肠杆菌中,诱导物排阻(木糖摄取)的调控与磷酸烯醇式丙酮酸:葡萄糖磷酸转移酶系统(Phosphoenolpyruvate-glucose phosphotransferase system,PTS)相关联.通常,葡萄糖PTS转运系统由3类蛋白质构成:磷酸烯醇式丙酮酸依赖性蛋白激酶I(EI)、含组氨酸的磷酰基载体蛋白(HPr)和葡萄糖特异性酶II(EII).大肠杆菌EII包括两个蛋白:分别是crr编码的EIIA和ptsG编码的EIIBC(两个结构域),后者为跨膜蛋白,葡萄糖在通过EIIBC的过程中伴随着一系列的磷酸化反应,磷酸基团由PEP依次转移至EI,HPr,EIIA,EIIBC和底物葡萄糖.其中,EIIA是大肠杆菌CCR调控的关键因子,当葡萄糖存在时,由于具有更高的亲和力而结合大量磷酸基团,使得EIIA以去磷酸化的形式积累,去磷酸化的EIIA能够结合到XylE和XylH上,从而抑制木糖的跨膜运输.当培养基中缺乏葡萄糖时,EIIA以磷酸化形式大量存在,不能结合木糖转运蛋白,从而解除诱导物排阻.3) 此外,EIIA还在CRP-cAMP介导的转录激活中发挥重要作用.当葡萄糖缺乏时,磷酸化的EIIA激活腺苷酸环化酶,将ATP转化为cAMP,然后cAMP与CRP结合形成复合物,从而激活木糖转运和代谢相关操纵子的转录.
枯草芽孢杆菌(Bacillussubtilis)也存在上述3种CCR调控机制,但具体作用机理与大肠杆菌差异很大,且更复杂.1) 枯草芽孢杆菌的木糖代谢基因也形成操纵子xylAB,其表达受到阻遏蛋白XylR的严格调控,木糖的结合能够使XylR失去活性,从而诱导xylAB转录,但当葡萄糖或葡萄糖-6-磷酸存在时,其对XylR的亲和力比木糖要高,转录依然不能起始.枯草芽孢杆菌中,木糖转运蛋白为H+同向运输蛋白AraE,AraE为非特异性蛋白,可以转运阿拉伯糖、木糖和半乳糖.调控蛋白AraR阻遏araE的转录,调节AraR活性的底物为阿拉伯糖而非木糖,当阿拉伯糖存在时,AraR失去活性开启araE的转录.2) 枯草芽孢杆菌代谢物排阻也与PTS相偶联,不同的是其关键因子为HPr而非EIIA.HPr上组氨酸残基磷酸化后,将磷酸基团通过EIIBC传递给葡萄糖,同时HPr(His-P)与其他PTS系统的EIIBC相作用,阻断了其他糖类的跨膜运输.目前尚没有HPr(His-P)与AraE作用的报道.然而,当葡萄糖存在时,CcpA可以结合到araE的mRNA前导区,干扰转录延伸,使AraE不能正常表达[13].这可能是枯草芽孢杆菌排阻诱导物木糖的替代作用机制.3) HPr参与CcpA介导的转录阻遏调控,其中一个同源六聚体的双功能HPrK发挥重要作用.果糖-1,6-二磷酸或葡萄糖-6-磷酸浓度高时(表示糖酵解活性高),HPrK发挥激酶活性,磷酸化HPr上46位丝氨酸残基,HPr(46Ser-P)作为效应物使二聚体CcpA结合到有关操纵子上游代谢物阻遏元件(Catabolite repression element,cre)序列,抑制转录的起始[14].与之相反,当营养匮乏时,HPrK发挥磷酸化酶的活性,使得HPr丝氨酸残基去磷酸化,不能作为CcpA的辅因子调控转录.胞内无机磷的积累能够强化HPrK磷酸化酶的活性[15].
与大肠杆菌和枯草芽孢杆菌相比,谷氨酸棒杆菌(Corynebacteriumglutamicum)不存在典型的CCR调控系统.由于缺乏xylA,谷氨酸棒杆菌不能利用木糖,但其基因组上存在xylB.Kawaguchi等[16]在谷氨酸棒杆菌中过表达来源于大肠杆菌的xylA时,菌株能够以木糖为唯一碳源生长.谷氨酸棒杆菌缺乏CRP和CcpA,虽然相继利用葡萄糖和其他碳源,但不出现典型的二次生长[17],甚至可以同步代谢葡萄糖和乙酸、葡萄糖和葡萄糖酸[18-19].xylB的转录受到阻遏蛋白AltR的调控,木糖(或其代谢物木酮糖、阿拉伯糖醇)作用于AtlR可以激活转录,目前尚不清楚xylB是否受到葡萄糖的调控.然而,当培养基中存在葡萄糖时,木糖的代谢被抑制,可能的机制是诱导物排阻.但是,目前谷氨酸棒杆菌的木糖转运途径尚不清楚,我们推测与酿酒酵母(Saccharomycescerevisiae)和运动发酵单胞菌(Zymomonasmobilis)一样,木糖通过葡萄糖运输途径被吸收进胞内,因此,葡萄糖竞争性地抑制木糖的跨膜转运.表1汇总了大肠杆菌、枯草芽孢杆菌和谷氨酸棒杆菌木糖代谢、转运、CCR调控机制、关键因子以及破解策略等方面的异同.

表1 大肠杆菌、枯草芽孢杆菌和谷氨酸棒杆菌木糖利用相关特性
3 CCR解除策略及应用
目前,对解除大肠杆菌CCR、构建葡萄糖和木糖同步利用菌株的研究较多.根据大肠杆菌CCR机制,全局调控基因ptsG,crp和ccr成为首选代谢工程改造靶点.EIIBC(ptsG)缺失的大肠杆菌能够激活半乳糖透性酶来运输葡萄糖,虽然葡萄糖的利用受到一定影响,但菌株能够同步代谢葡萄糖和木糖,生长周期比对照缩短16%[20].同样,Nichols等[21]也发现ptsG突变菌株能够同步利用葡萄糖和木糖.从该菌株出发构建乳酸发酵菌,在葡萄糖存在的条件下,木糖消耗达到75%,而ptsG+对照菌只消耗了18%~20%的木糖[22].Cirino等[10]将crp基因替换为对胞内cAMP浓度不敏感的突变体,也实现了葡萄糖和木糖的同步利用.然而,这些改变全局调控因子的策略一定程度上影响了菌株对葡萄糖的正常摄入和代谢.换个角度,改变木糖利用操纵子的启动区域使其变为组成型表达也可能是解除CCR调控的一种策略.但是,Kim等[23]用合成启动子组成型表达xylAB,xylFGH和xylE,工程菌株AXcp出现严重的生长缺陷,于是他们采用定向进化的手段在木糖培养基上培养50 d,获得了生长性能回复并能高效同步利用葡萄糖和木糖的菌株GX50,测序并采用基因重建策略证明,该菌株pyrE基因突变可能是菌体生长回复的原因,xylA和araE上游非编码区发生了点突变,导致木糖代谢速率提高.可见,利用定性进化获得性状优良的菌株,然后采用反向遗传学手段重建工程菌也是重要的研究思路,将与理性从头设计相辅相成,发挥越来越重要的作用.
与大肠杆菌相比,有关枯草芽孢杆菌同步利用葡萄糖和木糖代谢工程的报道很少.由于枯草芽孢杆菌CCR调控机制更加复杂而严谨,目前尚无直接改造CCR全局性调控因子的研究.枯草芽孢杆菌中,木糖通过单一的蛋白AraE向胞内运输.Park等[24]将araE基因构建在xylA启动子和fba终止子之间,整合到B.subtilis168基因组上,菌株能够高效吸收木糖,但木糖的快速代谢还是发生在葡萄糖基本耗尽之时.同样,利用P43强启动子组成型表达AraE也取得很好的效果,同时过表达大肠杆菌来源的xylAB,菌株可以同步利用葡萄糖和木糖,但耗糖速率较低[25].
近年来,对谷氨酸棒杆菌葡萄糖和木糖共利用的代谢工程研究逐渐多了起来.Kawaguchi等[16]在C.glutamicumR菌株中过表达来源于大肠杆菌的xylA,菌株能够利用木糖作为唯一碳源生长,同时过表达xylA和xylB,菌体生长加快,且转换为厌氧条件时能够同步代谢5%的葡萄糖和2.5%的木糖.之后,他们将大肠杆菌xylAB串联整合到C.glutamicumR基因组上,结果表明整合5个拷贝数时菌株的木糖消耗速率最快,该菌转移至厌氧条件下12 h即可同步消耗完40 g/L葡萄糖和20 g/L木糖[26].国内,南京工业大学的学者对谷氨酸棒杆菌利用木糖进行了研究,Wang等[27]利用trc启动子将大肠杆菌的xylA和xylB在C.glutamicum13032中过表达,菌体转至厌氧条件发酵48 h,能够利用玉米芯水解液中55 g/L木糖和4 g/L葡萄糖生成40.8 g/L琥珀酸.上述研究均是在谷氨酸棒杆菌中异源表达木糖代谢操纵子,没有涉及内源xylB的转录控制和应用,同时并没有解除好氧条件下葡萄糖对木糖利用的抑制作用.我们推测,在厌氧条件下菌体TCA循环减弱导致胞内供能减少,影响了葡萄糖通过PTS进入细胞(该过程与磷酸化相偶联),从而使木糖向胞内的运输增加,实现了菌体对葡萄糖和木糖的共利用.目前,关于利用葡萄糖和木糖混合糖发酵生产氨基酸的报道较少[28].Gopinath等[29]过表达大肠杆菌的xylA来发酵水稻秸秆酸水解液,谷氨酸和赖氨酸产量分别为出发菌的4.8倍和2.9倍.Meiswinkel等[30]对不同来源的xylA和xylB组合进行了优化,分别以木糖和水稻秸秆水解液为碳源,谷氨酸、赖氨酸和鸟氨酸的生产强度都显著提高.
4 结 论
综上所述,微生物同步代谢葡萄糖和木糖在木质纤维素资源利用方面具有重要意义,其在芳香族氨基酸、组氨酸和核苷发酵中的特殊意义迫切需要证实.目前虽然有一些利用木糖发酵氨基酸的报道,但产量都非常低.原因首先是对构建同步利用葡萄糖和木糖菌株的代谢工程研究还不够深入,其次是在工业生产菌株中缺乏对这种策略的应用.笔者所在团队长期从事氨基酸和核苷的发酵,谷氨酸棒杆菌为重要的氨基酸生产菌,且与大肠杆菌和枯草芽孢杆菌相比,其葡萄糖效应的调控机制要简单得多,因此,我们正致力于谷氨酸棒杆菌同步利用葡萄糖和木糖的代谢工程改造及产业应用.然而,谷氨酸棒杆菌向胞内运输木糖的途径尚不清楚,成为重要的制约因素,目前的报道多是利用谷氨酸棒杆菌静息细胞可以高效合成产物的特性,在厌氧条件下发酵生产琥珀酸等有机酸.要获得真正在高耗氧条件下同步利用葡萄糖和木糖的菌株,并应用于氨基酸生产,还需要更加系统深入的研究.
[1] 李燕军,范晓光.氨基酸发酵工业中原料替代的思考[J].发酵科技通讯,2015,44(2):57-64.
[2] WYMAN C E. Potential synergies and challenges in refining cellulosic biomass to fuels, chemicals, and power[J].Biotechnology progress,2003,19(2):254-262.
[3] 王健,路鹏,张昕.氨基酸及衍生物生产——生物制造重要组成部分[J].发酵科技通讯,2016,45(1):7-11.
[4] BUSCHKE N, BECKER J, SCHFER R, et al. Systems metabolic engineering of xylose-utilizingCorynebacteriumglutamicumfor production of 1,5-diaminopentane[J].Biotechnology journal,2013,8(5):557-570.
[5] KUHAD R C, GUPTA R, KHASA Y P, et al. Bioethanol production from pentose sugars: Current status and future prospects[J].Renewable and sustainable energy reviews,2011,15(9):4950-4962.
[6] SCALCINATI G, OTERO J M, VAN VLEET J R, et al. Evolutionary engineering ofSaccharomycescerevisiaefor efficient aerobic xylose consumption[J].FEMS yeast research,2012,12(5):582-597.
[8] LI K, FROST J. Microbial synthesis of 3-dehydroshikimic acid: a comparative analysis of D-xylose, L-arabinose, and D-glucose carbon sources[J].Biotechnology progress,2008,15(5):876-883.
[9] WULF P D, SOETAERT W, SCHWENGERS D, et al. D-Glucose does not catabolite repress a transketolase-deficient D-ribose-producingBacillussubtilismutant strain[J].Journal of industrial microbiology and biotechnology,1996,17(2):104-109.[10] CIRINO P C, CHIN J W, INGRAM L O. EngineeringEscherichiacolifor xylitol production from glucose-xylose mixtures[J].Biotechnology and bioengineering,2006,95(6):1167-1176.
[11] SUMIYA M, DAVIS E O, PACKMAN L C, et al. Molecular genetics of a receptor protein for D-xylose, encoded by the genexylF, inEscherichiacoli[J].Receptors channels,1995,3(2):117-128.
[12] SONG, S, PARK C. Organization and regulation of the D-xylose operons inEscherichiacoliK-12: XylR acts as a transcriptional activator[J].Journal of bacteriology,1997,179(22):7025-7032.
[14] DEUTSCHER J, KÜSTER E, BERGSTEDT U, et al. Protein kinase-dependent HPr/CcpA interaction links glycolytic activity to carbon catabolite repression in Gram-positive bacteria[J].Molecular microbiology,1995,15(6):1049-1053.
[15] MIJAKOVIC I, PONCET S, GALINIER A, et al. Pyrophosphate-producing protein dephosphorylation by HPr kinase/phosphorylase: a relic of early life?[J].Proceedings of the national academy of sciences of the United States of America,2002,99(21):13442-13447.
[16] KAWAGUCHI H, VERTS A A, OKINO S, et al. Engineering of a xylose metabolic pathway inCorynebacteriumglutamicum[J].Applied and environmental microbiology,2006,72(5):3418-3428.
[17] ENGELS V, WENDISCH V F. The DeoR-type regulator SugR represses expression ofptsGinCorynebacteriumglutamicum[J].Journal of bacteriology,2007,189(8):2955-2966.
[18] WENDISCH V F, GRAAF A A D, SAHM H, et al. Quantitative determination of metabolic fluxes during coutilization of two carbon sources: comparative analyses withCorynebacteriumglutamicumduring growth on acetate and/or glucose[J].Journal of bacteriology,2000,182(11):3088-3096.
[19] FRUNZKE J, ENGELS V, HASENBEIN S, et al. Co-ordinated regulation of gluconate catabolism and glucose uptake inCorynebacteriumglutamicumby two functionally equivalent transcriptional regulators, GntR1 and GntR2[J].Molecular microbiology,2008,67(2):305-322.
[21] NICHOLS N N, DIEN B S, BOTHAST R J. Use of catabolite repression mutants for fermentation of sugar mixtures to ethanol[J].Applied microbiology and biotechnology,2001,56(1/2):120-125.
[22] DIEN B S, NICHOLS N N, BOTHAST R J. Fermentation of sugar mixtures usingEscherichiacolicatabolite repression mutants engineered for production of lactic acid[J].Journal of industrial microbiology and biotechnology,2002,29(5):221-227.[23] KIM S M, CHOI B Y, RYU Y S, et al. Simultaneous utilization of glucose and xylose via novel mechanisms in engineeredEscherichiacoli[J].Metabolic engineering,2015,30:141-148.
[24] PARK Y C, JUN S Y, SEO J H. Construction and characterization of recombinantBacillussubtilisJY123 able to transport xylose efficiently[J].Journal of bacteriology,2012,161(4):402-406.
[25] CHEN Tao, LIU Weixi, FU Jing, et al. EngineeringBacillussubtilisfor acetoin production from glucose and xylose mixtures[J].Journal of biotechnology,2013,168(4):499-505.
[26] SASAKI M, JOJIMA T, INUI M, et al. Simultaneous utilization of D-cellobiose, D-glucose, and D-xylose by recombinantCorynebacteriumglutamicumunder oxygen-deprived conditions[J].Applied microbiology and biotechnology,2008,81(4):691-699.
[27] WANG Chen, ZHANG Hengli, CAI Heng, et al. Succinic acid production from corn cob hydrolysates by genetically engineeredCorynebacteriumglutamicum[J].Applied biochemistry and biotechnology,2014,172(1):340-350.
[28] 陈宁,范晓光.氨基酸生产菌株的研究热点及发展动向[J].发酵科技通讯,2016,45(1):1-6.
[29] GOPINATH V, MEISWINKEL T M, WENDISCH V F, et al. Amino acid production from rice straw and wheat bran hydrolysates by recombinant pentose-utilizingCorynebacteriumglutamicum[J].Applied microbiology and biotechnology,2011,92(5):985-996.
[30] MEISWINKEL T M, GOPINATH V, LINDNER S N, et al. Accelerated pentose utilization byCorynebacteriumglutamicumfor accelerated production of lysine, glutamate, ornithine and putrescine[J].Microbial biotechnology,2013,6(2):131-140.
(责任编辑:朱小惠)
Overview of metabolic engineering on simultaneous utilization of glucose and xylose by microbes
LI Yanjun1,2,3, ZHAO Yan1,2,3, HUANG Longhui1,2,3, LI Juan1,2,3, XIE Xixian1,2,3, CHEN Ning1,2,3
(1. National and Local United Engineering Lab of Metabolic Control Fermentation Technology, Tianjin 300457, China; 2. Tianjin Engineering Lab of Efficient and Green Amino Acid Manufacture, Tianjin 300457, China; 3. College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)
At present, as the resource exhaustion and environment pollution problems become more and more serious, the production of bioproducts including biofules and biomaterials from agricultural waste and other lignocellulosic feedstocks has attracted a great deal of attention. The microbial co-utilization of glucose and xylose is essential in lignocellulose biorefinery, and meanwhile is beneficial in improving fermentation performance for aromatic amino acids. Nevertheless, because of the existence of carbon catabolite repression (glucose effect), most microbes don’t have this ability. Therefore, it is urgent to construct strains that simultaneously use glucose and xylose by metabolic engineering technologies. In this study, the significance of simultaneous utilization of glucose and xylose by microbes was stated, as well as the mechanisms of glucose effect and its break-down methods in amino acids and nucleotides producing strains such asEsherichaicoli,Bacillussubtilis, andCorynebacteriumglutamicumwere elaborated. In addition, the applications of glucose and xylose co-metabolizing strains were introduced.
xylose; amino acid;Escherichiacoli;Bacillussubtilis;Corynebacteriumglutamicum; carbon catabolite repression
2016-05-16
国家自然科学基金青年科学基金资助项目(31500026);中国博士后科学基金资助项目(2016M601269)
李燕军(1983—),男,山西吕梁人,讲师,博士,研究方向为谷氨酸棒杆菌代谢工程,E-mail:yili@tust.edu.cn.
Q591
A
1674-2214(2017)01-0054-06

