ABCC10在浸润性乳腺癌中的表达及耐药研究
陈 飞, 路 选, 王 颖
(扬州大学附属医院, 江苏 扬州, 225001)
ABCC10在浸润性乳腺癌中的表达及耐药研究
陈 飞, 路 选, 王 颖
(扬州大学附属医院, 江苏 扬州, 225001)
乳腺癌; 化疗; 耐药
乳腺癌最重要的全身治疗手段之一就是化疗,但化疗的疗效往往由于肿瘤细胞对化疗药物的耐药而降低,所以研究清楚乳癌细胞对化疗耐药的原因则显得尤为重要,目前的研究着重于肿瘤耐药基因及其相关蛋白[1]。研究[2]表明ABC家族膜转运体在导致肿瘤细胞耐药的过程中扮演着重要的角色,ABC膜转运蛋白家族即ATP结合盒(ABC)膜转运蛋白家族,其耐药机制为通过膜转运蛋白,把化疗药物从细胞内转运至细胞外,细胞内化疗药物浓度减小,对肿瘤的杀伤能力减少,从而造成耐药。ABC家族的一个亚家族(C族)也称为多药耐药相关蛋白(MRP)家族,人类ABCC10(MRP7)是MRP家族最新发现的成员[3]。但ABCC10与乳腺癌的关系研究甚少,本研究探讨乳腺癌中ABCC10的表达以及对常见乳癌化疗药物的耐药,现报告如下。
1 资料与方法
1.1 标本来源
收集2014年11月—2015年11月本院乳腺外科浸润性乳腺癌组织手术切除标本及相应正常组织55例。患者平均年龄( 56.13±8.70)岁,中位年龄61岁。其中髓样癌3例,黏液癌1例,浸润性导管癌51例,手术前患者均未行化疗或放疗。术后即刻将标本置于预先盛有无菌RPMI1640 培养液的无菌管中,部分新鲜癌组织用于化疗药物药敏试验,将相应标本用10%甲醛固定,经脱水、透明,常规石蜡包埋。由病理科经验丰富医师进行癌组织病理分类、分级诊断,术后进行TNM 分期。
1.2 试剂
ABCC10兔抗人多克隆抗体及二抗购自上海昕浩生物科技有限公司,RPMI1640、胎牛血清购自美国Hyclone公司,胰蛋白酶和购自Thermo Fisher公司,紫杉醇、多西他赛购自扬子江药业,表阿霉素、环磷酰胺、吉西他滨、长春瑞滨分别购自辉瑞制药有限公司、德国BAXTER ONCOLO公司、江苏豪森药业、吉林一心药业公司。MTT和DMSO购自Sigma公品。免疫组化试剂盒购自美国Gene Tec公司。
1.3 方法
1.3.1 癌组织药物敏感实验: 将新鲜癌破碎,反复冲洗匀浆,用尼龙膜过滤破碎的组织液,用RPMI1640完全培养液调整组织液中细胞浓度到105/mL,台盼蓝染色计数;将细胞悬液接种于96孔培养板,190 μL/孔,分空白组、对照组和实验组(实验组包括高浓度和低浓度组),每组设4个复孔;在37 ℃、5% CO2培养箱培养24 h, 分别加入上述各种化疗药10 μL, 使高浓度组的终浓度为人体血药浓度。阴性对照孔和空白孔加10 μL RPMI 1640,培养48 h后每孔加入5 mg/mL的MTT 20 μL, 接着培养4 h。去上清,每孔加入DMSO 150 μL, 使之混匀,培养板振荡10 min, 使孔中沉淀完全溶解。置于酶标仪,读取波长570 nm处各孔吸光度值。
1.3.2 ABCC10蛋白检测: 标本石蜡包埋后,经5 μm连续切片,分别做HE和免疫组化染色。免疫组化染色采用两步法: 切片脱蜡至水,尿素消化,3%过氧化氢封闭,用柠檬酸缓冲液进行微波加热煮沸进行抗原修复,冷却至室温,加兔血清孵育,加一抗(1︰200) 4 ℃ 过夜后,取出37 ℃ 复温, PBS 冲洗3次,每次5 min, 加入山羊二抗(En Vision), 37 ℃恒温反应(中间各步用PBS 洗),加DAB 显色,用苏木精轻微复染,脱水、透明及封片,在光镜下观察。对照组设正常组织和空白(以PBS代替一抗)对照。
1.4 判定标准
以IR数值作为药物敏感性的判断标准,IR<30%为耐药, 31%~50%低度敏感,51%~70% 为中度敏感,>70%高敏[4]。药物抑制率(IR)=(对照组OD值-药物组OD值)/(对照组OD值-空白组OD值)×100%。免疫组化结果判定: 以细胞膜及胞质中出现均匀一致的棕黄色颗粒为ABCC10阳性细胞,在400倍的光学显微镜下,每例均随机选取5个视野,用二级计分法计算结果,取平均值。阳性细胞比得分(5%为0分,5%~25%为1分,26%~50%为2分, 51%~75%为3分, >75%为4分)乘以染色强度得分(淡黄色为1分,黄色及深黄色为2分,褐色及深褐色为3分),结果0分为阴性(-), 1~4分为弱阳性(+), 5~8分为中度阳性(2+),9~12分为强阳性(3+) 。
1.5 统计学方法
采用非参数检验的方法对癌组织的组织学类型TNM分期以及病理分级进行单因素分析。癌组织耐药性试验结果与其相应组织ABCC10表达进行Spearman秩相关检验,以rs表示秩相关系数。使用SPSS 17.0软件进行统计学处理。
2 结 果
2.1 免疫组化结果和ABCC10 的表达与临床病理因素的关系
免疫组化结果显示, ABCC10阳性表达主要定位于胞膜上和胞质中。阳性表达率为67.3%, 不同病理分级、TNM分期之间ABCC10的表达差异均有统计学意义(P<0.05); 病理分级、TNM分期越高, ABCC10表达的阳性率越高。见表1。
2.2 化疗药物敏感性检测结果与ABCC10表达的相关性
浸润性乳腺癌组织对6种常见化疗药物的耐药性检测结果与其相应组织中ABCC10的表达做相关性分析,见表2。
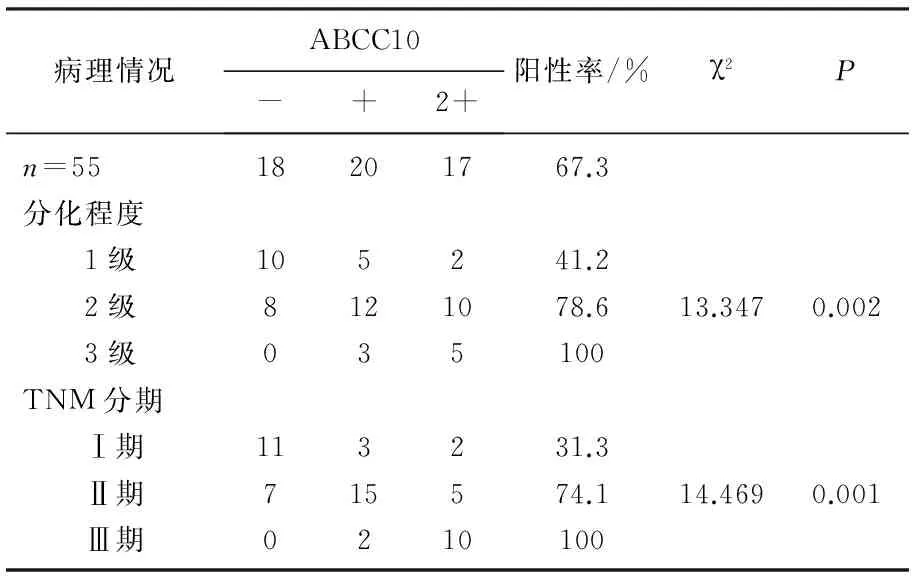
表1 乳癌组织中ABCC10的表达与临床病理因素的关系

表2 ABCC10 在乳腺癌表达与药物敏感相关性
3 讨 论
目前乳腺癌的治疗,包括局部治疗和全身治疗,既要求标准化,又强调与个体化,其中化疗是乳腺癌全身治疗的重要组成部分。研究证明多药耐药(MDR)成为化疗失败的重要原因。MDR, 即肿瘤细胞一旦对一种抗癌药物产生耐药,就可能对非同一类型的多种结构、细胞靶点和作用机制迥然不同的药物也产生耐药。耐药相关标志与治疗药物或化疗方案密切相关且非常复杂[4-5]。研究发现ABC家族介导的药物外排在MDR中起了重要作用,人类 ABCC10是新近发现的 ABC 家族成员。研究[6-8]表明ABCC10的水平不但能够影响肿瘤的生物学行为,也可以调节多种化疗药物对恶性肿瘤细胞的敏感性,其主要的作用机制是使得细胞内化疗药物外排[9]。在对肺癌、头颈部恶性肿瘤的研究中,都看到了类似的结果[10-11], 但ABCC10在乳腺癌中的研究甚少。
本实验运用免疫组化法证明了ABCC10在乳腺癌组织中有过表达现象, ABCC10在阳性表达率为67.3%, 不同病理分级、TNM分期之间ABCC10的表达差异均有统计学意义(P<0.05), 并且组织学分级、TNM分期越高, ABCC10表达的阳性率越高。提示ABCC10 与乳腺癌的恶性程度,有一定的相关性,可能与乳腺癌的发生、发展过程具有某种联系。
[1] 赵宇斌, 张少华, 王金清, 等. 乳腺癌组织EphA2和EphrinA1蛋白表达及临床意义的探讨[J]. 中华肿瘤防治杂志, 2011, 18(7): 513-516.
[2] Kruh G D, Belinsky M G. The MRP family of drug efflux pumps[J]. Oncogene, 2003, 22(47): 7537-7552.
[3] Kao H H, Chang M S, Cheng J F, et al. Genomic structure, gene expression, and promoter analysis of human multidrug resistance-associated protein 7[J]. J Biomed Sci, 2003, 10(1): 98-110.
[4] Jian H J, Jin Q C, Long Y J, et al. Breast cancer resistance protein expression and 5-Fluorouracil resistance[J]. Bio Envir Sci, 2008, 21(2): 290-295.
[5] Rodrigues F F, Santos R E, Melo M B, et al. Correlation of polymorphism of the MDR-1 gene and the response of primary chemotherapy in women with locally advanced breast cancer[J]. Genet Mol Res, 2008, 7(1): 177-183.
[6] Domanitskaya N, Wangari-Talbot J, Jacobs J, et al. Abcc10 status affects mammary tumour growth, metastasis, and docetaxel treatment response[J]. British journal of cancer, 2014, 111(4): 696-707.
[7] Kathawala R J, Wei L, Anreddy N, et al. The small molecule tyrosine kinase inhibitor NVP-BHG712 antagonizes ABCC10-mediated paclitaxel resistance: a preclinical and pharmacokinetic study [J]. Oncotarget 2015, 6(1): 510-521.
[8] Wijnholds J. Drug resistance caused by multidrug resistance-associated proteins [J]. Novartis Foundation symposium, 2002, 243: 69-79, 80-62, 180-185.
[9] Huang Y, Sadee W. Membrane transporters and channels in chemoresistance and sensitivity of tumor cells [J]. Cancer Lett, 2006, 239( 2): 168-182.
[10] 王鹏, 张志培, 王小平, 等. 非小细胞肺癌组织ABCC10的表达及其与耐药相关性的研究[J]. 中华肿瘤防治杂志, 2010, 17(8): 605-608.
[11] Naramoto H, Uematsu T, Uchihashi T, et al. Multidrug resistance associated protein 7 express ion is involved in cross-resistance to docetaxel in salivary gland adeno carcinoma cell lines[J]. Int J Oncol, 2007, 30( 2): 393-401.
2016-11-23
R 737.9
A
1672-2353(2017)05-177-02
10.7619/jcmp.201705059

