NEP1-40对缺氧缺血性脑病新生大鼠的Wnt信号通路胞增殖的调控作用
王 骅, 王静成, 王永祥, 王大新, 陶玉平,冯新民, 熊传芝, 顾加祥, 何金山
(江苏省苏北人民医院 骨科, 江苏 扬州, 225000)
论 著
NEP1-40对缺氧缺血性脑病新生大鼠的Wnt信号通路胞增殖的调控作用
王 骅, 王静成, 王永祥, 王大新, 陶玉平,冯新民, 熊传芝, 顾加祥, 何金山
(江苏省苏北人民医院 骨科, 江苏 扬州, 225000)
目的 探讨Nogo-A受体拮抗剂NEP1-40对Wnt信号通路和神经细胞增殖的调控作用。方法 40只大鼠被均分为HIBD(缺氧缺血性脑损伤)组和HIBD+NEP1-40组,采用PCR定量、Western blot分析、细胞增殖的免疫组化试验、8-异前列腺素评估等检测分析缺氧缺血性脑病新生大鼠的修复过程中Wnt信号通路中NgR的转录因子调控与神经细胞增殖。结果 NEP1-40处理后, cJun和c-Myc的表达在蛋白水平上调,基因表达水平上调, Ki-67增加, 8-异前列腺素无显著变化。结论 通过抑制NgR后发现, c-Jun和c-Myc是Wnt通路的主要转录因子,同时脑室下区神经细胞的增殖增加。
缺氧缺血性脑病; Wnt信号通路; Nogo-A; NEP1-40; 神经细胞增殖
缺氧缺血性脑病(HIE)是由于各种围生期因素引起的脑缺氧或缺血而形成的常见脑损伤。对于HIE新生儿来说,神经细胞再生是一个至关重要的受损脑组织修复过程[1]。抑制剂能降低中枢神经系统(CNS)的自我修复能力,其中Nogo A尤为重要[2]。Nogo A是已知的特定中枢神经系统神经突起生长的抑制剂,它属于编码网状组织的基因家族,与内质网有关[3]。中枢神经系统损伤后, Nogo A抑制神经元轴突再生及其突触的重塑[4], 也可能抑制高等脊椎动物中枢神经系统的再生[5]。Kmari等[6]应用RT-PCR对正常老化的小鼠脑组织Nogo A蛋白和mRNA水平进行分析,证实Nogo A蛋白水平在衰老过程中具有改变突触可塑的作用。Nogo A基因敲除成年小鼠中枢神经系统轴突导向因子增加,在体内促进轴突的再生[7]。 Nogo-66受体(NgR)连同少突神经细胞-髓磷脂糖蛋白和髓鞘相关糖蛋白共同介导抑制轴突生长,调节成人中枢神经系统的轴突再生及可塑性[8-9]。Wnt信号通路调控着胚胎以及成人的细胞与细胞间联系,包括在发育和修复期间的细胞增殖和分化[10]。研究[11]表明, Wnt信号通路参与了由Nogo介导的神经细胞再生,但其机制仍然未知。本实验使用NgR的拮抗剂NEP1-40, 研究其对受损中枢神经的再生及相关转录因子(TF)的作用,现报告如下。
1 材料与方法
1.1 构建动物模型和药物治疗
采用新生雄性Wistar大鼠40只(7 d龄,体质量为(16±3.0) g, 扬州大学的动物研究中心提供)。新生缺氧缺血性脑病大鼠动物模型按经典法构建,该法由Vannucci于1981年在Levine的成年大鼠缺氧缺血性脑损伤模型基础上经过改进而建成,至今在全世界被广泛应用。其具体操作方法如下:生后7 d大鼠麻醉后行左颈总动脉结扎术,术后恢复4~8 h后置于氧浓度为8%、环境温度为37 ℃的密闭容器内持续缺氧3.5 h, 构建后被命名为缺氧缺血性脑损伤(HIBD)大鼠[12]。40只大鼠被分为HIBD组和HIBD + NEP1-40组,每组20只,NEP1-40处理7 d。
1.2 PCR定量
采用TRIzol(Invitrogen, 美国)分离大脑总RNA。采用PCR芯片(SABiosciences, 美国)用于检测大鼠Wnt信号通路,其中包含APC、APC2、CCND1、CCND2、CCND3、CTNNB1、EP300、FGF4、FZD3、c-Jun、LRP5基因, c-Myc、Ppp2ca、PPP2R1A、WISP1、Wnt3a。采用cDNA合成装备(Invitrogen, 美国)逆转录后,使用ABI Prism SDS 7000 (Applied Biosystems, 美国) 将所有的产物都用作实时PCR模板。步骤如下: ① 50 ℃ 2 min, 1循环; ② 95 ℃ 10 min, 1循环; ③ 95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s, 40循环; ④ 72 ℃ 10 min, 1循环。
1.3 Western blot分析
脑的总蛋白提取物(12 μg)加入4×缓冲液, 100 ℃煮5 min, 然后经10% SDS-PAGE凝胶(Invitrogen, 美国)。凝胶电泳后,转移到NE膜(70 V, 2 h, 4 ℃)。5%脱脂牛奶封闭1 h后,膜用APC、EP300、c-Jun、c-Myc、Wnt3a的一抗(兔多克隆抗体IgG,Millipore)孵育, 3% BSA,根据实时PCR, 4℃ 过夜。1×TPBS洗涤后(pH 7.4), 膜与二抗(羊抗兔IgG)在室温条件下孵育1 h, 1×TPBS再洗涤(pH 7.4), 拍摄照片(Kodak, 美国)用于分析。β-肌动蛋白作为阴性对照。
1.4 细胞增殖的免疫组化试验
脑提取物通过免疫组化检测Ki67的表达。制备了12 μm冰冻鼠脑冠状切片(Leica), Ki67染色(Abcam、1∶1 000), 评估脑室下区神经干细胞的增殖。在激光共聚焦显微镜下拍摄的照片,背景为暗(Nikon, 100×)。
1.5 8-异前列腺素评估检测
脑组织在加蛋白酶抑制剂(1∶1 000, Invitrogen, 美国)的TBS缓冲液中磨碎, 12 000 g/min 4 ℃离心40 min。上清液转移至另一管。活性氧ROS的特殊标记物8-异前列腺素水平,按照流程用试剂盒(Cayman Chemical Company, 美国)测定。
1.6 统计学分析
采用SPSS 13.0进行统计,所有数据以均数±标准差表示,结果用t检验进行评价。P<0.05为差异有统计学意义。
2 结 果
2.1 NEP1-40对基因表达的影响
HIBD组APC、EP300、c-Jun、c-Myc、Wnt3a基因表达明显增加(>1.35 fold), 而HIBD + NEP1-40组, CCND2、WISP1 用NEP1-40处理7 d后减少(<0.75 fold)。而其他基因无显著变化(>1.5 fold或<0.75 fold)。HIBD组值设定为1, HIBD + NEP1-40组与HIBD组相比得出相对值。所有的数据分析见图1。
2.2 NEP1-40对蛋白表达的影响
Western blot分析见图 2, NEP1-40处理7 d后, cJun和c-Myc的表达在蛋白水平上调(>1.5 fold), 基因表达有相同的变化。然而APC、EP300、Wnt3a、CCND2、WISP1, 表达无明显变化(>1.35 fold或<0.75 fold), 基因表达完全不同。HIBD组值设定为1, 而HIBD + NEP1-40组与HIBD组相比得相对值。见图3。

a:>1.35fold;b:<0.75fold;*P<0.05;**P<0.01图1 HIBD组与HIBD+NEP1-40组的基因表达对比分析

左:HIBD+NEP1-40组;右:HIBD组图2 Westernblot分析结果

a:>1.35fold;*P<0.05;**P<0.01图3 HIBD组与HIBD+NEP1-40组的蛋白表达对比分析
2.3 8-异前列腺素的检测分析
8-异前列腺素是检测组织器官中氧化应激的一个理想的生物标志物。HIBD + NEP1-40组和HIBD组之间无显著的变化。本研究表明NEP1-40不能调节缺氧缺血性脑病中枢神经系统的氧化应激。HIBD组值设定为1, 而HIBD + NEP1-40组与HIBD组相比得相对值。见图4。

图4 HIBD组与HIBD+NEP1-40组的8-isoprostane检测对比分析
2.4 神经细胞再生的分析
如图5(Bar: 200 μm)箭头所示Ki67, 在成人大脑中的神经细胞增殖的脑室下区, HIBD + NEP1-40组(图5 A)与HIBD组(图5 B)相比神经细胞的再生增加,或许有助于修复损伤的中枢神经系统。促进神经细胞的增殖对缺氧缺血性脑病患者的治疗是一种潜在有效的方法。脑室下区Ki67的表达HIBD组值设定为1, 而HIBD + NEP1-40组与HIBD组相比得出相对值。见图6。
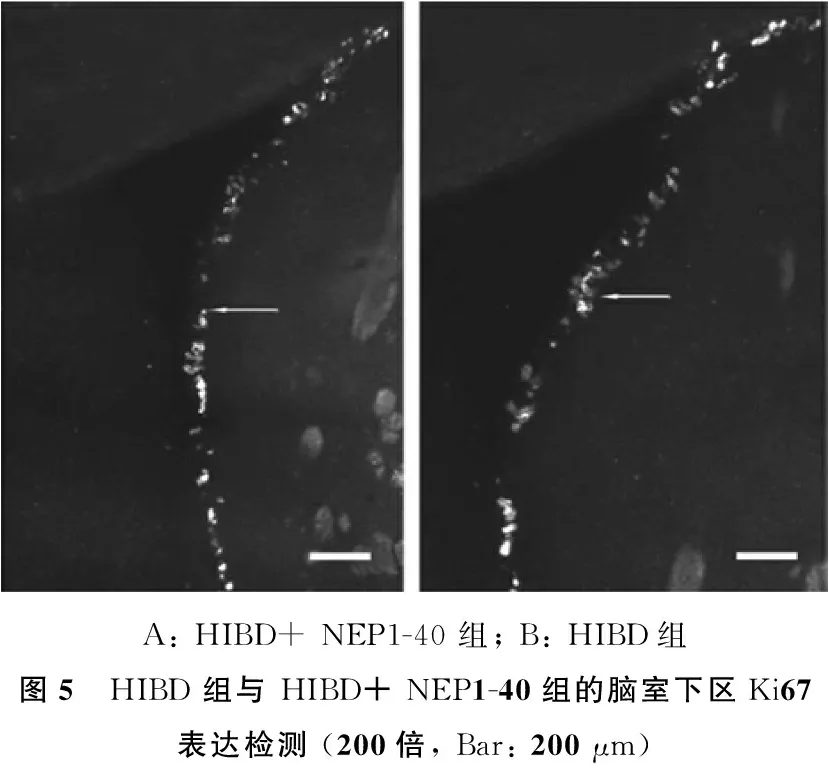
A:HIBD+NEP1-40组;B:HIBD组图5 HIBD组与HIBD+NEP1-40组的脑室下区Ki67表达检测(200倍,Bar:200μm)

图6 HIBD组与HIBD+NEP1-40组的脑室下区Ki67表达对比分析(*P<0.05)
3 讨 论
许多蛋白质都参与了神经内分泌或神经内分泌细胞中的膜转运, Nogo蛋白是其中之一[13]。Nogo-A具有2个已知的抑制作用域,包括氨基-Nogo(位于N-末端)和Nogo-66[5]。神经细胞损伤时阻断 Nogo-A蛋白将有助于保护或修复受损的神经细胞。Nogo-66受体(NgR)对于Nogo蛋白的一个特定区域是一种高亲和力结合受体,这个区域是一种抑制轴突生长的髓磷脂相关蛋白[14]。NgR关乎到神经细胞的可塑性和再生性[15]。Wnt信号通路在胚胎发育、细胞分化、细胞极性生成中发挥着多种重要作用[16], 尤其是转移神经管腹侧基因至背区[17]。在本研究中,发现c-Jun和c-Myc大多上调。c-Jun在整个月经周期对子宫内膜细胞的增殖和凋亡有重要作用[18]。c-Jun蛋白水平的周期性变化对腺上皮细胞增殖凋亡具有显著意义[19]。c-Myc通过结合增强子Box序列和召集组蛋白乙酰转移酶(HATs)激活大量的基因表达[20], 在各种有丝分裂信号包括 Wnt信号通路激活[21]。
8-异同前列腺素是一种理想的氧化应激标志物,其浓度变化可在不稳定的氧化应激中检测到[22]。本研究表明, 2组间8-异同前列腺素无明显变化。这一结果表明氧化应激与神经细胞损伤和神经细胞修复无关或未参与Nogo-A的抑制。Ki-67是细胞增殖标记物,与细胞增殖和细胞周期中各阶段(G1, S, G2, 有丝分裂)密切相关,但与休眠细胞(G0)无关[23]。HIBD + NEP1-40组可检测到Ki-67增加,意味着在大脑中的神经细胞增殖的地方脑室下区发生了神经细胞再生的增加。促进神经细胞增殖是一个潜在有效的方法治疗HIE患者,有待进一步研究。
本研究主要集中在Nogo-A受体拮抗剂NEP1-40对调控Wnt信号通路与新生缺氧缺血性脑病大鼠神经细胞的增殖的影响,通过抑制NgR发现, c-Jun和c-Myc是Wnt通路的主要转录因子,而发生在脑室下区的神经细胞的增殖在此过程中增加。
[1] Pietrini D, Piastra M, Luca E, et al. Neuroprotection and hypothermia in infants and children[J]. Curr Drug Targets, 2012, 13(7): 925-935.
[2] Pernet V, Schwab M E. The role of Nogo-A in axonal plasticity, regrowth and repair[J]. Cell Tissue Res, 2012, 349(1): 97-104.
[3] Skaper S D. Neuronal growth-promoting and inhibitory cues in neuroprotection and neuroregeneration[J]. Methods Mol Biol, 2012, 846: 13-22.
[4] Zemmar A, Weinmann O, Kellner Y, et al. Neutralization of Nogo-A enhances synaptic plasticity in the rodent motor cortex and improves motor learning in vivo[J]. J Neurosci, 2014, 34(26): 8685-8698.
[5] Borrie S C, Baeumer B E, Bandtlow C E. The Nogo-66 receptor family in the intact and diseased CNS[J]. Cell Tissue Res, 2012, 349(1): 105-117.
[6] Kumari A, Thakur M K. Age-dependent decline of nogo-a protein in the mouse cerebrum[J]. Cell Mol Neurobiol, 2014, 34(8): 1131-1141.
[7] Kempf A, Montani L, Petrinovic M M, et al. Upregulation of axon guidance molecules in the adult central nervous system of Nogo-A knockout mice restricts neuronal growth and regeneration[J]. Eur J Neurosci, 2013, 38(11): 3567-3579.
[8] McDonald C L, Bandtlow C, Reindl M. Targeting the Nogo receptor complex in diseases of the central nervous system[J]. Curr Med Chem, 2011, 18(2): 234-244.
[9] Cao Z, Gao Y, Deng K, et al. Receptors for myelin inhibitors: Structures and therapeutic opportunities[J]. Mol Cell Neurosci, 2010, 43(1): 1-14.
[10] Budnik V, Salinas P C. Wnt signaling during synaptic development and plasticity[J]. Curr Opin Neurobiol, 2011, 21(1): 151-159.
[11] Cerpa W, Toledo E M, Varela-Nallar L, et al. The role of Wnt signaling in neuroprotection[J]. Drug News Perspect, 2009, 22(10): 579-591.
[12] Cao Y, Shumsky J S, Sabol M A, et al. Nogo-66 receptor antagonist peptide (NEP1-40) administration promotes functional recovery and axonal growth after lateral funiculus injury in the adult rat[J]. Neurorehabil Neural Repair, 2008, 22(3): 262-278.
[13] Llorens F, Gil V, del Río JA. Emerging functions of myelin-associated proteins during development, neuronal plasticity, and neurodegeneration[J]. FASEB J, 2011, 25(2): 463-475.
[14] Teng F Y, Tang B L. Nogo-A and Nogo-66 receptor in amyotrophic lateral sclerosis[J]. J Cell Mol Med, 2008, 12(4): 1199-1204.
[15] Zhang S, Zhang Q, Zhang J H, et al. NgR acts as an inhibitor to axonal regeneration in adults[J]. Front Biosci, 2008, 13: 2030-2040.
[16] Cadigan K M. TCFs and Wnt/β-catenin signaling: more than one way to throw the switch[J]. Curr Top Dev Biol, 2012, 98: 1-34.
[17] Clevers H, Nusse R. Wnt/β-catenin signaling and disease[J]. Cell, 2012, 149(6): 1192-1205.
[18] Otsuki Y. Apoptosis in human endometrium: apoptotic detection methods and signaling[J]. Med Electron Microsc, 2001, 34(3): 166-173.
[19] Doucas H, Garcea G, Neal C P, et al. Changes in the Wnt signalling pathway in gastrointestinal cancers and their prognostic significance[J]. Eur J Cancer, 2005, 41(3): 365-379.
[20] Honeycutt K A, Roop D R. c-Myc and epidermal stem cell fate determination[J]. J Dermatol, 2004, 31(5): 368-375.
[21] Katoh M, Katoh M. WNT signaling pathway and stem cell signaling network[J]. Clin Cancer Res, 2007, 13(14): 4042-4045.
[22] Kim H S, Lee K, Kang K A, et al. Phloroglucinol exerts protective effects against oxidative stress-induced cell damage in SH-SY5Y cells[J]. J Pharmacol Sci, 2012, 119(2): 186-192.
[23] Lin T, Liu Y, Shi M, et al. Promotive effect of ginsenoside Rd on proliferation of neural stem cells in vivo and in vitro[J]. J Ethnopharmacol, 2012, 142(3): 754-761.
Role of NEP1-40 in regulation of Wnt signaling pathway and regeneration of neural cells in neonatal rats with hypoxic ischemic encephalopathy
WANG Hua, WANG Jingcheng, WANG Yongxiang, WANG Daxin,TAO Yuping, FENG Xinmin, XIONG Chuanzhi, GU Jiaxiang, HE Jinshan
(DepartmentofOrthopedics,SubeiPeople′sHospital,Yangzhou,Jiangsu, 225000)
Objective To explore the role of Nogo-A receptor antagonist NEP1-40 in regulating regeneration of neural cells and related Wnt signaling pathway in neonatal rats with hypoxic ischemic encephalopathy (HIBD). Methods A total of 40 HIBD rats were divided into HIBD group and HIBD+ NEP1-40 group, 20 rats in each group. PCR Test, Western Blot Analysis, IHC test for cell proliferation and 8-isoprostane detection were used to evaluate regulation of NgR transcription factors in Wnt signaling pathway and proliferation of neural cells. Results The expressions of c-Jun and c-Myc, at the protein level, were up-regulated after treatment with Nogo-A receptor antagonist NEP1-40 for 7 days, and the same change was observed at gene expression and Ki-67. There was no significant change of 8-isoprostane. Conclusion The c-Jun and c-Myc are the main transcription factors in Wnt signaling pathway by inhibition of NgR, and meanwhile the proliferation of nerve cells in subventricular zone increase.
hypoxic ischemic encephalopathy; Wnt signaling pathway; Nogo-A; NEP1-40; neural cell proliferation
2016-11-21
江苏省扬州市社会发展科技攻关资助项目(YZ2011082); 江苏省科技支撑计划-社会发展资助项目(BE2013911);
江苏省自然科学基金资助项目(BK20141281)
王永祥
R 742
A
1672-2353(2017)05-001-04
10.7619/jcmp.201705001

