巨菌草纤维特性分析及其木素结构表征
沈 锋 陈嘉川 杨桂花,* 王 强 刘姗姗 胡长青
(1.齐鲁工业大学制浆造纸科学与技术教育部重点实验室,山东济南,250353;2.山东晨鸣纸业集团股份有限公司,山东寿光,262700)
·巨菌草纤维·
巨菌草纤维特性分析及其木素结构表征
沈 锋1陈嘉川1杨桂花1,*王 强1刘姗姗1胡长青2
(1.齐鲁工业大学制浆造纸科学与技术教育部重点实验室,山东济南,250353;2.山东晨鸣纸业集团股份有限公司,山东寿光,262700)
对巨菌草纤维形态、化学成分组成、木素结构及其微区分布进行了研究。利用纤维质量分析仪(FQA)测得纤维平均长度为0.95 mm,宽度为23.1 μm,长宽比为41.1。高效液相色谱(HPLC)定量分析碱性硝基苯氧化产物确定巨菌草木素结构为典型的GSH型。利用核磁共振磷谱(31P-NMR)定量分析木素各酚羟基功能基团,结果显示脂肪族羟基含量最高,为3.96 mmol/g,其中非缩合型羟基占总酚羟基的比例较大,为96.3%;二维核磁共振(2D-HSQC NMR)波谱分析表明,β-O- 4′芳基醚键结构比例最高,为84.4%;其次为β-β′树脂醇结构和β-5′苯基香豆满结构,所占比例分别为9.9%和5.7%;在芳香区含有大量的紫丁香基和愈创木基结构单元,其中S/G比例为1.25。共聚焦拉曼光谱(CRM)分析表明,木素在细胞不同区域的浓度由大到小的顺序为细胞角隅CC>复合胞间层CML>次生细胞壁SW;羟基肉桂酸的浓度分布规律与木素的分布变化相似,但其浓度低于木素的浓度。
巨菌草;木素结构;核磁共振磷谱;二维核磁共振
木质纤维生物质资源作为一种丰富的可再生资源,其富含的多糖组分经过发酵可生产生物燃料和生物质基化学品[1]。常见的生物质原料主要包括木材和禾本科植物、农林废弃物、能源植物等,其主要组分为纤维素、半纤维素和木素[2]。在这些生物质原料中,能源植物由于具有产量大且培育成本低的特点而成为潜在的能够满足大规模生产的原料,目前在制浆造纸、纺织、高附加值化工产品等领域有一定的应用。因此,高产低投资的能源植物成为科技人员的研究热点,其中就包括巨菌草(Pennisetumsinese)[3]。
巨菌草是由福建农林大学林占熺研究员于1983年引进中国的。这种植物是由多种狼尾草属杂交而成的单子叶多年生植物,对温度和土壤要求不高,适应能力强,植株高大,不易倒伏,热利用率较高,生物量大,一年可以长高5~7 m,最高产量达300 t/hm2,为已知人工种植植物的最高产量[4-5]。目前,巨菌草在生物质发电、纤维板、制造燃料乙醇等领域已有应用。若以巨菌草为原料,研发出各种具有优异性能、高附加值的生物质材料,可进一步扩大巨菌草的经济效益和环境效益[6-7]。
本实验主要利用高效液相色谱分析(HPLC)、傅里叶红外光谱(FT-IR)、核磁共振磷谱(31P-NMR)、二维核磁共振(2D-HSQC NMR)、凝胶渗透色谱(GPC)和共聚焦拉曼光谱(CRM)技术分析探讨巨菌草的化学组成、木素的基本结构及其分布,为巨菌草全组分的高值化利用提供理论指导。
1 材料与方法
1.1 实验原料
巨菌草,一年生,取自广东省。巨菌草除去叶、根,然后粉碎,取40~60目木粉使用。
1.2 实验方法
1.2.1 巨菌草纤维形态测定及化学成分分析
采用加拿大OPTEST公司的纤维质量分析仪(FQA)分析纤维长度、宽度等形态学参数。
纤维素、半纤维素、木素、苯-醇抽出物、灰分等按照国家标准(GB/T 2677.10—1995,GB/T 2677.9—1994,GB2677.8—81,GB2677.7—81, GB2677.3—81)进行测定。
1.2.2 木粉的碱性硝基苯氧化
实验具体方法参见谢益民教授[8]的改良方法,对降解产物的分析采用高效液相色谱分析(HPLC)来定性定量。用10 mL二氧六环溶解经过减压蒸发除去溶剂的降解产物,再取其1 mL稀释5倍后用HPLC进行定性定量分析。精确称量紫丁香醛(S)、紫丁香酸(S)、香草醛(G)、香草酸(G)、对羟基苯甲醛(H)、对羟基苯甲酸(H)作为准样,定量分析巨菌草中木素结构单元的含量。
HPLC分析条件为:色谱柱Nova-PakC18;流动相为乙腈∶水=12∶88(体积比),并加0.1%的磷酸;流速为1.2 mL/min;进样量为20 μL;检测器为紫外吸收检测器,280 nm。
1.2.3 木素的分离提取
取40~60目巨菌草木粉用丙酮抽提8 h,抽提结束后用去离子水洗涤。风干后的试样用球磨机球磨72 h后供制备酶解-温和酸解木素(EMAL)用。按照文献[9-10]进行EMAL的分离制备,测量纯化后木素样品的纯度和糖含量等。
1.2.4 FT-IR分析
取1.0 mg巨菌草EMAL试样,与300 mg KBr经玛瑙研钵研磨后压片,采用美国ANALECT公司的PFX- 65红外光谱仪进行扫描,扫描范围为4000~400 cm-1。
1.2.531P-NMR分析
称取干燥的巨菌草EMAL样品40 mg(精确至0.0001 g),溶解于0.5 mL氘代吡啶-氘代氯仿(体积比为1.6∶1)溶剂中,使木素完全溶解,加入200 μL 浓度为80 mg/mL内标(内标剂:环己醇)溶液和50 μL浓度为11 mg/mL松弛剂(即驰豫剂:乙酰基丙酮络酸铬)溶液,充分混合均匀,再加入100 μL磷化试剂(2-氯- 4,4,5,5-四甲基-1,3,2-二氧磷杂戊环,纯度是95.0%,TMDP),迅速将混合溶液转移至测试管中进行检测[11]。
磷化后的EMAL样品用核磁共振波谱仪(AVANCEⅡ400)测定木素中的基团含量。扫描时间为1 h左右。
1.2.6 2D-HSQC NMR分析
将20 mg巨菌草EMAL样品溶于DMSO-d6有机溶剂中,然后在核磁共振波谱仪上测定,具体条件为:弛豫时间1.5 s,采样时间0.17 s,采样128次,256增量,即128×256[12]。
1.2.7 巨菌草EMAL分子质量分布
巨菌草EMAL的乙酰化参照文献方法[12]进行。取100 mg巨菌草EMAL样品溶于5 mL体积比为1∶2的吡啶-醋酸酐溶液中,避光条件下充入氮气保护,搅拌24 h后停止反应。然后将溶液缓慢倒入搅拌着的200 mL乙醚中,析出乙酰化的木素样品,用乙醚洗涤数次直至无吡啶气味,真空干燥6 h,得到的粉末即为乙酰化的木素样品。乙酰化的木素样品通过凝胶渗透色谱(GPC)来测定木素质均相对分子质量(Mw)和数均相对分子质量(Mn)[12]。
1.2.8 共聚焦拉曼光谱(CRM)分析
选取合适位置的巨菌草试样用单面刀片分割成1 cm 长小段,然后经煮沸软化后用聚乙二醇包埋剂进行包埋,然后使用滑走切片机(Leica SM2010R,Germany)切取厚度为8 μm的横切面切片,将切好的样品置于载玻片上,滴加1滴氘水,然后盖上盖玻片。采用共聚焦拉曼显微镜(Horiba JobinYvon, Longjumeau, France)进行检测。具体方法见参考文献[13]。
2 结果与讨论
2.1 巨菌草的纤维形态
表1为巨菌草的纤维形态数据。由表1可知,巨菌草纤维的平均长度为0.95 mm,平均宽度为23.1 μm,长宽比为41.1。纤维长度略低于一般禾本科原料(麦草平均长度1.32 mm,芦苇平均长度1.12 mm),长宽比数值较大,有较好的纤维交织能力,可作为制浆造纸纤维原料使用。
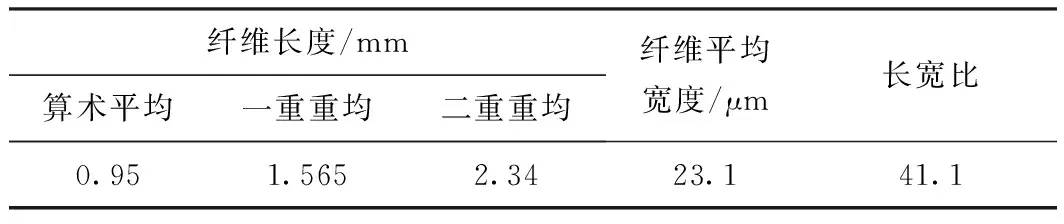
表1 巨菌草纤维形态
2.2 化学成分分析
2.2.1 巨菌草的化学组分分析
根据国家相关标准,对巨菌草的化学成分进行了分析测定,分析结果见表2。
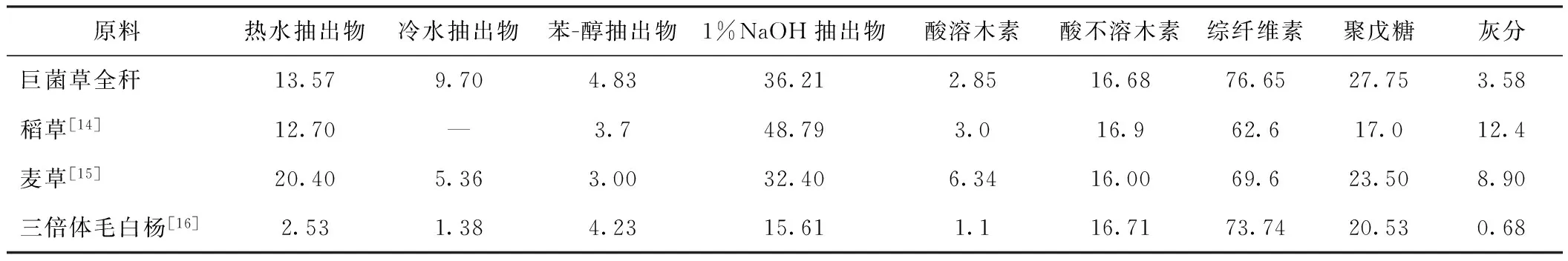
表2 巨菌草的化学成分 /%
从表2中数据可以看出,巨菌草的灰分含量小于稻草和麦草的,热水抽出物和苯-醇抽出物含量高于三倍体毛白杨[14-16]的。巨菌草的综纤维素含量为76.65%,木素含量为19.53%,聚戊糖含量为27.75%。基于纤维素含量、木素含量、灰分含量等数据分析,巨菌草易于蒸煮,化学药品消耗量低,制浆得率较高;其制浆造纸性能优于麦草,稍差于三倍体毛白杨,是较好的制浆造纸用非木材纤维原料[5, 17]。
2.2.2 巨菌草EMAL的成分分析
巨菌草EMAL成分分析结果见表3。表3中数据表明,通过酶解-温和酸解法制备的EMAL纯度为92.5%。木素中含有约7.5%的碳水化合物,且碳水化合物中主要是木糖,这说明木素与部分聚木糖存在部分交联,且在酶解-温和酸解法制备过程中并未完全去除。
2.3 硝基苯氧化
碱性硝基苯氧化巨菌草原料中木素的非酚型结构时,主要生成紫丁香醛/酸(S)、香草醛/酸(G)、对羟基苯甲醛/酸(H)这3种小分子醛/酸,而其对应的木素基本结构单元为紫丁香基丙烷(S)、愈创木基丙烷(G)和对羟基苯基丙烷(H)结构。因此,通过测定硝基苯氧化产物中几种酚醛和酚酸的含量,就可推断出木素非缩合型结构单元的比例。巨菌草所含EMAL结构单元的含量见表4。

表3 巨菌草EMAL的成分分析 /%
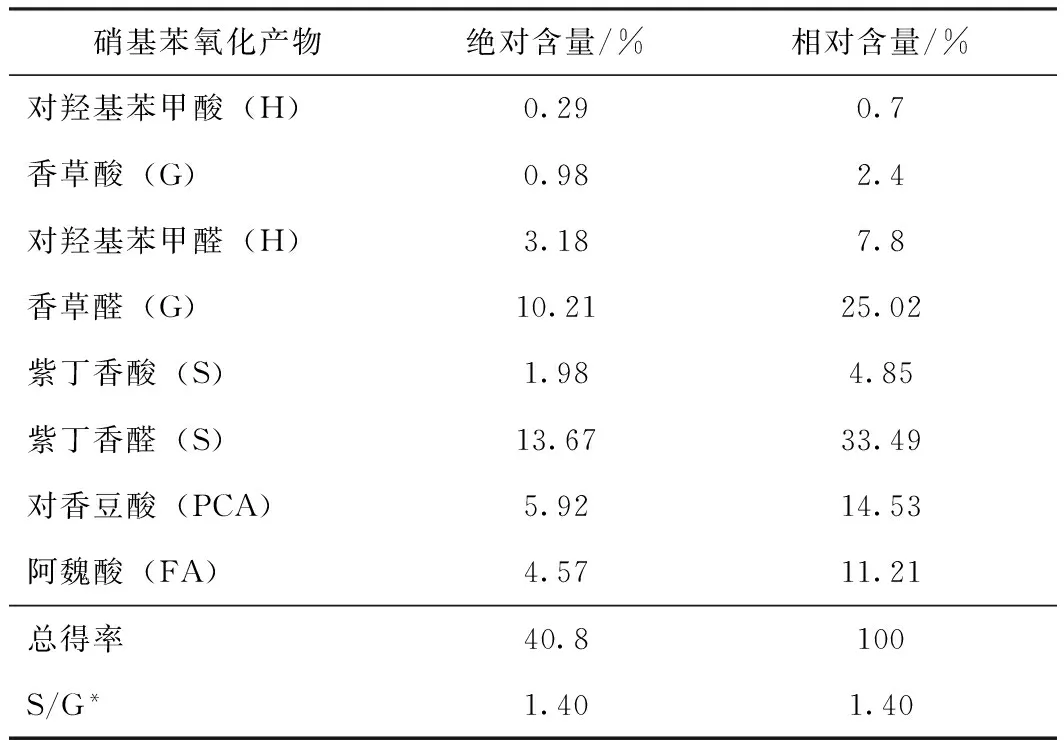
表4 巨菌草木素结构单元的含量
注 *S代表紫丁香醛与紫丁香酸之和;G代表香草醛与香草酸之和。
由表4中数据可知看出,木素经过硝基苯氧化之后,酚醛/酸降解产物得率较低,为40.8%。巨菌草木素结构单元中紫丁香基丙烷结构单元(S)含量最高,为38.34%;愈创木基丙烷结构(G)单元次之,为27.42%;对羟基苯基丙烷结构(H)单元最少,为8.5%;而且降解产物中还含有较多的阿魏酸(FA)和对香豆酸(PCA)等小分子产物。其中S/G的比值为1.40,由于紫丁香基丙烷结构不易形成缩合型结构,因此S/G的比值与木素中非缩合性结构的比例有很大的关系,而且巨菌草中木素结构是典型的GSH型,其比例为S∶G∶H=1.4∶1.0∶0.4。此外,作为木素和半纤维素结合的交联聚合物,阿魏酸和对香豆酸的含量较高,且具有草类原料禾本科植物的特征[18]。非缩合型结构木素在制浆或漂白过程中容易降解,因而紫丁香基丙烷结构含量越多的木素越容易降解。由此可知,巨菌草的木素结构比较容易降解。
2.4 巨菌草EMAL的FT-IR分析
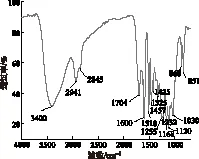
图1 巨菌草EMAL的FT-IR图
2.5 巨菌草EMAL的31P-NMR谱分析
经过衍生化的巨菌草EMAL样品,通过核磁共振磷谱仪测定得到的31P-NMR谱图见图2。
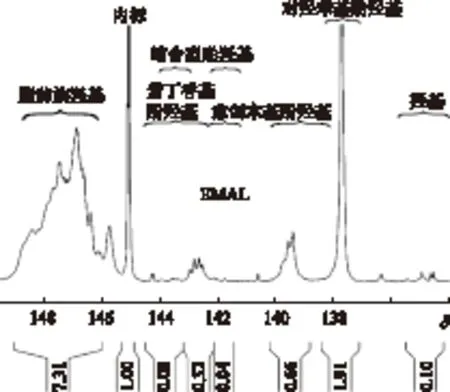
图2 巨菌草EMAL的31P-NMR谱图
图2表明,巨菌草EMAL样品中,主要为酚羟基、脂肪族羟基、羧基等,其中酚羟基又包括缩合型和非缩合型愈创木基型(G)、紫丁香基型(S)和对羟基苯基型(H)羟基,这些羟基都是木素结构的功能基团。对这些基团的信号区域进行积分,可以得到积分值,然后再根据内标用量,计算出木素中各官能团的含量,单位为mmol/g。
对于不同原料,其积分区间也不相同。巨菌草EMAL中紫丁香基酚羟基出现在δ=143.1~142.4范围之内,它和缩合酚羟基出现的范围δ=144.2~141.5相重叠,因此在积分的时候,需要把紫丁香基从缩合酚羟基中分离出来(见图2),从而使缩合酚羟基的积分区域分为δ=144.2~143.1和δ=142.4~141.5两个积分区间。

表5 31P-NMR定量分析EMAL的功能基团及其含量
由表5中数据可知,巨菌草EMAL中脂肪族羟基含量最高,为 3.96 mmol/g,总酚羟基含量次之,为1.62 mmol/g,羧基含量最低,仅为0.05 mmol/g。在酚羟基中,非缩合型酚羟基含量较高,为1.56 mmol/g,缩合型酚羟基含量较低,为0.06 mmol/g。各非缩合型酚羟基占总酚羟基的含量分别为:S-酚羟基10.5%,G-酚羟基22.2%,H-酚羟基63.6%,而缩合型酚羟基(S—OH和G—OH)3.7%。需要说明的是,图2中显示的紫丁香基酚羟基的数量并不能真实反映木素结构中紫丁香基单元的实际数量,因为木素分子质量较大,结构复杂,连接键较多且S-木素容易形成β-O- 4等芳基醚键,因而游离出较少的S-酚羟基,从而导致总酚羟基和各酚羟基含量较低[20]。
2.6 巨菌草EMAL的2D-HSQC NMR谱分析
为了进一步研究巨菌草EMAL结构单元之间的连接键结构,以及各连接键的比例,使用2D-HSQC NMR技术进行了表征,见图3。图3(a)表示木素侧链区域(δC/δH50~90/2.9~5.1),图3(b)代表芳环区域(δC/δH98~135/5.2-7.6),图4为木素的主要连接结构及单元,表6为2D-HSQC 谱图信号的化学位移归属[3, 21]。

图3 巨菌草EMAL侧链和芳香环上C—H的 2D-HSQC NMR谱图
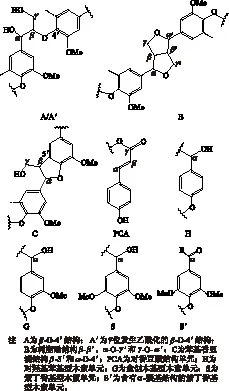
图4 巨菌草EMAL的主要结构
由图3和图4可知,巨菌草EMAL结构之间的连接键主要为β-O- 4′芳基醚键结构(A 和 A′),β-O- 4′结构(A)上Cα—Hα、Cβ—Hβ、Cγ—Hγ的化学位移δC/δH分别为72.0/4.89,83.5/4.45和84.9/4.12,60.7/3.53,而γ位乙酰化的β-O- 4′结构(A′)的Cγ—Hγ的相关信号δC/δH主要集中在63.0/4.29处,证明巨菌草EMAL的β-O- 4′结构在γ位发生了一定的乙酰化反应,乙酰化广泛存在于植物组织中[22]。在侧链区域还检测到木素其他缩合型结构,如树脂醇结构(resinol,β-β′,B),苯基香豆满结构(phenylcoumaran,β-5′,C)等,在Cγ—Hγ的化学位移δC/δH分别为71.6/3.69和63.5/3.78。
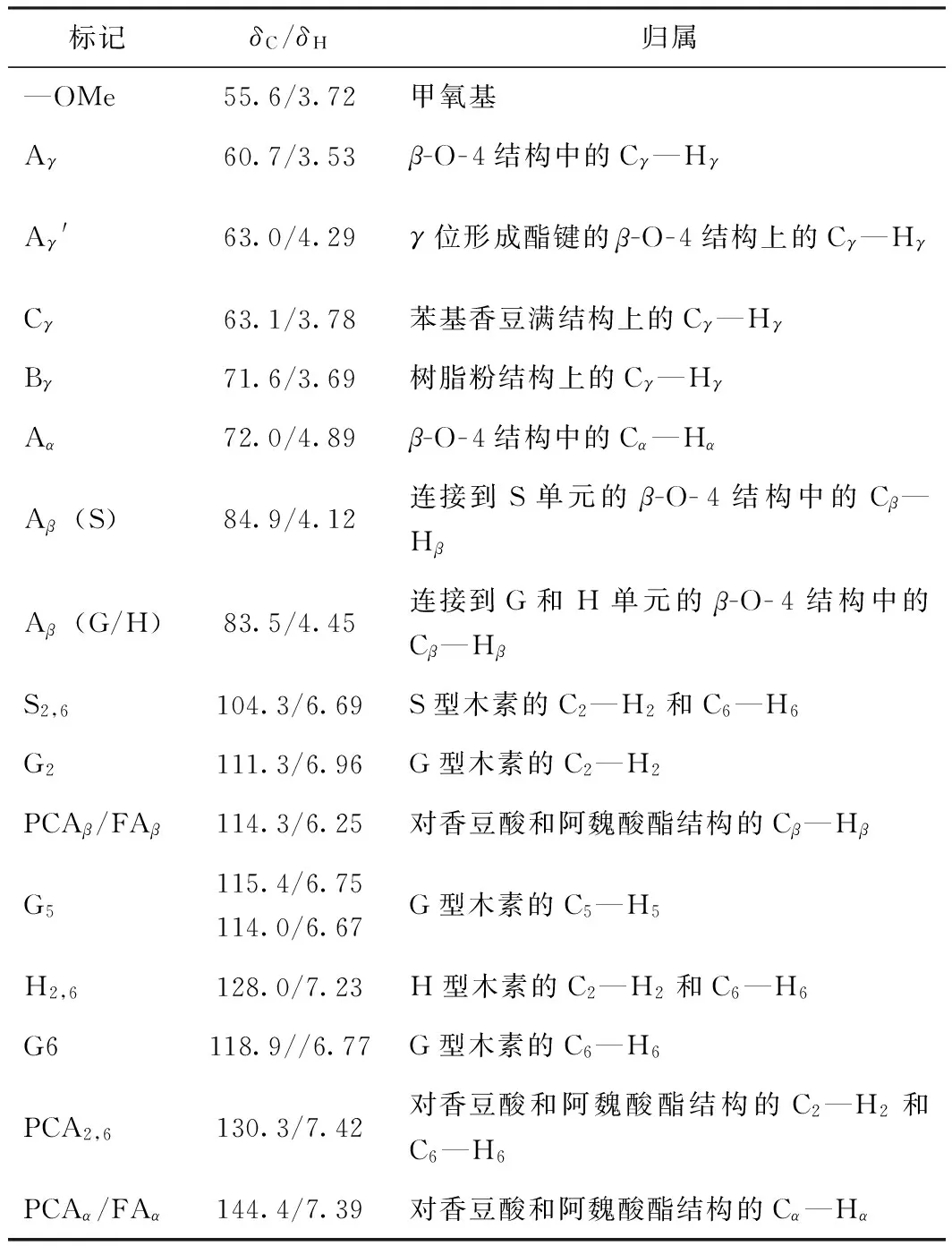
表6 巨菌草EMAL 2D-HSQC NMR谱图化学位移及归属
在木素的芳香环区域,可以明显观察到木素的3种结构紫丁香基(S)、愈创木基(G)和对羟苯基(H)单元吸收信号,这说明巨菌草是典型的GSH型单元木素。S型单元的2,6位碳是相互对称的,其C2,6—H2,6的化学位移δC/δH为103.6/6.69,S型单元α位发生了一定的氧化反应,S′(α-oxidation)的化学位移δC/δH为106.3/7.19。G型单元的信号峰出现在不同的位置:C2—H2(G2)、C5—H5(G5)、C6—H6(G6)的化学位移δC/δH分别为111.3/6.96,115.4/6.75和114.0/6.67,118.9/6.77。H型单元得吸收峰与G型单元的吸收峰比较接近,其中H3,5的化学位移主要与G型单元5号位上的相关信号发生重叠。对香豆酸的吸收信号较强,在不同位置均有吸收信号。其中C2,6—H2,6位的化学位移δC/δH为115.4/6.77,Cα—Hα和Cβ—Hβ位的化学位移δC/δH分别为144.4/7.39和114.3/6.25。有研究发现木素中的H单元主要以对香豆乙酰基的形式存在[23]。
利用2D-HSQC NMR图半定量技术分析巨菌草EMAL中不同结构单元及S/G比值,分析结果见表7。表7结果表明,巨菌草EMAL主要结构单元为β-O- 4′芳基醚键(A/A′),其占总侧链单元的84.4%,其次为β-β′树脂醇结构(B),占总侧链单元的9.9%,而β-5′苯基香豆满结构(C)占总侧链单元的5.7%。二维图谱得到的S/G比值为1.25,与硝基苯氧化中S/G为1.40相比略低,可能原因是硝基苯氧化主要与木素非缩合型单元发生反应,而且2D-HSQC NMR谱图中是木素整体结构单元的比例。

表7 巨菌草EMAL结构2D-HSQC NMR谱图定量分析

图6 巨菌草细胞壁组分分布的CRM成像图
2.6 巨菌草EMAL分子质量分布
巨菌草EMAL的质均相对分子质量(Mw)和数均相对分子质量(Mn)通过凝胶渗透色谱(GPC)来测定,以苯乙烯标样作为标准,测定谱图见图5。由图5可知,巨菌草EMAL的质均相对分子质量为7289,的多分散系数较小(小于2.0),这说明EMAL的分子质量分布较小。
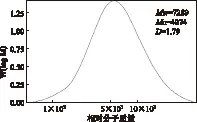
图5 巨菌草的相对分子质量分布
2.7 巨菌草木素共聚焦拉曼光谱(CRM)分析
图6为巨菌草纤维细胞中木素、碳水化合物和羟基肉桂酸的分布图像。由图6(a)可以清晰地观察到木素在细胞角隅(CC)的拉曼信号强度最强,这表明CC中木素浓度最高,其次是复合胞间层(CML),次生细胞壁(SW)木素信号强度最弱,说明木素的浓度在SW中最低。与木素在不同细胞层次中的分布相类似的是羟基肉桂酸的分布,羟基肉桂酸(HCA)主要由PCA 和FA组成,它们作为木素与半纤维素结合的交联聚合物分子,其在细胞壁中的分布在植物细胞壁天然抗降解屏障中扮演着重要角色,因而了解其分布对于后续巨菌草的资源化利用以及生物质预处理等工艺可提供理论指导。图6(b)主要显示碳水化合物在纤维细胞中的分布,其主要包括纤维素和半纤维素。从图6中可以看出碳水化合物在SW中拉曼信号强度最强,表明碳水化合物在SW中浓度最高,而在CC和CML区域碳水化合物的信号强度较弱,其浓度也较低。
3 结 论
(1)巨菌草纤维长度较长,为0.95 mm,长宽比较大,为41.1,而且综纤维素含量较高,木素含量较低,是较好的制浆造纸原料。
(2)通过硝基苯氧化可知,巨菌草酶解-温和酸解木素(EMAL)中紫丁香基型(S)和愈创木基型(G)结构单元含量较高,分别为38.3%和27.4%,且S/G的比例为1.40,是典型的GSH型禾本科植物。核磁共振磷谱(31P-NMR)图谱分析表明巨菌草EMAL中含有脂肪族羟基、缩合型和非缩合型的愈创木基型、紫丁香基型和对羟基苯基型羟基和羧基,其中脂肪族羟基含量最高,为 3.96 mmol/g,酚羟基中非缩合型酚羟基含量较高,为1.56 mmol/g,缩合型酚羟基含量较低,为0.06 mmol/g,羧基含量最低,仅为0.05 mmol/g。
(3)二维核磁共振(2D-HSQC NMR)分析技术表明,巨菌草EMAL主要包含β-O- 4′芳基醚键、β-β′树脂醇结构、β-5′苯基香豆满结构,在芳香区含有大量的紫丁香基和愈创木基结构单元,以及大量的对香豆酸结构单元,从而构成了木素和半纤维素结合的交联聚合物分子,并在植物细胞壁的抗降解屏障中发挥重要作用。共聚焦拉曼光谱(CRM)表明巨菌草木素在细胞不同区域的浓度分布不均一,其中细胞角隅(CC)中木素浓度最高,复合胞间层(CML)浓度次之,次生细胞壁(SW)中木素浓度最低。羟基肉桂酸的浓度分布规律与木素的分布变化相似,但其浓度低于木素的浓度,碳水化合物主要分布在次生细胞壁中。
[1] Zhao X, Zhang L, Liu D. Biomass recalcitrance. Part II: Fundamentals of different pre-treatments to increase the enzymatic digestibility of lignocellulose[J]. Biofuels, Bioproducts and Biorefining, 2012, 6(5): 561.
[2] You T, Zhang L, Guo S, et al. Unraveling the structural modifications in lignin ofArundodonaxLinn. during acid-enhanced ionic liquid pretreatment [J]. Journal of Agricultural & Food Chemistry, 2015, 63(50): 10747.
[3] Río JC Del, Prinsen P, Jorge R, et al. Structural characterization of the lignin in the cortex and pith of elephant grass (Pennisetumpurpureum) stems[J]. Journal of Agricultural & Food Chemistry, 2012, 60(14): 3619.
[4] Lin Xing-sheng, Lin Zhan-xi, Lin Dong-mei,et al. Preliminary Study on Juncao as Biomass Fuel[J]. Journal of Fujian College of Forestry, 2013, 33(1)1: 82. 林兴生, 林占熺,林冬梅, 等. 菌草作为生物质燃料的初步研究[J]. 福建林学院学报, 2013, (1): 82.
[5] Lu Nan, Shen Feng, Wang Sheng-dan, et al. Biological Structure and KP Pulp Properties of Pennisetum Sinese Grasses[J]. Paper and Paper Making, 2015, 34(3): 27. 鲁 南, 沈 锋, 王胜丹, 等. 巨菌草的生物结构及制浆造纸性能 [J]. 纸和造纸, 2015, 34(3): 27.
[6] Lin Zhan-xi. Juncao Technology Status and Application Prospect[J]. Academic Review. 1996(z1): 80. 林占禧. 菌草技术现状及其应用前景[J]. 学术评论, 1996(z1): 80.
[7] Li Zhi-wen. Study on Characteristics of Pennisetum Sinese as an Energy Source [J]. Agriculture Engineering Technology(New Energy Industry), 2013(6): 12. 李志文. 巨菌草作为能源草的特性研究[J]. 农业工程技术·新能源产业, 2013(6): 12.
[8] Xie Y, Robert D R, Terashima N. Selective carbon 13 enrichment of side chain carbons of ginkgo lignin traced by carbon 13 nuclear magnetic resonance[J]. Plant physiology and biochemistry, 1994, 32(2): 243.
[9] LU Nan,SHEN Feng,WANG Sheng-dan, et al. Studies on Lignin and Hemicellulose of Pennisetum Sinese Grasses [J]. China Pulp & Paper, 2016, 35(8):1. 鲁 南, 沈 锋, 王胜丹, 等. 巨菌草的木素及半纤维素分析 [J]. 中国造纸, 2016, 35(8): 1.
[10] Liu Yu, Zhan Huai-yu, Chen Jia-chuan, et al. Structural analysis of raw material lignin from triploid of polulus tomentosa[J]. China Paper & Paper Industry, 2006, 27(11): 88. 刘 玉, 詹怀宇, 陈嘉川, 等. 三倍体毛白杨原料木素结构分析 [J]. 中华纸业, 2006, 27(11): 88.
[11] Argyropoulos D.31P NMR in wood chemistry: A review of recent progress [J]. Research on chemical intermediates, 1995, 21(3/5): 373.
[12] Wen J-L, Sun S-L, Yuan T-Q, et al. Structural elucidation of whole lignin from Eucalyptus based on preswelling and enzymatic hydrolysis[J]. Green Chemistry, 2015, 17(3): 1589.
[13] Zhe J, Xun Z, Zhe L, et al. Visualization of Miscanthus×giganteus cell wall deconstruction subjected to dilute acid pretreatment for enhanced enzymatic digestibility[J]. Biotechnology for Biofuels, 2015, 8(1): 1.
[14] Wang Wang-xia, Jing Lei, Jin Yong-can, et al. Effects of Acetic Acid Pre-hydrolysis on the Chemical Compositions and Enzymatic Hydrolysis of Rice Straw[J]. Jounrnal of Cellulose Science and Technology. 2011, 19(2): 35. 王旺霞, 荆 磊, 金永灿, 等. 醋酸预水解对稻草化学成分及酶水解性能的影响[J]. 纤维素科学与技术, 2011, 19(2): 35.
[15] Li You-sen, Yang Shu-hui, Wu Jie-sheng. Study on the Production of Linearboard with Ammonium Sulfite Kenaf and Wheat Straw Pulps[J]. Journal of Northwest Institute of Light Industry, 1990, 8(3): 73. 李友森, 杨淑惠, 吴解生. 亚铵法红麻、 麦草浆配抄挂面牛皮箱纸板试验研究 [J]. 西北轻工业学院学报, 1990, 8(3): 73.
[16] Yao Chun-li, Pu Jun-wen. Timber Characteristics and Pulp Properties of the Triploid ofPopulustomentosa[J]. Journal of Beijing Forestry University, 1998, 20(5): 18. 姚春丽, 蒲俊文. 三倍体毛白杨化学组分纤维形态及制浆性能的研究[J]. 北京林业大学学报, 1998, 20(5): 18.
[17] Pu Jun-wen, Song Jun-long, Xie Yi-min, et al. Characteristics of lignin structure of triploid clones of Populus tomentosa Carr[J]. Journal of Beijing Forestry University, 2002, 24(56): 211. 蒲俊文, 宋君龙, 谢益民,等. 三倍体毛白杨木质素结构特性研究[J]. 北京林业大学学报, 2002, 24(56): 211.
[18] Wu Qin, Chen Jia-chuan, Yang Gui-hua, et al. Fiber morphology, chemical composition, and APMP pulp properties of fast growing black poplar crotches[J]. Chemistry and Industry of Forest Products, 2010, 30(3): 35. 吴 芹, 陈嘉川, 杨桂花, 等. 速生黑杨枝桠材纤维形态、化学组分及APMP制浆性能的研究[J]. 林产化学与工业, 2010, 30(3): 35.
[19] Faix O. Classification of lignins from different botanical origins by FT-IR spectroscopy[J]. Holzforschung-International Journal of the Biology, Chemistry, Physics and Technology of Wood, 1991, 45(s1): 21.
[20] Li Bing-yun, Zhan Huai-yu, Liang Chen, et al. Analysis of lignin structure in Bambusa Chungii SCMP by 2D NMR[J]. Paper Science & Technology, 2010, 29(5): 62. 李兵云, 詹怀宇, 梁 辰, 等. 粉丹竹SCMP木素结构的2D NMR分析[J]. 造纸科学与技术, 2010, 29(5): 62.
[21] Jorge R, Pepijn P, Ana G, et al. Isolation and structural characterization of the milled wood lignin, dioxane lignin, and cellulolytic lignin preparations from brewer′s spent grain[J]. Journal of Agricultural & Food Chemistry, 2014, 63(2): 603.
[22] Río J C Del, Gisela M, Jorge R, et al. Occurrence of naturally acetylated lignin units[J]. Journal of Agricultural & Food Chemistry, 2007, 55(14): 5461.

(责任编辑:董凤霞)
Fiber Morphology, Lignin Structure and Lignin Distribution in Cell Wall of thePennisetumsinese
SHEN Feng1CHEN Jia-chuan1YANG Gui-hua1,*WANG Qiang1LIU Shan-shan1HU Chang-qing2
(1.KeyLabofPulp&PaperScienceandTechnologyofEducationMinistry,QiluUniversityofTechnology,Ji’nan,ShandongProvince, 250353; 2.ChenmingPulp&PaperCo.,Ltd.,Shouguang,ShandongProvince, 262700)
(*E-mail: ygh2626@126.com)
The morphologiy of fibers, chemical components, lignin structure and the lignin distribution in cell wall ofPennisetumsinesewere analyzed. Fiber Quality Analyzer (FQA) analysis showed that average fiber length was 0.96mm and the width was 23.1 μm, fiber length-width ratio reached to 41.1. Alkaline nitrobenzene oxidation quantitative analysis revealed thatPennisetumsineselignin was typical GSH-type. It was found that the highest content of hydroxyl groups was aliphatic OH (3.96 mmol/g), and non-condensed phenolic hydroxyl accounted for a large proportion content of the total phenolic hydroxyl (96.3%). In addition, 2D-HSQC NMR analysis indicated that the alkyl aryl ether linkages was predominant (β-O- 4′, 84.4% of total linkages), followed by resinols (β-β′, 9.9%) and phenylcomumarans (β-5′5.7%). Moreover, aromatic regions showed large quantity of S-type and G-type lignin, and the S/G ratio was 1.25. Confocal Raman microscopy (CRM) indicated that the concentrations of lignin and hydroxycinnamic acid (HCA) in the cell walls followed the decreasing order, as CC>CML>SW, but the concentration of HCA waslowerthan that of lignin.
Pennisetumsinese; lignin structure;31P-NMR; 2D-HSQC NMR
沈 锋先生,在读硕士研究生;主要从事植物纤维结构方面的研究。
2016- 12- 05(修改稿)
国家自然科学基金(31370580, 31470602);山东省重大科技专项(2015ZDZX09002);泰山学者工程专项经费。
TS721
A
10.11980/j.issn.0254- 508X.2017.03.003
*通信作者:杨桂花,博士生导师;研究领域:制浆造纸与生物质精炼绿色化学技术。

