荆芥挥发油对内毒素中毒模型小鼠的保护作用
温桃群+桑文涛+徐锋+王凤+曾南


[摘要] 觀察荆芥挥发油对内毒素(LPS)中毒模型小鼠的保护作用,并采用GC-MS对荆芥挥发油进行化学成分测定。雄性C57BL/6J小鼠按体重分层随机分为空白对照组、模型对照组、地塞米松组(5 mg·kg-1)、荆芥挥发油0.226 g·kg-1及0.452 g·kg-1剂量组。除地塞米松组实验当日腹腔注射给药一次外,其余各组小鼠连续灌胃给药5 d,1次/d。各组末次给药30 min后,除空白组小鼠外,其余各组小鼠腹腔注射LPS(15 mg·kg-1)制备内毒素中毒模型。造模12 h后,小鼠取血分离血清,采用ELISA及液相蛋白芯片技术测定炎症因子IL-18,IL-1β,IL-5,TNF-α,单核细胞趋化蛋白-1(MCP-1),巨噬细胞炎性蛋白(MIP-1β),巨噬细胞集落刺激因子(M-CSF)及粒细胞-巨噬细胞集落刺激因子(GM-CSF)的水平;剖取肺脏、脾脏、胸腺称重,计算脏器指数;取小鼠全血进行白细胞(WBC)、血小板(PLT)计数;同时进行各组小鼠肺组织病理组织学检查。GC-MS检测结果显示薄荷酮、胡薄荷酮的相对质量分数分别为46.67%,33.92%,二者质量分数占总挥发油的80.59%。荆芥挥发油预防给药,0.452,0.226 g·kg-1剂量均能显著降低模型小鼠血清IL-1β,IL-5,TNF-α,MCP-1,MIP-1β,M-CSF水平(P<0.01或P<0.05),荆芥挥发油0.452 g·kg-1剂量亦降低血清IL-18,GM-CSF水平(P<0.01或P<0.05);荆芥挥发油0.226 g·kg-1剂量能使肺组织内嗜中性粒细胞浸润减少,显示出良好抗炎效应。但荆芥挥发油预防给药,对模型小鼠白细胞计数的升高、血小板计数的减少及脾脏指数、肺指数的升高、胸腺指数的降低无明显干预作用。结果表明,荆芥挥发油预防给药对内毒素(LPS)中毒模型小鼠有一定保护作用,作用发挥主要与抑制各类炎性细胞因子的释放,减轻炎症反应有关。
[关键词] 荆芥挥发油;内毒素中毒;保护作用;小鼠
[Abstract] In order to study the protective effects of Schizonepeta volatile oil (Sto)on endotoxin poisoning mice,and the relatively content of each chemical osubstance in Schizonepeta volatile oil was measured using GC-MS. The mare C57BL/6J mice were randomly divided into five groups including the normal group,model group,dexamethasone group (5 mg·kg-1),and Sto (0.226 and 0.452 g·kg-1,respectively) groups. The dexamethasone group was given the drugs once time by intraperitoneal injection on the 5th day,while the other mice were given drugs by oral administration once a day for 5 days. Then,the normal group was injected with the saline and the other groups were injected LPS (15 mg·kg-1) after 30 minutes of the last administration. After LPS injection twelve hours,the blood,serum,and lung tissue of mice were collected. The IL-18,IL-1β,IL-5,TNF-α,MCP-1,MIP-1β,M-CSF,and GM-CSF were measured in serum by ELISA and Luminex Magpix. The white cell (WBC) and platelet (PLT) in blood were counted and lung,spleen,and thymus index were calculated. The lung histopathology was performed at the same time. The GC-MS results showed that the relative content of menthone and pulegone are 46.67% and 33.92%,respectively. The Sto (0.452 and 0.226 g·kg-1,respectively) reduced the levels of IL-1β,IL-5,TNF-α,MCP-1,MIP-1β,and M-CSF in serum (P<0.01 or P<0.05). The 0.452 g·kg-1 Sto also reduced the levels of IL-18 and GM-CSF in the serum (P<0.01 or P<0.05). And the 0.226 g·kg-1 Sto showed good anti-inflammatory effects by reducing neutrophil infiltration in the lung tissue. But the Sto had no effect on the increasing of WBC,spleen and lung index as well as decreasing of PLT and thymus index. The results showed that Sto has a protective effect in LPS-induced exdotoxin poisoning mice,its mechanism is related to inhibit the release of varies of inflammatory cytokines and reduce the inflammation reaction.
[Key words] Schizonepeta volatile oil;endotoxin poisoning;protective effects;mice
doi:10.4268/cjcmm20162425
脂多糖(lipopolysaccharide,LPS)作为内毒素的主要成分,在多种疾病的病理进程中发挥重要作用,如感染性休克、多器官功能衰竭、发热反应、弥散性血管内凝血等。荆芥为临床常用辛温解表药之一,具有祛风解表、宣毒透疹、理血止痉之功效,多用于外感表证[1]。现代药理研究表明,荆芥抗炎、抗病毒作用良好,临床常用于治疗感冒发热、 咽喉肿痛和皮疹、皮肤瘙痒等。前期研究已证明荆芥挥发油具有良好的抗炎作用,其作用的发挥与影响花生四烯酸代谢、抗氧化、抑制促炎因子生成等有关[2-8]。内毒素作为细菌致病主要物质,能激活单核-巨噬细胞系统,产生大量炎症因子,而解表药恰能通过发汗解表祛邪之功效发挥抗炎、抗菌、抗病毒的作用,因此本课题组采用LPS造模,观察荆芥挥发油对模型小鼠的影响,以期进一步揭示和完善该提取部位的抗炎效应与机制,为其临床应用提供药理学数据。
1 材料
1.1 动物 SPF级C57BL/6J小鼠,雄性,体重18~22 g,北京维通利华实验动物有限公司提供,许可证号SCXK(京)2012-0001,动物合格证号11400700130007。
1.2 受试物 荆芥购自成都荷花池中药材市场,经成都中医药大学中药鉴定教研室严铸云教授鉴定,为唇形科植物荆芥Schizononepeta tenuifolia Briq.的地上部分。荆芥挥发油提取:按2015年版《中国药典》第4部通则2204挥发油提取法中甲法提取,无水硫酸钠充分脱水,得到浅黄色、透明油状液体,密闭贮存于棕色瓶中,4 ℃保存备用,挥发油的提取率为0.61%(mL·g-1),符合2015年版《中国药典》荆芥含挥发油不得少于0.6%(mL·g-1)的要求。GC-MS进行挥发油成分分析。实验时用0.35%聚氧乙烯脱水山梨醇单油酸酯(吐温-80)溶液配制使用,给药剂量分别为其LD50的1/10和1/5,即0.226,0.452 g·kg-1。
1.3 试剂 地塞米松(Sigma,批号D-4902-25 mg);LPS(Escherichia coil 055:B5,Lot#044 M4004V)购自Sigma公司。Mouse IL-18 ELISA kit,批号118018007,购自E-bioscience公司。MILLIPLEX MAP Mouse Cytokine/Chemokine Magnetic Bead Panel-Immunology Multiplex Assay,批号2683668,购自Millipore公司。
1.4 仪器 HP6890/5973GC/MS仪(美国Agilent);3001型酶标仪(美国Thermo Fisher Scientific);Luminex Magpix(液相悬浮芯片仪,美国Millipore );BS323S电子天平(北京赛多利斯仪器系统有限公司);MEK-6318K全自动血液分析仪(日本Nihon Kohden公司)。
2 方法
2.1 荆芥挥发油的GC-MS测定 将荆芥挥发油样本与色谱甲醇按50 μL∶2 mL进行混匀,然后采用0.22 μm尼龙筛网进行过滤,再装入棕色瓶内。将已处理好样本按照以下条件进行检测:HP-INNOWx色谱柱(0.53 mm×15 mm×50 m);载气He;流速1 mL·min-1,柱初温80 ℃,程序升温10 ℃·min-1至140 ℃,再程序升温5 ℃·min-1至200 ℃后,程序升温25 ℃·min-1至终温260 ℃;电离方式EI,电离能70 eV;倍增器电压330 V;扫描范围20~450。质谱标准谱库为美国NIST,相对含量的确定为面积归一化法。
2.2 荆芥挥发油对LPS中毒模型小鼠的影响 取健康C57BL/6J雄性小鼠,按体重分层随机分为空白组、模型组、地塞米松(5 mg·kg-1)组(即阳性对照组)、荆芥挥发油0.452,0.226 g·kg-1组。除地塞米松组实验当日腹腔注射给药一次外,其余给药组小鼠按0.02 mL·g-1体积灌胃给药,空白组与模型组给予等体积0.35%吐温-80溶液,连续给药5 d,1次/d,末次给药30 min后,小鼠腹腔注射LPS(15 mg·kg-1,0.01 mL·g-1)造模,造模后12 h小鼠取血分离血清,采用ELISA试剂盒检测血清IL-18水平,采用液相悬浮芯片仪检测血清IL-1β,IL-5,TNF-α,单核细胞趋化蛋白-1(MCP-1),巨噬细胞炎性蛋白-1β(MIP-1β),巨噬细胞集落刺激因子(M-CSF),粒细胞-巨噬细胞集落刺激因子(GM-CSF)水平。另取小鼠全血 20 μL至装有 2 mL稀释液的 EP 管中,混匀,采用全自动血细胞分析仪测定白细胞计数。剖取小鼠脾脏、胸腺、肺脏称重,计算脏器指数。将分离后的小鼠左肺固定于10%中性福尔马林中,乙醇脱水,石蜡包埋,切片,HE 染色,光镜下观察各组小鼠肺组织的病理损伤。
2.3 数据处理 实验过程中所产生数据均采用SPSS 18.0软件进行统计分析,所有数据用±s表示,各组数据间采用独立样本t检验分析检验,P<0.05为差异有统计学意义。
3 结果
3.1 荆芥挥发油 GC-MS测定 从本实验所用荆芥挥发油中分离出相对质量分数0.5%以上的成分12个,其中薄荷酮相对质量分数为46.67%,胡薄荷酮相对质量分数为33.92%,二者质量分数占总挥发油的80.59%,为挥发油主要组成成分。经计算,本實验挥发油样品的胡薄荷酮质量分数为0.207%,符合2015年版《中国药典》所述胡薄荷酮(C10H16O)含质量分数不得少于0.020%的规定。结果见表1。
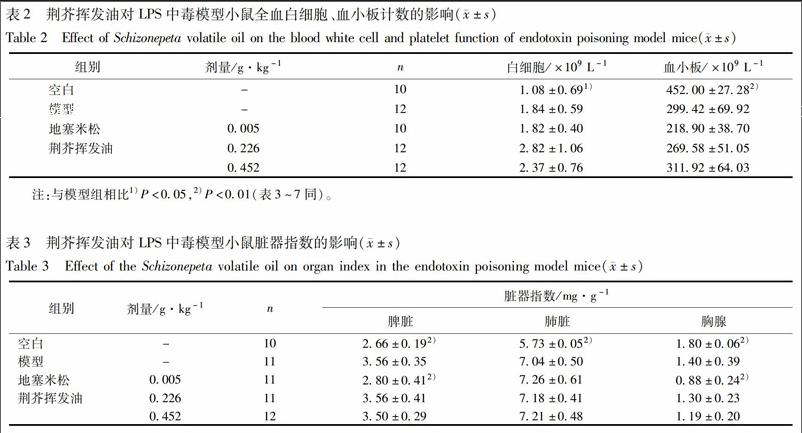
3.2 荆芥挥发油对模型小鼠全血白细胞与血小板计数、脏器指数的影响 与空白组比较,模型组小鼠全血白细胞计数显著增加(P<0.05),血小板计数显著降低(P<0.05);模型组脾脏指数、肺指数显著升高(P<0.01或P<0.05),胸腺指数显著降低(P<0.01);与模型组比较,各给药组对全血白细胞,血小板计数均无明显影响作用;地塞米松组能显著降低脾脏指数(P<0.01),其余各给药组对脏器指数无明显作用,见表2,3。
3.3 荆芥挥发油对模型小鼠血清IL-18水平的影响 与空白组比较,模型组血清IL-18含量显著增加(P<0.01);与模型组比较,荆芥挥发油0.452 g·kg-1剂量显著降低血清IL-18水平(P<0.01),见表4。
3.4 荆芥挥发油对模型小鼠血清IL-1β,IL-5,TNF-α水平的影响 与空白组比较,模型组小鼠血清IL-1β,IL-5,TNF-α 含量均显著增加(P<0.01或P<0.05);与模型组比较,荆芥挥发油0.452,0.226 g·kg-1剂量组对此均有显著对抗作用,能降低血清IL-1β,IL-5,TNF-α含量(P<0.01或P<0.05),见表5。
3.5 荆芥挥发油对模型小鼠血清MCP-1,MIP-1β, M-CSF,GM-CSF水平的影响 与空白组相比,模型组血清中MCP-1,MIP-1β,M-CSF,GM-CSF均显著增加(P<0.01或P<0.05);荆芥挥发油0.452,0.226 g·kg-1剂量组能显著降低血清中MCP-1,MIP-1β,M-CSF水平(P<0.01或P<0.05);荆芥挥发油0.452 g·kg-1剂量组显著降低血清中GM-CSF水平(P<0.05),见表6。
3.6 荆芥挥发油对模型小鼠肺组织病理组织学的影响 镜下观察可见,与空白组比较,造模组小鼠肺组织中肺泡隔内嗜中性粒细胞浸润明显,肺泡膈有不同程度增厚,肺组织小血管内充满嗜中性粒细胞,肺泡膈增厚的主要原因为炎细胞浸润造成。为了更直观说明药物对此病变程度的影响作用,实验中对各造模组肺组织切片中肺泡膈和小血管内嗜中性粒细胞的数量进行定量,评价方法:每叶肺400倍镜下取上、中、下3张图片,肺叶尖为上,支气管进入处最下端为下,两端之间为中部,每只动物取6张图片,计数每张图片上的嗜中性粒细胞数目,取其平均值作为该例标本嗜中性粒细胞的计数,并以此作为急性炎性反应程度指标进行统计学处理,统计方法为SPSS 18.0方差分析。结果见表7,图1,荆芥挥发油对内毒素所诱导的肺组织急性炎性细胞浸润有减轻作用,其中0.226 g·kg-1剂量组作用显著(P<0.01)。
4 讨论
内毒素又名“致热物质”,为革兰氏阴性菌细胞壁外膜特有成分,能够直接或间接损伤肺泡-毛细血管屏障,导致毛细血管通透性增加,炎症介质释放失控和中性粒细胞迁移,常见于感染性疾病和严重创伤中。内毒素中毒是指内毒素大量积聚于血液中,超过机体各自卫系统的清除能力所导致的不同程度的内毒素血症。内毒素血症进一步的发展可能引起脓毒性休克、弥散性血管内凝血、急性呼吸窘迫综合征等。脂多糖(LPS)作为内毒素的主要成分,是重要的致病因素之一,在细菌繁殖或死亡时可释放到细胞外发挥致病效应[9]。由LPS所致的内毒素中毒模型可表现出肺泡膈增厚,细胞成分增加,炎细胞浸润等。大量研究发现,由LPS诱导的动物内毒素中毒模型具有易于操作,可重复性好,不会引起多器官功能衰竭的特点,因此十分适用于药物抗炎作用机制的研究。
IL-1β作为一种前炎性释放因子,能诱导单核细胞趋化蛋白(MCP-1)、巨噬细胞炎性蛋白(MIP-1β)的产生。IL-18又名IFN-γ诱导因子,能诱导IFN-γ,细胞间黏附因子(ICAM-1),TNF-α等的产生。TNF-α可直接损伤肺血管内皮细胞和激发中性粒细胞大量释放炎性介质,造成肺组织损伤[11]。有研究报道给予LPS刺激后,模型小鼠体内IL-1β,IL-18,TNF-α,MCP-1,MIP-1β,M-CSF等促炎因子水平均明显上升[12-16]。本实验结果显示,LPS所诱导的中毒模型小鼠血清中促炎因子IL-18,IL-1β,IL-5,TNF-α,MCP-1,MIP-1β,M-CSF,GM-CSF的水平均明显升高,且肺组织内中性粒细胞浸润明显,与文献报道相符,表明造模成功。荆芥挥发油预防给药,0.452,0.226 g·kg-1剂量均能显著降低血清IL-1β,IL-5,TNF-α,MCP-1,MIP-1β,M-CSF含量,0.452 g·kg-1剂量同时能降低血清中IL-18,GM-CSF水平,表明荆芥挥发油能通过抑制大量促炎细胞因子的释放来减轻模型小鼠的炎性损伤,是其抗炎机制之一。此外,病理学组织检测发现,荆芥挥发油0.226 g·kg-1剂量能使肺组织内嗜中性粒细胞浸润减少,显示出良好抗炎效应。
此外,实验结果显示,LPS诱导的中毒模型小鼠全血白细胞计数显著增加,血小板计数明显下降,脾脏指数、肺指数显著升高,胸腺指数显著降低,均体现出LPS对血液系统及器官组织的损伤表现,与文献报道相符[15],然而荆芥挥发油预防给药对上述损伤表现的干预作用不明显。
综上,荆芥挥发油预防给药对内毒素中毒模型小鼠具有一定保护作用,主要是通过减轻炎症反应来发挥保护作用,作用机制与下调促炎因子的释放,减轻炎性细胞浸润有关。但其对于炎症反应相关信号通路的影响有待进一步探讨。
[参考文献]
[1] 雷载权. 中药学[M]. 上海:上海科学技术出版社,1995:32.
[2] 楊旋. 荆芥挥发油抗炎作用的机理研究Ⅱ[D]. 成都:成都中医药大学,2006.
[3] 曾南,沈映君,任永欣,等. 荆芥挥发油抗炎作用机理的实验研究[J]. 中药材,2006,29(4):359.
[4] 曾南,沈映君,刘旭光,等. 荆芥挥发油抗炎作用研究[J]. 中药药理与临床,1998,14(6):24.
[5] 沈映君. 中药解表方药研究[M]. 北京:中国医药科技出版社,2004:231.
[6] 解宇环,郭沛鑫,缪飞,等. 胡薄荷酮对急性炎症动物模型影响的实验研究[J]. 时珍国医国药,2013,24(6):1344.
[7] 郭沛鑫,解宇环,敖丽. 胡薄荷酮对LPS致急性肺损伤大鼠肺组织NF-κB、My D88 含量的影响[J]. 天然产物研究与开发,2013(11):1503.
[8] 张丽,冯有龙,丁安伟. 荆芥化学成分研究[J]. 中药材,2001,24(3):183.
[9] 张霞,剡根强,王静梅. 细菌内毒素的研究概况[J]. 上海畜牧兽医通讯,2006(4):4.
[10] Heine H,Rietschel E T,Ulmer A J,et al. The biology of endotoxin[J]. Mol Biotechnol,2001,19(3):279.
[11] Baluk P,Yao L C,Feng J,et a1.TNF-alpha drives remodeling of blood vessels and lymphatics in sustained airway inflammation in mice[J]. Clin Invest,2009,119:2954.
[12] 张群,雷林生,周桂保,等. 灵杆菌多糖对内毒素所致小鼠休克死亡的保护作用及其机制研究[J]. 解放军医学杂志,2011,36(10):1065.
[13] 王崇伟,程锐,秦勤,等. 内毒素致新生大鼠急性肺损伤IL-18的变化[J].中国新生儿科杂志,2006,21(4):210.
[14] 张海英. sRAGE对脂多糖介导的小鼠急性肺损伤的作用[D]. 沈阳:中国医科大学,2007.
[15] 王兵,王勇强,邵蕾,等. 加味凉膈散对脂多糖诱发小鼠血小板减少症的影响[J]. 山东医药,2011,51(45):30.
[16] Trapnell B C,Whitsett J A. GM-CSF regulates pulmonary surfactant homeostasis and alveola rmacrophage-mediated innatehost defense [J]. Annu Rev Physiol,2002,64(1):775.
[責任编辑 马超一]

