灯盏花素提取纯化工艺及其片剂的制备
葛月宾,尚莹莹,黄 琳,王双奇,雷丛林
(中南民族大学 药学院,武汉 430074)
灯盏花素提取纯化工艺及其片剂的制备
葛月宾,尚莹莹,黄 琳,王双奇,雷丛林
(中南民族大学 药学院,武汉 430074)
为确定灯盏细辛中灯盏花素的提取纯化工艺,以70%乙醇溶液超声波提取灯盏细辛药材,醇提浸膏进行HP-20大孔吸附树脂洗脱和酸沉工艺纯化,在(335±1) nm波长处采用紫外分光光度法测定了野黄芩苷的含量.以乳糖、蔗糖和微晶纤维素为填充剂,以交联聚维酮为崩解剂,制备了灯盏花素片剂(野黄芩苷标示量20 mg)并开展了质量检查.结果表明:大孔吸附树脂20%,50%,80%乙醇洗脱部位经酸沉后测定的含量分别为98%,79.8%,42.1%,而50%乙醇洗脱部位的得率最高达到12.14%.优选灯盏花素片剂处方为主药12%,MCC 40%,PVPP 30%,蔗糖13%,乳糖5%,硬脂酸镁0.5%,50%乙醇适量.该提取纯化方法能获得较高野黄芩苷含量的灯盏花素,制备的片剂质量检查合格.制备工艺操作性强,重现性好,能适应于工业大生产的需求.
灯盏细辛;灯盏花素;紫外分光光度法;提取纯化;片剂
灯盏细辛为菊科植物短葶飞蓬Erigeronbreviscapus(Vant.)Hand.-Mazz.的干燥全草,其性味辛、微苦、温[1],主治小儿疳积、小儿麻痹及脑膜炎的后遗症、牙痛、小儿头疮等[2].灯盏花素为该植物中提取分离所得的提取物,主要成分为灯盏花乙素又名野黄芩苷(结构式如图1),它是灯盏细辛中发挥主要生物活性的黄酮类成分,具有扩张脑血管、降低脑血管阻力、增加脑血流量、改善微循环、抗血小板聚集等多种药理作用,目前已广泛用于临床治疗各种心、脑血管疾病[3],也是灯盏细辛和灯盏细辛制剂的主要质量控制指标成分,研究灯盏花素提取纯化的工艺更有利于其药材的开发和利用.
目前对灯盏花素的含量测定、药理活性等已进行了较为充分的研究,但目前常见剂型口服生物利用度、起效时间等方面存有缺陷,难以得到高纯度的提取物,本文采用超声波法提取药材(灯盏细辛)后,HP-20大孔树脂柱洗脱,酸沉法纯化,得灯盏花素主要集中在20%和50%的乙醇洗脱部位段.2015版《中国药典》中将灯盏细辛提取物通过大孔树脂柱,仅用水洗脱,收集洗脱液浓缩、酸沉、结晶即得.灯盏花素的主要成分野黄芩苷溶于碱、吡啶、冰醋酸,但不溶于水,故灯盏花素在水部位含量极低.本文给出的灯盏花素提取纯化方案较药典更简单、可行、有效,将含量≥90%的灯盏花素经处方筛选制得片剂,质量检查合格,可为其制剂处方、工艺设计及生物药剂学研究提供参考.
1 材料与方法
1.1 材料和仪器
灯盏细辛全草(云南菊花村中药材市场),HP-20型大孔树脂柱(日本三菱化学),野黄芩苷对照品(110842,中国食品药品检定研究院),市售灯盏花素片(国药准字Z44023596,广东彼迪药业),其他试剂均为分析纯.
紫外分光光度计(UV-1800型,上海美谱达),旋转蒸发器(RE-52AA型,上海亚荣生化),低速离心机(TDZ-5型,长沙平凡仪器仪表),电子天平(FA1004N型,上海民桥精密科学仪器),单冲压片机(TDP-5型,中南制药机械厂),片剂四用测定仪(SY-2D型,上海黄海药检仪器).
1.2 灯盏花素的提取
称取100 g灯盏细辛,用70%乙醇浸泡24 h,超声波提取3次[4],每次1 h,每次提取溶剂量为10倍药材量(g·mL-1).70%乙醇提取液用滤纸过滤、合并,经减压浓缩得浸膏,重复3次,计算出膏率和野黄芩苷提取率[5,6]:出膏率(%)=干浸膏重量/提取用生药重量×100% ,野黄芩苷提取率(%)=野黄芩苷重量/提取用生药重量×100% .
1.3 灯盏花素的纯化
1.3.1 大孔树脂纯化
称取350 g HP-20型大孔树脂,无水乙醇湿法装柱,上述灯盏花素浸膏干法拌样上柱,依次用水,20%、50%、80%乙醇洗脱得到5个部位.
1.3.2 碱溶酸沉精制
上述各个大孔树脂洗脱部位以m(生药量)∶V(水)=1∶0.4(g·mL-1),加沸蒸馏水使溶解,加NaOH溶液调节pH 8.0,趁热过滤,滤液加热,缓慢加入10% H2SO4溶液调节pH 3.0,在50~55℃保温15 min,4000 r/min离心收集沉淀,母液静置过夜再离心,合并沉淀,蒸馏水洗涤至中性pH 7.0,50℃真空干燥[6].灯盏花素的提取纯化流程即为70%的乙醇超声提取3次,得醇提物浸膏,浸膏过HP-20打孔树脂柱,经水,20%、50%、80%乙醇洗脱得到5个部位,各个部位分别通过碱溶酸沉工艺精制,最后测定其中灯盏花素的含量.
1.4 灯盏花素中野黄芩苷的含量测定
1.4.1 检测波长的确定
精密称量野黄芩苷对照品5.0 mg,用甲醇配制成8 mg·mL-1的溶液,以甲醇为空白溶剂,在200~700 nm处进行全波长扫描,结果表明:野黄芩苷在(335±1) nm处有最大吸收,故确定其为含量测定的检测波长.
1.4.2 含量测定
根据灯盏花素中药部颁标准[7],取灯盏花素样品约5 mg,精密称定,置于50 mL量瓶中,加甲醇适量,于水浴约50℃振摇使溶解,放冷,用甲醇稀释至刻度,摇匀,精密量取2.0 mL,置25 mL量瓶中,用甲醇稀释至刻度,摇匀,置1 cm吸收池中,以甲醇为空白,照分光光度法(附录V A),在(335±1) nm波长处测定吸收度,按灯盏花乙素(C21H18O12)的吸收系数(E1% 1cm)为570计算,即得.吸光度与样品浓度的计算公式:
(1)
根据公式(1)计算所含野黄芩苷的浓度C值,并按下式计算其含量:
野黄芩苷含量(%)=[(C×25×50)/2]/W×100% .
(2)
1.5 片剂处方的筛选
以含野黄芩苷(C21H18O12)不低于90%的灯盏花素为原料药,采用湿法制粒压片法制备片剂,根据片剂的质量项目评价和筛选各组成辅料的种类和用量[8].
1.6 质量检查
根据《中国药典》2015年版四部“制剂通则0101”开展灯盏花素的质量评价.片剂外观应完整、光洁、色泽均匀、无异物.取自制片20片,精密称定总重量求得均重后,再分别精密称定各片的重量.灯盏花素片平均重为0.155 g,重量差异限度为±7.5%.自制片剂能承受40~60 N的压力,认为合格.未检出断裂、龟裂及粉碎的片.参照《中国药典》2015年版四部“通则0921”崩解时限检查法进行测定.自制片剂崩解时限在15 min之内.
1.7 溶出度测定
1.7.1 最大吸收波长的确定
精密称取野黄芩苷对照品适量(约5 mg),置于50 mL量瓶中,超声30 min使溶解,定容,精密吸取2 mL,置于25 mL量瓶中,以pH 6.8磷酸盐缓冲液为介质,全波长扫描测定紫外吸收.结果表明:该溶液在335 nm的波长处有最大吸收,同法测得辅料及溶剂系统对野黄芩苷在335 nm波长处的最大吸收无影响,与文献[7]一致.
1.7.2 标准曲线的绘制
精密称定干燥的野黄芩苷对照品约5 mg,置50 mL容量瓶中,加甲醇溶解得0.1 mg·mL-1的对照品.分别精密吸取对照品溶液1.0,2.0,3.0,4.0,5.0 mL分别置于25 mL量瓶中,加甲醇定容、摇匀,得浓度为4,8,12,16,20 μg·mL-1标准溶液,在(335±1) nm波长处测定吸收度,标准曲线为y=0.01043+0.074x,r=0.99989(pH= 6.8 PBS),在3.684~18.42 μg/mL浓度范围内线性关系良好(见图2).
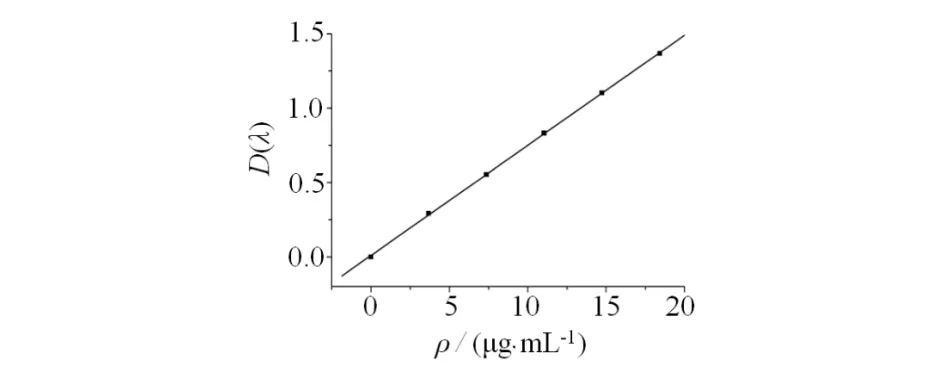
图2 PBS作溶剂的标准曲线Fig.2 Standard curve of PBS as solvent
1.7.3 溶出度的测定
取灯盏花素片6片,依照溶出度测定法[9,10],以pH=6.8 的PBS 900 mL为溶出介质,转速5 r·min-1,温度为(37±1)℃,分别在5,10,15,30,45,60 min时,取溶出液10 mL,立即过滤并补液10 mL,样品溶出液经0.8 μm微孔滤膜滤过,弃去初滤液,取续滤液4.0 mL,置10 mL量瓶中,加溶出介质稀释至刻度,于(335±1) nm处测其吸收度,代入以pH=6.8 的PBS为溶剂的标准曲线方程中,计算累积溶出百分率.
1.8 制剂含量测定
1.8.1 最大吸收波长的确定
采用铝盐显色法[11]测定,因铝盐法对极微量的黄酮类化合物显色明显,测定更准确.精密称取野黄芩苷对照品约5 mg置于50 mL量瓶中,超声30 min使溶解,定容,精密吸取2 mL,置于25 mL量瓶中,加入10% AlCl3溶液3.0 mL,醋酸-醋酸钾缓冲溶液3.0 mL,加甲醇稀释至刻度,摇匀,放置30 min,用紫外分光光度计全波长扫描,结果在(353±1) nm和(297±1) nm波长处有吸收峰,为避免末端吸收的干扰,故选择(353±1) nm为参考波长,同法测得辅料及溶剂系统对野黄芩苷在353 nm波长处的最大吸收无影响.
1.8.2 标准曲线的制备
精密称取野黄芩苷对照品约5 mg置于50 mL量瓶中,加甲醇,超声30 min使溶解,定容,精密量取对照品溶液1.0,2.0,3.0,4.0,5.0 mL,分别置于25 mL量瓶中,加入显色剂,在(353±1) nm波长处测定吸收度,标准曲线y=0.00203+52.99504x,相关系数r=0.99965,线性范围4.16~20.80 μg·mL-1(见图3).
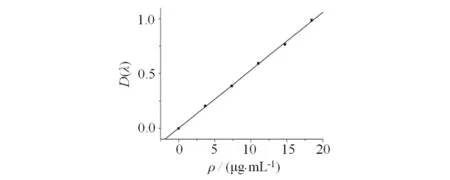
图3 甲醇作溶剂的标准曲线Fig.3 Standard curve of methanol as solvent
1.8.3 含量测定
取灯盏花素片10片粉碎、混匀,精密称量0.155 g(每片含灯盏花素20 mg)置100 mL容量瓶中,加甲醇稀释,精密量取2.0 mL溶液置25 mL容量瓶中,加入显色剂,测定吸收度值,根据1.8.2项中标准曲线计算溶液的浓度和药物百分含量.
2 结果与分析
2.1 大孔树脂精制结果
灯盏细辛精制和纯化结果见表1,表1中50% 乙醇洗脱得到的纯化物中野黄芩苷得率最高,达到12.14%;进一步碱溶酸沉后,20%乙醇部位所得野黄芩苷含量最高,达到98%,表明该部分灯盏花素所含成分非常纯,达到实验要求的90% 以上,可作为原料药进行压片.
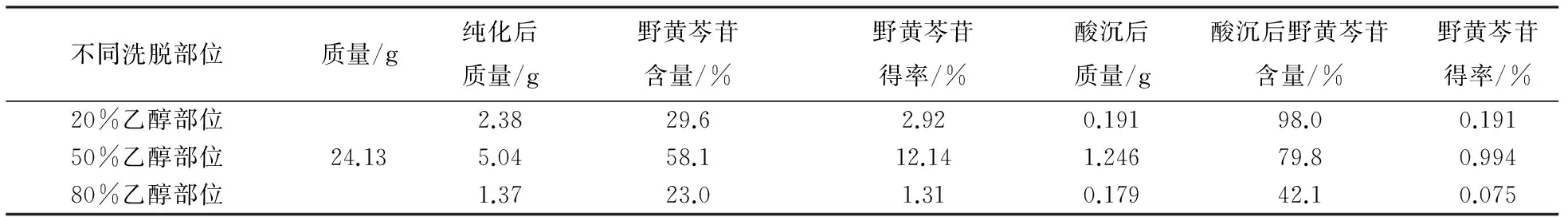
表1 灯盏细辛精制和纯化结果Tab.1 Fleabane refining and purification results of E.breviscapus
2.2 处方筛选
PVPP为30%时,在15 min内完全崩解,符合规定;考察了常用的润滑剂滑石粉、硬脂酸镁及其不同加入量的助流性能,比较其休止角、流速及片重差异,选定以0.5%硬脂酸镁为润滑剂;得到优选处方如下:灯盏花素1.87 g(质量分数12%,下同),蔗糖2.02 g(13%),MCC 6.22 g(40%),PVPP 4.67 g(30%),硬脂酸镁0.078 g(0.5%),乳糖0.78 g(5%),50%乙醇适量.制成100片,每片总重0.155 g.
取一定量的灯盏花素、蔗糖、乳糖、MCC、PVPP、硬脂酸镁粉碎过筛,50%乙醇搅匀,备用;精密称取处方量的灯盏花素、蔗糖、乳糖、MCC、PVPP按等量递增法混合均匀,用50%乙醇作为润湿剂,20目筛湿法制粒,50℃鼓风干燥 60 min,18 目筛整粒,加入硬脂酸镁0.5%,混和均匀,压片,控制片重 155 mg.
2.3 片剂的质量检查
片剂呈淡黄色、表面光滑、色泽均匀、无杂斑、无异物.脆碎度减失重量未超过1%,且未检出断裂、龟裂及粉碎的片.随机取自制片和市售片各6片,检测硬度和崩解时限,结果见表2.

表2 片剂的硬度和崩解时限的测定Tab.2 Determination of tablet hardness and disintegration
由表2可知:自制片和市售片的硬度符合标准;自制片的崩解时限符合普通片剂的要求,而市售片满足分散片在3 min内崩解完全的要求.
2.4 溶出度的测定
自制药的溶出曲线图见图4.由图4可知:自制药的溶出度为92%~94%,符合药典对于一般片剂的标准,故合格.;而市售药在5 min之内的溶出量已经达到85%,再结合其崩解时限分析,该市售片可能为分散片.本品的溶出度检测方法重复性好,准确性高,简便可行,可用于灯盏花素片的质量控制.

a)市售药;b)自制药
2.5 片剂的含量测定
自制药的野黄芩苷含量测定结果平均标示量为106%(见表3),符合药典规定,合格.

表3 自制药的含量测定Tab.3 Determination of the content of self-made tablet
3 结论
(1)采用超声波乙醇回流提取法提取灯盏花素,该提取法提取率高、操作简便、能耗和成本低.用野黄芩苷作对照品,铝盐法显色后的扫描图谱出现了两个吸收峰,取(335±1) nm波长处为最大吸收峰.
(2)溶出试验中灯盏花素属黄酮类成分,主要含灯盏花乙素,在碱性或近中性介质中易溶.灯盏花乙素在磷酸盐缓冲液(pH 6.8)中溶解度为4.6 mg·mL-1,能够满足漏槽条件.
(3)采用超声波法提取药材(灯盏细辛)后,HP-20大孔树脂柱洗脱,酸沉法纯化,得到了较高含量的灯盏花素,实验操作简单、可行、有效;含量≥90%的灯盏花素经处方筛选制得片剂,质量检查合格.
(4) 本文采用了紫外分光光度法和铝盐显色法测定了灯盏花素的含量.在国家药品标准中,灯盏花素片和灯盏花注射液中灯盏花素的含量测定均采用紫外分光光度法,但该方法对灯盏乙素的选择性差[12];而铝盐显色法更加精确.所以,灯盏花素的提取纯化和片剂的溶出度测定用紫外分光光度法;而片剂的含量测定用铝盐显色法.
[1] 国家药典委员会.中国药典:I部[M].北京:化学工业出版社, 2010: 138.
[2] 林 镕, 陈艺林, 石 铸.中国植物志(第74卷)菊科(一)[M].北京:科学出版社, 1985: 308-309.
[3] 颜 承, 徐冠玲, 谢 梦, 等.野黄芩苷和野黄芩素制备研究进展[J].中成药, 2015,37(8): 1785-1790.
[4] Hu X, You J, Bao C, et al.Determination of toatal flavonoids inScutellariabarbataD.Don by dynamic ultrasonic extraction coupled with on-line spectrophotometry[J].Anal Chim Acta, 2008,610(2): 217-223.
[5] 许志刚, 巫莹莹, 刘智敏.灯盏花中灯盏花乙素的提取工艺研究[J].昆明理工大学学报(自然科学版),2013,38(5): 96-100.
[6] 廖矛川, 罗会畏, 李 竣, 等.黄芩苷提取精制工艺研究[J].中南民族大学学报(自然科学版),2013, 32(2): 69-72.
[7] 中华人民共和国卫生部.灯盏花素片质量标准,卫生部中药标准:中药成方剂第十三册(WS3-B-2516-97)[S/OL].http://www.docin.com/p-47002994.html.
[8] 葛月宾,李孟顺,代 黔.复方甘草片的薄膜包衣处方研究[J].中南民族大学学报(自然科学版),2012,31(1):58-60.
[9] 姜志远, 刘世萍, 曲 婷.灯盏花素片溶出度测定方法的考察[J].中国药师,2011,14(7): 1014-1016.
[10] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准:部颁药品标准[S].北京:人民卫生出版社,1964.
[11] 方崇波.紫外分光光度法测定灯盏花素粉末注射剂的含量[J].海峡药学,2010,24(10):78-80.
[12] 石森森,徐莲英,毛展凯.灯盏花素的理化性质及其稳定性影响因素研究[J].中国中药杂志,2009,34(7):843-847.
Extraction, Purification and Tablets Preparation of Breviscapine fromErigeronbreviscapus
GeYuebin,ShangYingying,HuangLin,WangShuangqi,LeiConglin
(School of Pharmaceutical Sciences,South-Central University for Nationalities,Wuhan 430074,China)
To investigate the extracting and refining technique of breviscapine fromErigeronbreviscapus,E.breviscapuswas extracted with 70% ethanol solution by ultrasonic method.The alcohol extract was eluted using HP-20 macroporous resin and purified with an acid precipitation process.UV spectrophotometry was used to determine the yield of scutellarin at a wavelength of (335±1) nm.Breviscapine tablets (with the labelled content of scutellarin 20 mg) were then prepared using lactose, sucrose and microcrystalline cellulose as filler and crosslinked povidone as disintegrating agent, respectively.The qualities of the tablets were also evaluated.The results showed that the content of scutellarin was 98%, 79.8%, 42.1% in the eluent of 20%, 50%, 80% ethanol, respectively, after the acid precipitation.And the elution with 50% ethanol afforded the highest yield of 12.14%.The optimized formulation of breviscapine tablets consisted of 12% breviscapine, 40% MCC, 30% PPVP, 13% sucrose, 5% lactose, 0.5% magnesium stearate and an appropriate amount of 50% ethanol.This technique proved highly efficient for the extraction and purification of scutellarin.The formulation and the prepared breviscapine tablets were up to standard, and the process was workable and reproducible, which may be adapted for industrial scale production.
E.breviscapus;breviscapine;UV spectrophotometry;extraction and purification;tablets
2016-01-01
葛月宾(1979-),女,教授,博士,研究方向:药物制剂及中药、民族药开发,E-mail: geyuebin@mail.scuec.edu.cn
湖北省自然科学基金资助项目(2013CFA013)
TQ460.6;R283.6
A
1672-4321(2017)01-0052-05

