青蒿提取物舒张小鼠气管平滑肌的作用机理
沈金花,黄 俊
(中南民族大学 生命科学学院,医学生物研究所&武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
青蒿提取物舒张小鼠气管平滑肌的作用机理
沈金花,黄 俊
(中南民族大学 生命科学学院,医学生物研究所&武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
分别使用L型钙离子通道(VDCCs)激动剂高钾溶液( 80 mmol/L KCl )和M受体激动剂乙酰胆碱(ACh)对小鼠离体气管环进行预刺激,研究了青蒿提取物(WEAA)对激动剂诱导的收缩反应的抑制作用.结果表明:WEAA能够抑制高钾和ACh诱导的预收缩,且呈剂量依赖性,浓度为10 mg/mL时完全抑制,而对静息状态下的气管环无作用.此外,WEAA阻断了VDCCs电流,抑制了高钾和ACh引起的胞外钙离子内流.而在ACh诱导的收缩反应中,该抑制效果不仅涉及VDCC通道,还有其他离子通道的参与.WEAA能够抑制ACh引起的内质网中钙离子的释放,且对气管环的收缩能力几乎无影响.结论:WEAA能够通过阻断VDCC通道和ACh激活的其他离子通道抑制外钙内流和细胞内钙释放,从而舒张小鼠气管平滑肌.WEAA有望作为一种潜在的气管扩张剂,用于治疗哮喘病.
青蒿提取物;气管平滑肌;哮喘
目前全球哮喘患者已超过3亿人, 哮喘的主要症状为气道阻塞、气道高反应和气道重塑,而气管平滑肌细胞过度收缩是形成气道高反应和气道阻塞的重要因素.气管平滑肌细胞的过度收缩使气道管腔缩小从而限制了气体交换,引起呼吸困难,甚至威胁患者的生命[1,2].目前用于治疗哮喘的药物主要为支气管扩张类药物,如β2肾上腺素能激动剂[3].
青蒿(ArtemisiaAnnuaL.) ,为菊科植物黄花蒿的地上部分.青蒿化学成份以青蒿素及其衍生物为主[4].目前,对于青蒿提取物的药用价值研究大部分集中在青蒿素的提取及应用上[5-7].而青蒿其他提取物是否也具有一定的药用价值并不清楚.基于此,提取青蒿水提取物,研究其对小鼠气管的舒张作用,以期获得用于扩张气管、治疗哮喘的药物.
1 实验材料
1.1 试剂和仪器
青蒿(购于北京同仁堂药房),乙酰胆碱(ACh)、硝苯地平、尼氟酸、木瓜蛋白酶、胶原蛋白酶H、牛血清蛋白(BSA)、二硫苏糖醇(DTT)(美国Sigma).
生理盐溶液( 2 Ca2+PSS):NaCl 135 mmol/L,KCl 5 mmol/L,CaCl22 mmol/L,Glucose 10 mmol/L,HEPES 10 mmol/L,MgCl2·6H2O 1 mmol/L.无Ca2+PSS ( 0 Ca2+PSS): NaCl 135 mmol/L,KCl 5 mmol/L,EGTA 0.5 mmol/L,Glucose 10 mmol/L,HEPES 10 mmol/L,MgCl2·6H2O 1 mmol/L.Ca2+母液: CaCl2120 mmol/L.rTASM解离液:NaCl 120 mmol/L,KCl 5.2 mmol/L,MgCl21.2 mmol/L,NaHCO325 mmol/L,KH2PO40.6 mmol/L,CaCl20.1 mmol/L,D-glucose 11 mmol/L,HEPES 10 mmol/L.细胞外液:NaCl 105 mmol/L,CsCl 6 mmol/L,BaCl227.5 mmol/L,Glucose 11 mmol/L,HEPES 10 mmol/L,TEA-Cl 10 mmol/L.电极内液:CsCl 130 mmol/L,EGTA 10 mmol/L,MgCl24 mmol/L,MgATP 4 mmol/L,HEPES 10 mmol/L.
离体组织器官恒温灌流系统(HV-4,成都泰盟科技有限公司),生物机能实验系统(BL-420S,成都泰盟科技有限公司),张力换能器(JH-2,航天医学工程研究所),膜片钳放大器(HEKA,EPC-10,德国Lambrecht),玻璃微电极(外径1.4 mm,南京泉水教学实验器材厂),中草药粉碎机(天津市秦斯特仪器有限公司).
1.2 实验动物
SPF级6周龄BABL/c雄性小鼠购于湖北省疾控中心.在控温、控湿的条件下,自由饮水进食.动物实验和处理均遵照《中南民族大学实验动物使用与福利指导手册》.
2 实验方法
2.1 青蒿提取物的制备
青蒿粉碎,取青蒿粉50 g,加入1L超纯水,55 ℃保温3 h,过滤得滤液,滤渣加入1 L超纯水,55 ℃保温3 h,过滤,合并滤液,浓缩至100 mL,加石油醚萃取过夜,去上层,下层水部浓缩得膏状物,烘干备用.
2.2 小鼠离体气管环的处理与上样
取体重在20~25 g的小鼠,颈部脱臼处死,立即取出气管置于含PSS生理溶液的解剖盘中,仔细剔除气管周围的结缔组织,制成约7 ms气管环后与挂钩连接,衔接于张力换能器并置于6 mL平衡液(PSS生理溶液)中,37 ℃温浴,通入高纯氧(99.99 %)达到饱和.调节气管初始前负荷为300 mg.开始平衡,每隔15 min换一次平衡液,共换液4次,平衡完成后,使用80 nmol/L高钾溶液或10 μmol/L Ach溶液进行预刺激,充分刺激后换液洗脱至恢复至基线.
2.3 小鼠气管平滑肌细胞的制备
颈部脱臼处死小鼠后,迅速取出小鼠气管,置于含rTASM解离液的解剖皿中,分离出主气管及支气管后,沿肌条与软骨环的连接处剪开,去除软骨组织.将肌条放入37 ℃预热10 min的3 mg/mL木瓜蛋白酶中消化22 min,然后将肌条转入37 ℃预热10 min的1 mg/mL胶原酶H中消化8 min.然后将肌条清洗2次,转入含300 μL BSA的离心管,小心打散后置于冰上备用.
2.4 全细胞电流记录
通过EPC-10膜片钳放大器检测全细胞VDCC电流.钳制电压为-70 mV,维持50 ms,给予细胞去极化阶刺激1000 ms,刺激电压从-70 mV逐渐增加至+40 mV,每10 s增加10 mV,拾取步阶脉冲电流信号,通过PatchMaster软件分析电流信号,Origin8分析作图.
3 结果
3.1 青蒿提取物舒张高钾预收缩的小鼠气管环
WEAA能够呈剂量依赖性地舒张高钾预收缩的小鼠气管环(图1a, b),且与VDCC特异性阻断剂效果类似.浓度为10 mg/mL时达到完全舒张,舒张比例为(100.00±0.00)%(图1d).而对静息状态下的小鼠气管环无舒张作用(图1c).

图1 青蒿提取物和硝苯地平舒张高钾预收缩的小鼠气管环Fig.1 Relaxant effects of WEAA and Nifedipine on high K+-induced pre-contracted mouse tracheal rings
3.2 青蒿提取物阻断高钾引起的外钙内流
当细胞外无钙离子存在时,高钾无法引起小鼠气管环的收缩,当补充钙离子后,能够立即引起收缩反应,且能被随后的10 mg/mL WEAA完全阻断(图2a).给予WEAA孵育后,补充钙离子时无法引起收缩反应(图2b).结果表明WEAA能够阻断高钾引起的外钙内流.
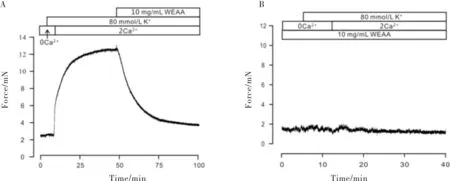
图2 WEAA阻断高钾引起的外钙内流.Fig.2 WEAA blocked high K+-evoked Ca2+ influx
3.3 WEAA阻断VDCC电流
全细胞模式下记录气管平滑肌细胞的VDCC电流.采用步阶电压刺激,使细胞产生内向电流(图3a),当电压为10 mV时得到最大激活电流(图3b),该电流能被WEAA和VDCC特异性阻断剂硝苯地平(nifedipine)完全阻断.
3.4 WEAA对ACh诱导的收缩反应
3.4.1 WEAA抑制ACh诱导的预收缩
ACh诱导的预收缩被WEAA抑制,抑制效果呈现剂量依赖性(图4a),量效曲线如图(图4b).
3.4.2 WEAA阻断ACh诱导的钙离子内流
ACh诱导的预收缩被硝苯地平部分抑制(图5a),阻断了L型钙通道,余下的部分被10 mg/mL WEAA完全阻断.提前孵育10 mmol/L硝苯地平阻断L型钙离子通道后,在胞外无钙离子的条件下加入ACh(图5b),气管平滑肌产生一个瞬时的收缩,提示钙库贮存的钙离子释放.当提前孵育了WEAA后(图5c),该内钙释放过程被抑制,同时补充钙离子后引起的收缩反应也被显著抑制.以上结果表明,WEAA能作用于ACh激活的除L型钙离子通道之外的其他离子通道,抑制胞外钙离子内流,使ACh预收缩的气管环舒张.另外,WEAA还能抑制平滑肌细胞钙库钙离子的释放.

图3 WEAA阻断VDCC电流Fig.3 WEAA blocked VDCC currents

图4 WEAA呈剂量依赖性地抑制ACh诱导的预收缩Fig.4 WEAA inhibited ACh-induced precontraction in a dose-dependent manner
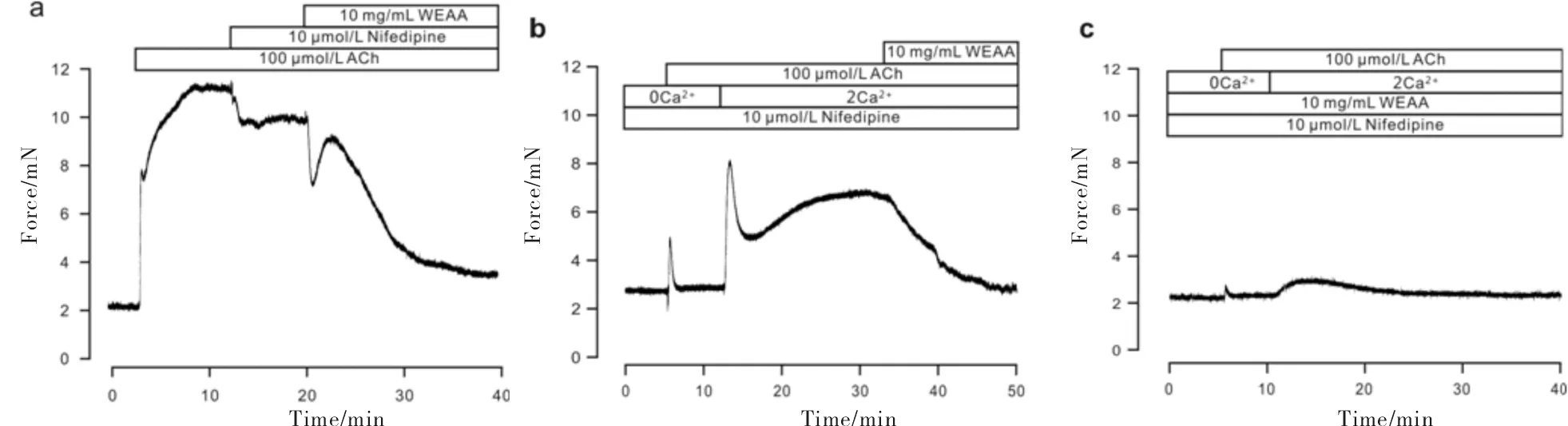
a) WEAA抑制了L型钙通道以外的其他通道;b、c) WEAA抑制了ACh引起的内钙释放
3.5 WEAA对小鼠气管环收缩能力的影响
如图6a所示,加入浓度梯度的WEAA后,ACh诱导的预收缩(图中a点所示)被抑制,且当浓度为10 mg/mL(图中b点所示)时抑制效果达到最大.洗去ACh和WEAA后,再次加入ACh进行收缩刺激(图中c点所示),发现其收缩活性几乎不受影响(图6b).
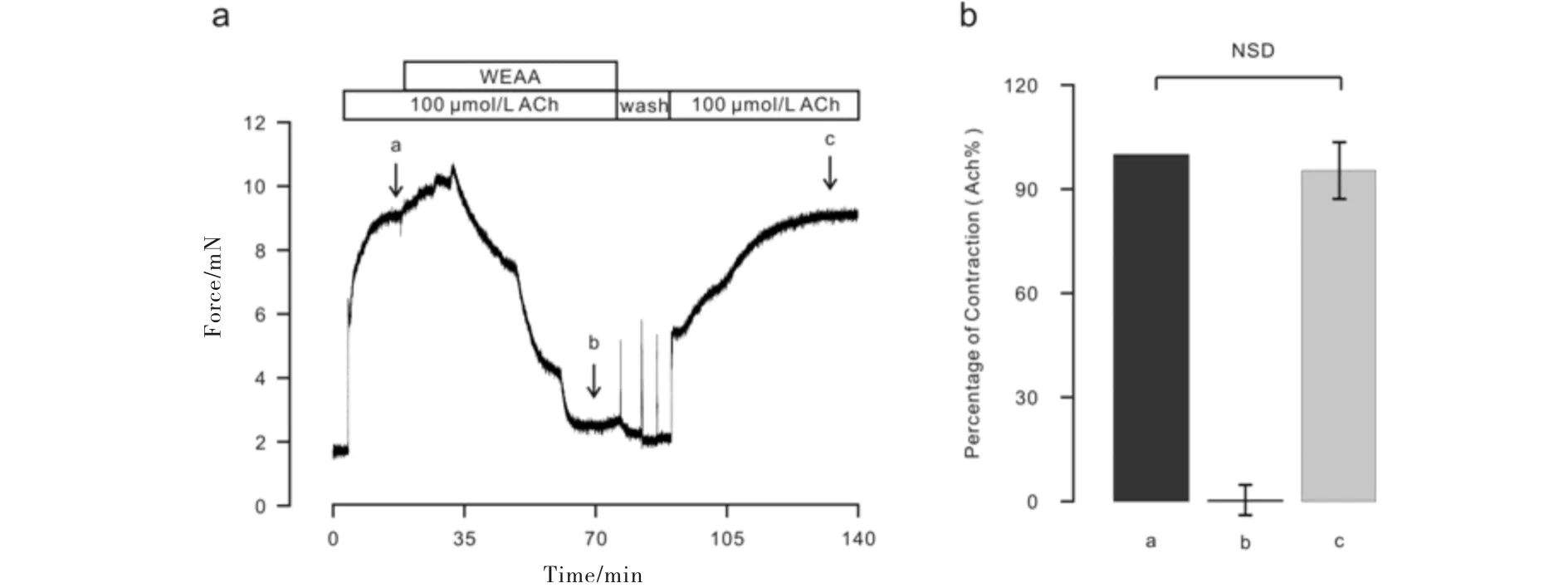
图6 WEAA对小鼠气管环收缩能力的影响Fig.6 Thecontractility effects of WEAA on mouse tracheal rings
4 结语
哮喘是一种主要由过敏原引起的呼吸系统疾病.气管经过敏原刺激后,产生一系列收缩反应,使气管过度收缩,引起患者呼吸困难,严重者甚至引起死亡.因此研究有效扩张气管的药物显得尤其重要.
气管的收缩反应主要与细胞内钙敏感信号通路有关.胞内钙离子与钙调蛋白结合,促进下游肌球蛋白的磷酸化,使胞内肌动蛋白微丝相互牵引,从而引起气管平滑肌细胞收缩[8, 9].本文使用高钾和乙酰胆碱作为激动剂,对离体小鼠气管进行预收缩反应.高钾作为一种去极化试剂主要通过激活L型钙离子通道(VDCC),引起胞外钙离子内流,胞内钙离子浓度增加,从而激活钙敏感信号通路,引起气管平滑肌收缩[10].结果表明,青蒿提取物能够完全抑制高钾诱发的收缩,且能够抑制胞外钙离子的内流.此外,通过膜片钳记录VDCC电流发现,WEAA能够完全阻断VDCC电流,这一阻断效果与VDCC特异性阻断剂硝苯地平一致.
乙酰胆碱作为一种常用的M受体激动剂[11],可以同时激活内质网RyR、IP3受体和细胞膜上一系列G蛋白偶联受体,使胞内钙离子浓度发生震荡,最终稳定并产生规律的收缩反应.钙离子浓度的变化过程涉及内质网钙离子的泵入和泵出,以及胞外钙离子的进入[12-14],其中外钙的进入有VDCC通道在内的多种离子通道参与,如Cl离子通道[15]、非选择性阳离子通道[16]等.本研究发现,WEAA能够完全抑制ACh诱导的收缩反应,并且能够抑制ACh引起的外钙内流、抑制内质网钙离子的释放.同时WEAA阻断ACh引发的外钙内流不仅有VDCC通道参与,当加入VDCC特异性阻断剂之后,余下的收缩部分能够继续被WEAA抑制,这表明WEAA抑制ACh诱导的收缩有VDCC通道之外的其他通道参与,可能为氯离子通道和非选择性阳离子通道等.
青蒿作为传统中药,目前主要用于抗疟疾特效药青蒿素及其衍生物的提取,其他生理活性及功能研究报告还不多.本文首次证明,青蒿水提取物有舒张气管平滑肌的作用.此外,结果还表明WEAA对小鼠气管组织的收缩能力几乎无影响.因此,青蒿将来有望作为一种潜在的气管扩张剂用于治疗哮喘.
[1] Postma D S, Kerstjens H A.Characteristics of airway hyperresponsiveness in asthma and chronic obstructive pulmonary disease [J].American Journal of Respiratory &Critical Care Medicine, 1998, 158(5 Pt 3):187-192.
[2] WestA R, Syyong H T, Siddiqui S, et al.Airway contractility and remodeling: links to asthma symptoms[J].Pulmonary Pharmacology &Therapeutics, 2012, 26(1):3-12.
[3] Han M K, Martinez F J.Pharmacotherapeutic approaches to preventing acute exacerbations of chronic obstructive pulmonary disease[J].Proceedings of the American Thoracic Society, 2011, 8(4):356-362.
[4] 屠呦呦, 倪慕云, 钟裕容,等.中药青蒿化学成分的研究Ⅰ[J].科技导报, 1981, 33(5):124-126.
[5] 李子颖, 李士雨, 齐向娟.青蒿素提取技术研究进展[J].中国现代中药, 2002, 4(2):17-21.
[6] 张 玲, 杜小英, 姜锦花.青蒿素提取分离工艺研究[J].现代中药研究与实践, 2005, 19(6):57-58.
[7] 李国栋, 周 全, 赵长文.青蒿素类药物的研究现状[J].中国药学杂志, 1998, 33(7):385-389.
[8] Janssen L J.Ionic mechanisms and Ca(2+) regulation in airway smooth muscle contraction: do the data contradict dogma?[J].Ajp Lung Cellular &Molecular Physiology, 2002, 282(6):1161-1178.
[9] Berridge M J.Elementary and global aspects of calcium signalling [J].Journal of Experimental Biology, 1997, 200(2):315-319.
[10] Prakash Y S, Kannan M S, Sieck G C.Regulation of intracellular calcium oscillations in porcine tracheal smooth muscle cells[J].American Journal of Physiology, 1997, 272(3 Pt 1):966-975.
[11] Du W, Mcmahon T J, Zhang Z S, et al.Excitation-contraction coupling in airway smooth muscle[J].Journal of Biological Chemistry, 2006, 281(40):30143-30151.
[12] Janssen L J, Sims S M.Acetylcholine activates non-selective cation and chloride conductances in canine and guinea-pig tracheal myocytes[J].Journal of Physiology, 1992, 453(3):197-218.
[13] Dai J M, Kuo K H, Leo J M, et al.Acetylcholine-induced asynchronous calcium waves in intact human bronchial muscle bundle[J].American Journal of Respiratory Cell &Molecular Biology, 2007, 36(5):600-608.
[14] Prakash Y S, Pabelick C M, Kannan M S, et al.Spatial and temporal aspects of ACh-induced [Ca2+]i oscillations in porcine tracheal smooth muscle[J].Cell Calcium, 2000, 27(3):153-162.
[15] Liu X, Farley J M.Acetylcholine-induced chloride current oscillations in swine tracheal smooth muscle cells[J].Journal of Pharmacology &Experimental Therapeutics, 1996, 276(1):178-186.
[16] Janssen L J, Sims S M.Spontaneous transient inward currents and rhythmicity in canine and guinea-pig tracheal smooth muscle cells[J].Pflügers Archiv - European Journal of Physiology, 1994, 427(5):473-480.
Relaxant Action ofArtemisiaAnnuaL.Extract on Mouse Airway Smooth Muscle
ShenJinhua,HuangJun
(Institute for Medical Biology &Hubei Provincial Key Laboratory for Protection and Application of Special Plant Germplasm in Wuling Area of China, College of Life Sciences, South-Central University for Nationalities, Wuhan 430074, China)
Water extract ofArtemisiaAnnuaL.( WEAA ) was prepared and used to survey the relaxant effect on mouse airway smooth muscle.In order to investigate it, high K+or ACh was employed, which was a specific activator of L-type Ca2+channel(VDCC)or M-Receptor, respectively.Firstly, a dose-dependent relaxant manner was presented on high K+and ACh-induced pre-contracted mouse tracheal rings when treated with WEAA, and they were relaxed completely in 10 mg/mL of WEAA.However, no effect was examined on resting tension.VDCCs were completely blocked and Ca2+influx was inhibited in both high K+and ACh-induced pre-contracted ASM.These results suggest that other membrane channels might be also involved in this process.Secondly, the intracellular Ca2+release was inhibited, and no significant effect was found on contractility of mouse tracheal rings after the treatment of WEAA.The data demonstrate that WEAA resulted in relaxation of pre-contracted ASM by blocking VDCC and other membrane channels to inhibit Ca2+influx and intracellular Ca2+release.This study indicates that WEAA would be a potential bronchodilators for asthma.
ArtemisiaAnnuaL.extract;airway smooth muscle;asthma
2016-12-17
沈金花(1975-),女,教授,研究方向:疾病相关基因的功能研究,E-mail:shenjinhua2013@163.com
国家自然科学基金资助项目(81170227);湖北省自然科学基金重点资助项目(2012FFA028)
Q474;R734.2
A
1672-4321(2017)01-0037-06

