热休克蛋白70-甲胎蛋白抗原表位肽疫苗抗小鼠H22肝癌细胞免疫机制的研究
胥 冰, 王巧侠, 王小平, 蔺焕萍, 马晓军, 张鹏飞, 赵 倩, 张克佩
(1. 陕西中医药大学 免疫及检验学教研室, 咸阳 712046; 2. 西安市中心医院 感染科, 西安 710003)
热休克蛋白70-甲胎蛋白抗原表位肽疫苗抗小鼠H22肝癌细胞免疫机制的研究
胥 冰1, 王巧侠2, 王小平1, 蔺焕萍1, 马晓军1, 张鹏飞1, 赵 倩1, 张克佩1
(1. 陕西中医药大学 免疫及检验学教研室, 咸阳 712046; 2. 西安市中心医院 感染科, 西安 710003)
分别以AFP多肽、HSP70 和HSP70-AFP多肽复合物免疫小鼠,检测各组CD8+T细胞培养上清IFN-γ、TNF-α、穿孔素、颗粒酶B水平及CD8+T细胞对H22细胞的杀伤作用,探讨热休克蛋白70(HSP70)-甲胎蛋白(AFP)抗原表位肽复合物对小鼠H22肝癌细胞的免疫效应。
甲胎蛋白 (AFP);热休克蛋白70( HSP70);多肽疫苗;抗瘤免疫
肝癌治疗主要采用放、化疗及手术,但均因其副作用大,术后3年存活率低而达不到理想的疗效。近年来以甲胎蛋白(AFP)为靶点的肿瘤疫苗的研发备受关注。AFP是肿瘤相关抗原,胚胎肝细胞的一种糖蛋白,胚胎期高表达,出生后低表达,当肝细胞癌变后AFP表达升高[1],70%的原发性肝癌病人可出现AFP高表达。研究表明甲胎蛋白存在不同的抗原表位,可为肝细胞癌的免疫治疗提供解决问题的途径[2-3]。但AFP在患者体内不能有效地被递呈从而激活免疫细胞,如何增强AFP的免疫原性,使免疫细胞能有效对其识别,才是解决问题的关键。应用AFP核酸疫苗,基因重组AFP载体介导DC细胞免疫等[4-6],依然不能有效增强AFP的免疫原性。另一简便而有效的方法即应用免疫佐剂,已证实热休克蛋白70具有良好的“免疫佐剂”效应,能与不同的肿瘤抗原肽结合诱发肿瘤特异性主动免疫。尤其对于抗原弱或难以诱发免疫的抗原,HSP70呈现了良好的内在免疫佐剂效应[7-9]。本实验将AFP表位肽与佐剂HSP70结合形成重组疫苗免疫小鼠, 观察荷瘤小鼠在重组疫苗诱导下产生针对AFP肿瘤,特异性细胞免疫的机制。
1 材料与方法
1.1 材料
40只6~8周龄健康C57BL/6小鼠(雌性),体质量(20±2)g。由西安交通大学医学院实验动物中心提供,动物许可证号: SCXK(陕) 2007-001;小鼠H22肝癌细胞株购自第四军医大学动物实验中心。MTT、纯化热休克蛋白70及淋巴细胞分离液(Sigma);胎牛血清及RPMI1640培养液(Hyclone);ELISA检测试剂盒及免疫磁珠MicroBead CD8+T细胞分选抗(Miltenyi Biotec);PHA(BD Biosciences);Shanghai Ziyu Biotechnology 公司合成AFP表位肽-FMNKFIYEI 9个氨基酸寡肽,HSP70-AFP表位肽复合物则通过氨基酸偶联法将热休克蛋白70羧基端与AFP表位肽氨基端相连,高效液相色谱纯化冻干粉,-20℃保存。超净工作台( 苏州净化);RT-2100C型酶联免疫检测仪(深圳雷杜科技有限公司);二氧化碳培养箱(BindCD -150);倒置显微镜(奥特BDS-200);全自动高压蒸汽灭菌器(日本三洋MLS-3780);电子精密分析天平(塞多利斯)。
1.2 方法
1.2.1 细胞培养及扩增
于含10%胎牛血清及双抗(100 U/青霉素、100 U/链霉素)的RPMI1640培养液中接种H22肝癌细胞,并于37℃,5% CO2饱和湿度扩增培养,台盼蓝染色检测细胞活力备用。
1.2.2 肿瘤模型小鼠的建立及体内肿瘤负荷实验
40只小鼠适应性喂养一周后随机分为:HSP70-AFP多肽疫苗组、HSP70组、AFP组、模型组。将扩增后的H22肝癌细胞制备成细胞悬液,密度为2×105/mL,接种于小鼠前肢右腋下,接种量为0.1 mL/只。3 d后,分别用生理盐水将HSP70-AFP多肽疫苗、AFP、HSP70稀释至1 μg /μL, 接种于小鼠右上肢腋下皮内0.1 mL/只,相当于10 μg/只剂量,于模型组同侧注射等量无菌生理盐水。首次免疫后,每隔1周等量、同法重复免疫1次,共3次。观察小鼠生存及体内肿瘤生长情况,每周3次测量实体瘤块大小并取均值,按照公式:4/3πr3(r表示半径)计算瘤块体积。
1.2.3 小鼠脾脏单个核细胞(PBMC)的分离
末次免疫后3 d处死全部小鼠,超净工作台取脾脏,灭菌生理盐水冲洗2次,剪碎并用无菌匀浆器研磨,200目无菌滤网过滤得滤液1 mL,( Ficoll-Hypaque法)用淋巴细胞分离液分离得PBMC,备用。
1.2.4 CD8+T细胞分选纯化-免疫磁珠分离法(MACS)
将各组PBMC计数,离心(1500 r/min,10 min)弃上清,每107细胞重悬于40 μL缓冲液中(PBS,含0.5%EDTA,0.5%小牛血清),加10 μL CD8+T 细胞生物素标记抗体混匀,5 min,4℃ 孵育,再将20 μL抗生物素磁珠加入其中混匀,4℃ 孵育10 min。将分离柱置分选器上,以3 mL无菌PBS缓冲液漂洗分离柱,用已被磁珠标记的细胞悬液过柱;收集流出的未标记细胞,备用。再以3 mL PBS缓冲液洗柱,继续收集流过液,其中即含所需CD8+T细胞[10-11]。流式细胞仪检测细胞纯化率。
1.2.5 CD8+T细胞的体外扩增培养
经流式细胞技术检测CD8+T细胞纯度达90%以上,将细胞置10%胎牛血清RPMI1640培养液内含PHA 5 μg/mL培养12 h, 37℃,5% CO2饱和湿度条件下继续扩增培养3 d,离心留上清,得沉淀细胞计数,调整细胞密度为5×106个/mL,备用。
1.2.6 检测小鼠CD8+T淋巴细胞培养上清TNF-α、穿孔素、IFN-γ、颗粒酶水平(ELISA)
参照TNF-α、穿孔素等ELISA试剂盒说明操作,检测上述离心上清液TNF-α、穿孔素、IFN-γ及颗粒酶的水平。
1.2.7 CD8+T淋巴细胞对H22肝癌细胞的杀伤作用
将扩增72 h的H22肝癌细胞,调整密度为5×104个/mL,于96孔细胞培养板接种培养,100 μL/孔。24 h后离心培养板,1000 r/min ,10 min,弃上清,即靶细胞。将体外扩增培养的CD8+T细胞,作为效应细胞加入相应的靶细胞孔中(效应细胞:靶细胞分别为10∶1、20∶1、40∶1),每孔加入10 μL 5 mg/mL MTT 液; 每组设3个复孔,37℃孵育4 h。去除培养液,加DMSO 150 μL/孔,置振荡器37℃振荡10 min,充分溶解结晶;酶标仪测各孔光密度值(波长490 nm)。计算细胞存活百分率(实验组D490 nm平均值/对照组D490 nm平均值×100%)。
1.2.8 统计学分析
SPSS 10.0软件包进行统计分析。使用Student- Newm an-Keuls方法及方差分析进行数据间比较,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体内肿瘤负荷实验结果
于各组小鼠接种H22肝癌细胞后,观察小鼠生存及体内肿瘤生长情况。发现HSP70-AFP多肽疫苗组较其他组动物食量好、活动自如、毛色光泽度好。30 d后空白组全部死亡;AFP组死亡6只;HSP70组死亡8只;HSP70-AFP组死亡3只,其余存活。证明HSP70-AFP多肽疫苗组保护效应较其他组明显(P<0.01),且该组瘤块体积明显偏小(P<0.01),具体结果见表1。
表1 各组小鼠接种H22细胞后瘤块体积比较
a:P<0.01,vs empty group; b:P<0.01, vs AFP group; c:P>0.05,vs empty group; the same below
2.2 流式细胞技术检测CD8+T细胞纯度
磁珠分离所得CD8+T淋巴细胞经流式细胞仪检测其纯度高达90%,见图1。
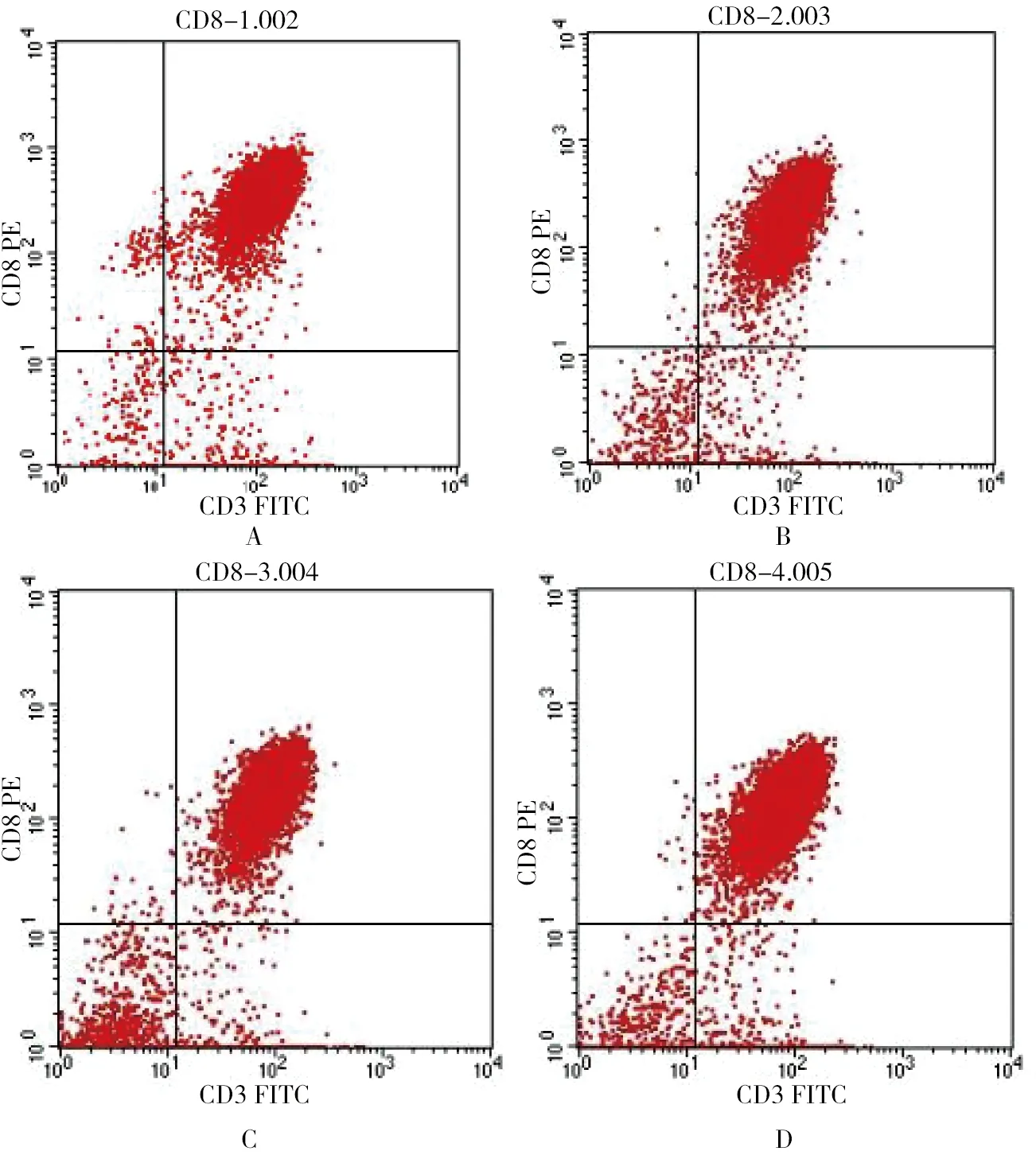
图1 流式细胞仪检测各免疫组小鼠CD8+T淋巴细胞的纯化
A:HSP70-AFP组纯化的CD8+T 淋巴细胞; B: HSP70组纯化的CD8+T 淋巴细胞; C: AFP组纯化的CD8+T 淋巴细胞; D:空白组纯化的CD8+T 淋巴细胞
2.3 小鼠CD8+T淋巴细胞培养上清IFN-γ、TNF-α、穿孔素及颗粒酶B水平
HSP70-AFP多肽疫苗组小鼠CD8+T淋巴细胞培养上清中IFN-γ、TNF-α、穿孔素、颗粒酶B水平较其他组明显升高, 具体结果见表2。
2.4 CD8+T淋巴细胞对靶细胞(H22)的杀伤作用
HSP70-AFP多肽疫苗组小鼠CD8+T细胞对小鼠H22肝癌细胞杀伤效应均高于其他各组(P<0.01), 见图2。
表2 CD8+T淋巴细胞培养上清TNF-α、穿孔素、IFN-γ、颗粒酶B

GroupsHSP70-AFPHSP70AFPEmptyTNF-α470.35±14.25a,b178.35±8.15c177.56±7.98c164.31±9.46穿孔素235.47±17.38a,b121.62±7.53c124.25±6.27c115.65±9.75IFN-γ436.37±11.24a,b179.57±7.69c186.48±8.62c168.42±10.52颗粒酶B105.34±12.26a,b60.57±7.69c62.48±8.62c56.42±10.52

图2 各免疫组小鼠CD8+T淋巴细胞对小鼠H22肝癌细胞的毒性作用
Fig 2 Cytotoxicity effect of various mice splenic lymphocyte cells against mice hepatocellular carcinoma cell H22
效应细胞∶靶细胞分别为10∶1、20∶1、40∶1
3 讨论
肿瘤免疫治疗具有高效性及毒副作用小等特点,并能启动或重启独立肿瘤免疫反应,同时自身组织细胞不受损伤。AFP作为肝癌的相关性抗原能促进肝癌细胞增殖,因此成为肝癌免疫治疗的新靶点。因AFP在胚胎期生成,机体对其产生了一定的免疫耐受,无法启动强免疫应答[12]。因此,本课题组前期热休克蛋白(HSP)作为佐剂,应用戊二醛交联法构建的HSP72-AFP复合物蛋白免疫小鼠,已证实不仅可增强AFP免疫原性,且针对AFP表达的肿瘤产生了较好的免疫效应[13]。
此次用氨基酸偶联法构建HSP70-AFP多肽重组疫苗免疫小鼠, 证实了此法重组疫苗的免疫效果更好。与戊二醛偶联法相比较,氨基酸偶联法减少了因戊二醛偶联对蛋白分子抗原表位的遮盖和破坏,利于保持蛋白多肽的功能结构,最大程度地保持表位肽的活性[14],直接将抗原表位肽偶联于HSP70,可促进抗原的提呈,从而活化效应细胞发挥杀瘤效应[15],研究结果也证实了氨基酸偶联法构建的HSP70-AFP表位肽疫苗相较戊二醛偶联法,诱导了较强的免疫攻击效应,并活化CD8+T细胞而释放了较高水平的细胞因子,体外淋巴细胞毒实验进一步证实重组蛋白疫苗对小鼠肝癌细胞杀伤率达60%。Lan等[16]将AFP与HSP70在基因水平重组构建真核表达载体,进行在体小鼠的实验证实可诱导针对AFP表达肿瘤一定的免疫效应,相较于氨基酸偶联法,基因水平构建的DNA疫苗表达量较少,产生的免疫效应相对有限,结合基因疫苗的安全性,产物的稳定性以及复杂的载体操作技术限制了基因疫苗的进一步实验研究。在本研究中应用了简便的氨基酸偶联法构建了蛋白多肽疫苗,此方法简单,合成量多,产物稳定,直接将HSP70和AFP抗原表位肽偶联利于抗原的提呈和活化效应细胞,体内外细胞毒性实验研究进一步证实了氨基酸偶联法重构HSP70-AFP表位肽疫苗能更有效地诱导特异性的CTL效应攻击肝癌细胞。
此外,体内肿瘤负荷实验进一步证实重组疫苗组小鼠荷瘤发生率低,生存时间较其他组显著延长,瘤块体积偏小。通过对CD8+T淋巴细胞培养上清中TNF-α及穿孔素等细胞因子水平的检测,发现重组疫苗组各指标均明显升高,研究报道经DC活化的AFP特异性T淋巴细胞能上调多种细胞因子含量,如:IL-2、IFN-γ、TNF-α、颗粒酶和穿孔素等,而具有显著的体内外抗肿瘤免疫活性[17],与本研究相佐证。本研究结果提示HSP70能有效地增强AFP的免疫原性,且经多肽疫苗连续免疫小鼠后,其体内产生了针对AFP抗原的有效杀伤瘤细胞的保护性细胞免疫反应,,延长了荷瘤小鼠的生存时间,为肿瘤疫苗的前期临床研究提供了重要的理论依据。
[1]SONG P, FENG X, INAGAKI Y, et al. Clinical utility of simultaneous measurement of alpha-fetoprotein and des-γ-carboxy prothrombin for diagnosis of patients with hepatocellular carcinoma in China: a multi-center case-controlled study of 1,153 subjects[J].Biosci Trends, 2014, 8(5):266-273.
[2]BUTTERFIELD L H, RIBAS A, POTTER D M, et al. Spontaneous and vaccine induced AFP-specific T cell phenotypes in subjects with AFP-positive hepatocellular cancer[J].Cancer Immunol Immunother, 2007, 56(12):1931-1943.
[3]EVDOKIMOVA V N, BUTTERFIELD L H. Alpha-fetoprotein and other tumour-associated antigens for immunotherapy of hepatocellular cancer[J].Expert Opin Biol Ther, 2008, 8(3):325-336.
[4]Cao D Y, Yang J Y, Dou K F, et al. Alpha-fetoprotein and interleukin-18 gene-modified dendritic cells effectively stimulate specific type-1 CD4- and CD8-mediated T-cell response from hepatocellular carcinoma patients in vitro[J]. Hum Immunol, 2007, 68(5):334-341.
[5]LAN Y H, LI Y G, LIANG Z W, et al. A DNA vaccine against chimeric AFP enhanced by HSP70 suppresses growth of hepatocellular carcinoma[J].Cancer Immunol Immunother, 2007, 56(7):1009-1016.
[6]RODR GUEZ M M, RYU S M, QIAN C, et al. Immunotherapy of murine hepatocellular carcinoma by alpha-fetoprotein DNA vaccination combined with adenovirus-mediated chemokine and cytokine expression[J].Hum Gene Ther, 2008, 19(7):753-759.
[7]BRAUNS T, LEBLANC P, GELFAND J A, et al. Could mycobacterialHsp70-containing fusion protein lead the way to an affordable therapeutic cancer vaccine? [J]. Expert Rev Vaccines, 2015, 14(3):435-446.
[8]HU H, QIU Y, GUO M, et al. Targeted Hsp70 expression combined with CIK-activated immune reconstruction synergistically exerts antitumor efficacy in patient-derived hepatocellular carcinoma xenograft mouse models[J]. Oncotarget, 2015, 6(2):1079-1089.
[9]MENG F D, SUI C G, TIAN X,et al. Heat shock protein 70 as a tumor antigen for in vitro dendritic cell pulsing in renal cell carcinoma cases[J].Asian Pac J Cancer Prev, 2014, 15(20):8947-8950.
[10]刘悦明,祝 军,郑司鹏,等.新疆地区健康成人外周血NK细胞体外扩增技术的研究[J]. 新疆医科大学学报,2013,35(6):763-767.
[11]朱利国,范 俊,浦洪波,等.基于磁性微球AFP时间分辨荧光免疫分析法的建立[J].标记免疫分析与临床,2016,23(1):83-86.
[12]赵 倩,王小平,胥 冰,等.甲胎蛋白与肝癌免疫的研究进展[J].生物学杂志,2016,33(2):95-99.
[13]胥 冰,王小平,马晓军,等.热休克蛋白 72-甲胎蛋白抗原表位肽复合物抗小鼠肝癌Hepal-6细胞免疫的实验研究[J].现代肿瘤医学,2014,22(11):2528-2531.
[14]刘 丽,汪巨峰,李 波.新型佐剂CPG ODN的研究进展[J].中国新药杂志,2014,23(2):161-170.
[15]赵 德,乔 翠,张 强,等.表位疫苗研究进展[J].动物医学进展,2012,33(1):102-106. [16]LAN Y H, LI Y G, LIANG Z W, et al. A DNA vaccine against chimeric AFP enhanced by HSP70 suppresses growth of hepatocellular carcinoma[J]. Cancer Immunol Immunother,2007,56(7):1009-1016.
[17]刘 扬,王跃如,王 龙,等.甲胎蛋白特异性肝癌疫苗体内杀伤肝癌细胞[J].中华实验外科杂志,2014,31(1):77-80.
Study of anti-tumor immunity elicited by peptides complex- heat shock protein 70 and alpha-fetoprotein epitope peptide
XU Bing1, WANG Qiao-xia2, WANG Xiao-ping1, LIN Huan-ping1,MA Xiao-jun1, ZHANG Peng-fei1, ZHAO Qian1, ZHANG Ke-pei1
(1. Immunology and the Science of Inspection Teaching and Research Section, Shaanxi University of Chinese Medicine,Xianyang 712046; 2. Department of Infectious Disease, Xi′an Central Hospital, Xi′an 710003, China)
To study anti-tumor immunity mechanism induced by a reconstructed peptide complex-heat shock protein 70 (HSP70) and alpha-fetoprotein (AFP), mice were immunized with recombinant peptide vaccine HSP70-AFP-P, whereas AFP peptide or HSP70 vaccination as controls. IFN-γ, TNF-α and granzyme-B, perforin-produced by separated CD8+T cells from vaccinated mice were detected with ELISA, respectively. In vivo tumor loaded test was exerted to evaluate the immune effect of the peptide vaccine. The study suggested that sequential immunization with HSP70-AFP peptide vaccine could bring about effective AFP-specific CD8+T cell responses and elicit specific antitumor immunity on AFP-producing tumors.
alpha-fetoprotein(AFP); heat shock protein 70 (HSP70); peptide vaccine; tumor immunity
2016-04-14;
2016-05-25
国家自然科学基金(No.81172135);陕西省自然科学基础研究项目(No.2016JM8023,2016JM8150);陕西省教育厅自然科学基础研究项目( No.07JK233,14JS025)
胥冰,硕士,副教授,主要从事分子免疫学研究工作,E-mail:xubing-95@163.com
王巧侠,硕士,副主任医师,主要从事消化系统疾病临床与基础研究,E-mail: 894449620@qq.com; 王小平,博士,教授,硕士生导师, 主要从事肿瘤分子免疫病理学研究,E-mail:120145557@qq.com
R730.51
A
2095-1736(2017)02-0046-04
doi∶10.3969/j.issn.2095-1736.2017.02.046

