硫酸介质中Pt电极上3-乙氧基-4-羟基苯乙醇酸的电氧化
刘万民,许 律,秦牡兰,邓继勇,肖 鑫
(湖南工程学院 化学化工学院, 湘潭 411104)
硫酸介质中Pt电极上3-乙氧基-4-羟基苯乙醇酸的电氧化
刘万民,许 律,秦牡兰,邓继勇,肖 鑫
(湖南工程学院 化学化工学院, 湘潭 411104)
采用循环伏安曲线法和极化曲线法研究了硫酸介质中的3-乙氧基-4-羟基苯乙醇酸(EHMA)在Pt电极上的电化学氧化过程.循环伏安曲线表明,EHMA的电化学氧化是完全不可逆的,在1.35 V(vs.SCE)处出现氧化电流峰;结合线性拟合方法表明,氧化峰电流与EHMA浓度在0.01~0.5 mol/L范围内、与硫酸浓度在0~0.25 mol/L范围内、与扫描速度平方根在0.05~2 V/s范围内呈良好的线性关系;硫酸介质中的EHMA在铂电极上的电氧化过程是由扩散步骤控制的.极化曲线表明,EHMA的电化学氧化反应为表观一级反应;在电极电势为1.2 V和1.3 V时,表观活化能分别为61.799 kJ/mol和52.780 kJ/mol;在温度35~50 ℃范围内,交换电流密度为1.20~2.04 ×10-6A/cm2.
3-乙氧基-4-羟基苯乙醇酸;电氧化;循环伏安;极化曲线
乙基香兰素(化学名3-乙氧基-4-羟基苯甲醛)无天然存在,是当今世界上最重要的合成香料之一.乙基香兰素具有与甲基香兰素(化学名3-甲氧基-4-羟基苯甲醛)同样的定香和留香功能,香气强于甲基香兰素3倍以上,故在食品、饮料、酒类等行业应用时,添加量少,可降低成本[1-4].目前,市场上的乙基香兰素大部分采用邻乙氧基苯酚-乙醛酸法生产,该法生产乙基香兰素均需经过缩合、氧化和脱羧三个步骤[5-6].首先,在碱性条件下,邻乙氧基苯酚与乙醛酸进行缩合反应生成3-乙氧基-4-羟基苯乙醇酸(简称EHMA);然后,在高温条件下,以硫酸铜或氧化铜作为氧化剂,将碱性介质中的EHMA氧化成3-乙氧基-4-羟基苯乙酮酸;最后,3-乙氧基-4-羟基苯乙酮酸在酸性介质中发生脱羧反应,得到乙基香兰素.该法中的氧化步骤采用的是化学氧化法,作为氧化剂的硫酸铜或氧化铜在反应完成后必须除去,这一后处理过程既增加了工序,又影响了产品的质量.如果在氧化步骤采用电化学氧化法来氧化EHMA,则无须另加化学试剂作氧化剂,而是以最清洁的电子作氧化剂.相对于化学氧化法而言,电化学氧化法还具有工艺流程短、操作简单、产品纯度高、环境污染少等优点[7].
迄今为止,关于电化学氧化EHMA制备乙基香兰素的报道较少[8-9].本文作者曾采用自制的聚邻甲苯胺-Cu2+膜电极作为阳极,间接电化学氧化碱性介质中的EHMA制备乙基香兰素[10].此法相对于化学氧化法具有上述优势,但氧化步骤完成后,仍需通过脱羧反应以获得乙基香兰素.鉴于此,又成功开发了Pt电极直接电化学氧化硫酸介质中EHMA合成乙基香兰素的工艺,将氧化步骤与脱羧步骤合二为一,进一步缩短了工艺流程,并获得了良好的效果[11].本文则在此基础上进一步研究了Pt电极直接电化学氧化硫酸介质中的EHMA这一电极过程,且获得了反应级数、交换电流密度和表观活化能等动力学参数.
1 实验部分
1.1 仪器与试剂
CHI660B型电化学工作站(上海辰华仪器公司),HH-2型数显恒温水浴锅(上海梅香仪器有限公司),Brucker ARX-300(300 MHz) (Bruker Corporation, Germany),分析纯;EHMA,根据参考文献[12]自制;溶液均用二次去离子水配制.
1.2 实验方法
在H型玻璃电解池中,以4 mm × 5 mm(长×宽)的铂片(非工作面用环氧树脂封闭) 为研究电极,30 mm × 40 mm(长×宽)的铂片为辅助电极,饱和甘汞电极(SCE)为参比电极,溶有EHMA的硫酸溶液为电解液,采用CHI660B型电化学工作站测试电解液中的极化曲线(扫描速度为1 mV/s)和循环伏安(CV)曲线.文中所述电位值均相对于SCE.
1.3 样品的收集与分析
根据参考文献[11]电解制备乙基香兰素样品.电解液用苯反复萃取,至苯无色为止.合并多次萃取液,往其中投入无水硫酸钠,静置24 h后过滤.滤液于80 ℃下蒸馏去苯,得咖啡色固体,即粗品乙基香兰素.粗品用甲苯进行重结晶,得微黄色晶体,再将其投入倍量的酒精和水中进行净化,加热至60 ℃,搅拌溶解,冷冻至10 ℃,析出纯白色乙基香兰素结晶.采用核磁共振波谱仪表征乙基香兰素.
2 实验结果与讨论
2.1 底液及研究液的CV曲线
35 ℃下,将Pt电极分别置于0.25 mol/L硫酸溶液(底液)及0.5 mol/L EHMA+0.25 mol/L硫酸溶液(研究液)中,以100 mV/s扫描速度测试CV曲线,如图1所示.
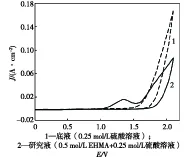
图1 底液及研究液的CV曲线
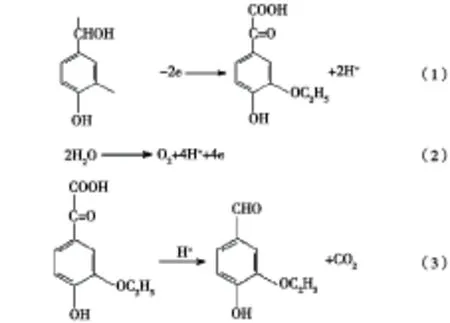
由图1可知,在0.25 mol/L硫酸溶液中,沿阳极方向扫描至1.35 V附近时有氧化电流产生,电位增大至1.5 V后,氧化电流迅速增大,铂电极表面有大量气泡析出.在0.5 mol/L EHMA+0.25 mol/L硫酸溶液中,沿阳极方向扫描至0.7 V附近时有氧化电流产生,电位增大至1.1 V后氧化电流明显增大,在1.35 V处出现一个氧化峰,随后氧化电流逐渐衰减;电位增大至1.55 V后,氧化电流重新开始升高,电位继续增大时,Pt电极上有气泡析出;反向扫描时无还原峰.通过对底液及研究液中的CV曲线分析可知,硫酸介质中的EHMA在Pt电极上于0.7 V附近开始氧化,随着电位的增大,氧化电流迅速增加,直至电极表面的EHMA浓度趋近零,在1.35 V处氧化电流达到最大值;而当电位增大至1.55 V 后,氧气的析出反应占据了主要地位.反向扫描过程中没有出现还原峰,表明EHMA的电化学氧化呈不可逆的特征.通过产物分析发现,1.35 V处的氧化电流峰即是EHMA的氧化电流峰.在H+的催化作用下,EHMA的氧化产物3-乙氧基-4-羟基苯乙酮酸进一步脱羧,生成乙基香兰素.EHMA的氧化反应、氧气的析出反应和脱羧反应如下:
2.2 不同硫酸浓度的CV曲线
在控制其他条件不变(温度为35 ℃,EHMA浓度为0.5 mol/L,扫描速度为100 mV/s)的情况下,测定了不同硫酸浓度中的CV曲线,如图2(a)所示.由图2(a)可知,当硫酸浓度为0时,几乎没有氧化电流产生;硫酸浓度由0增大至0.25 mol/L时,氧化电流增加幅度很大,峰电流(Jp)与硫酸浓度(c)之间成较好的线性关系,线性拟合方程为:Jp=0.00209+0.06157c,R=0.98123,如图2(b)所示;而当硫酸浓度继续成倍增大时,氧化电流却增加很小.这是因为硫酸在该电化学体系中主要有三方面的作用:作为支持电解质增强溶液的电导率、参与电极反应以及促进脱羧反应的发生.溶液中没有硫酸时,电导率很小,Pt电极上几乎没有EHMA的电氧化反应发生;硫酸浓度较小时,溶液电导率和EHMA的电氧化速度均较小,表现出氧化电流也较小;硫酸浓度较大时,虽然溶液的电导率和脱羧反应的速度均得到了提高,但由反应式(1)可知,H+浓度的增加会减缓EHMA电氧化反应的发生,致使氧化电流增加较小.因此,有一个维系三者平衡的硫酸浓度,为0.25 mol/L.
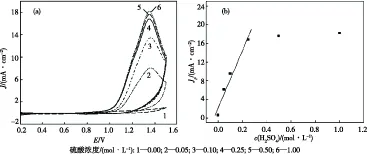
图2 不同硫酸浓度的CV曲线(a)及Jp与c(H2SO4)的关系曲线(b)
2.3 不同EHMA浓度的CV曲线
在控制其他条件不变(温度为35 ℃,硫酸浓度为0.25 mol/L,扫描速度为100 mV/s)的情况下,测定了不同EHMA浓度中的CV曲线,如图3(a)所示.由图3(a)可知,CV曲线上均只有氧化峰而无还原峰,氧化峰电流随着EHMA浓度的增大而增大.在0.01~0.5 mol/L浓度范围内,氧化峰电流与EHMA浓度呈良好的线性关系,线性拟合方程为:Jp=-0.00046+0.03341c,R=0.99889;而当EHMA的浓度继续增大时,氧化峰电流增加较少,如图3(b)所示.这可能是由于EHMA分子的基团较多,体积较大,溶液中EHMA的浓度较大时,分子热运动变得困难,参与放电的EHMA分子增加不多,造成峰电流增大不多.
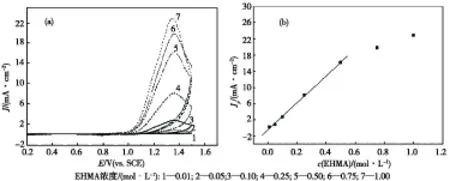
图3 不同EHMA浓度的CV曲线(a)及Jp与c(EHMA)的关系曲线(b)
2.4 不同扫描速度的CV曲线
图4(a)为35℃下,Pt电极在0.5 mol/L EHMA+0.25 mol/L硫酸溶液中,不同扫描速度下的CV曲线.由图可知,氧化峰电流随扫描速度的增大而增大,峰电位随扫描速度的增大略有正移.将氧化峰电流对扫描速度的平方根(v1/2)作图,如图4(b)所示,Jp与v1/2呈良好的线性关系,线性拟合方程为:Jp=0.00335+0.05495v1/2,R=0.99982.结果表明EHMA在Pt电极上的伏安行为是一受扩散控制的电极过程,这与我们之前的研究结果相一致[11].
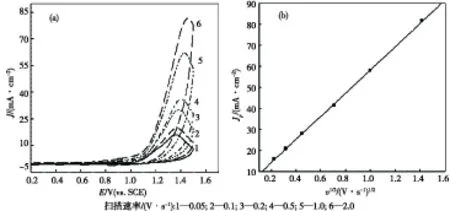
图4 不同扫描速率的CV曲线(a)及Jp 与v1/2的关系曲线(b)
2.5 不同EHMA浓度的阳极极化曲线
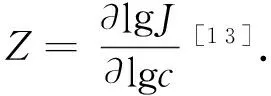
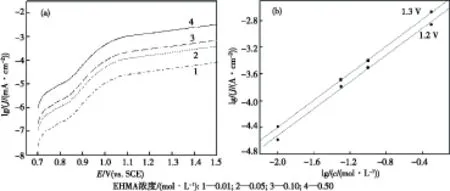
图5 不同EHMA浓度的阳极极化曲线(a)及lgJ与lgc的关系曲线(b)
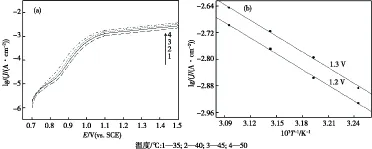
图6 不同温度的阳极极化曲线(a)及lgJ与1/T的关系曲线(b)
2.6 不同温度的阳极极化曲线
图6(a)为Pt电极在0.5 mol/L EHMA+0.25 mol/L硫酸溶液中,不同温度下的阳极极化曲线.根据Arrhenius公式lgJ=A-Ea/(2.303RT)[14],在相同电极电势(E分别取1.2 V和1.3 V)下,以lgJ对1/T作图,见图6(b),求得表观活化能分别为61.799 kJ/mol和52.780 kJ/mol.可见,对于阳极氧化反应,随着电极电势升高,活化能降低.
2.7 不同温度的稳态极化曲线
图7为Pt电极在0.5 mol/L EHMA+0.25 mol/L硫酸溶液中,不同温度下的稳态极化曲线.由图7可知,该体系的静止电位为0.685 V.在高过电位条件下,阴极反应可以忽略,阳极过电位与电流密度之间满足塔菲尔(Tafel)关系.Tafel区线性部分切线5与虚线6的交点即是交换电流密度的对数值lgJ0[15],由此可计算出35 ℃、40 ℃、45 ℃、50 ℃下的交换电流密度分别为1.20×10-6A/cm2、1.38×10-6A/cm2、1.62×10-6A/cm2、2.04×10-6A/cm2.
2.8 样品的表征
对1.35 V处的氧化产物样品做核磁共振氢谱分析,如图8所示.样品的氢谱特征峰可分别归属为:1H NMR (300 MHz, CDCl3),δ:9.81 (s, 1H),7.50-7.31 (m, 2H),7.04 (d, J = 8.3 Hz, 1H),6.51-6.23 (m, 1H),4.19 (q, J = 7.0 Hz, 2H),1.47(t, J=7.0 Hz, 3H).结合参考文献[11]可以确定产物为乙基香兰素.
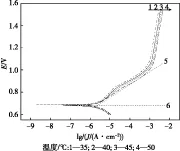
图7 不同温度的稳态极化曲线
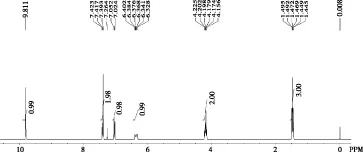
图8 乙基香兰素样品的核磁共振氢谱图
3 结论
(1)通过测定Pt电极在EHMA+硫酸介质中的CV曲线,发现EHMA的电化学氧化反应是完全不可逆的,在1.35 V处出现氧化电流峰;结合线性拟合方法发现,氧化峰电流与EHMA浓度在0.01~0.5 mol/L范围内呈较好的线性关系,氧化峰电流与硫酸浓度在0~0.25 mol/L范围内呈较好的线性关系;氧化峰电流与扫描速度平方根在0.05~2 V/s范围内呈良好的线性关系,EHMA在铂电极上的伏安行为是一受扩散控制的电极过程.
(2)通过测定Pt电极在EHMA+硫酸介质中的的极化曲线,发现EHMA的电化学氧化反应为表观一级反应;在电极电位为1.2 V和1.3 V时,其表观活化能分别为61.799 kJ/mol和52.780 kJ/mol;在温度35~50 ℃范围内,其交换电流密度为1.20~2.04 ×10-6A/cm2.
(3)通过对1.35 V处的氧化产物进行核磁共振氢谱分析和红外光谱分析表明,该产物为乙基香兰素.
[1] Egawa T, Kameyama A, Takeuchi H. Structural Determination of Vanillin,Isovanillin and Ethylvanillin by Means of Gas Electron Diffraction and Theoretical Calculations[J]. Journal of Molecular Structure, 2006, 794(1/2/3): 92-102.
[2] Knez Z, Skerget M, Uzunalic A P. Phase Equilibria of Vanillins in Compressed Gases[J]. Journal of Supercritical Fluids, 2007, 43(2): 237-248.
[3] Ohashi M, Omae H, Hashida M,et al. Determination of Vanillin and Related Flavor Compounds in Cocoa Drink by Capillary Electrophoresis[J]. Journal of Chromatography A, 2007, 1138(1/2): 262-267.
[4] Meropi T P, Antony C C. Chemiluminometric Determination of Vanillin in Commercial Vanillin Products[J]. Talanta, 2007, 71(1): 208-212.
[5] Soucek J, Hora A, Kluger A,et al. Improved Catalysts for Oxidation of Phenylglycolic Acids to Benzaldehydes: CS, 265937 [P]. 1990-04-13.
[6] Stange H, Matschiner H, Mendow E,et al. Preparation of Aromatic Hydyoxyaldehydes by Copper Catalyzed Oxidation of Arylglycolic Acids: DD, 301512[P]. 1993-02-18.
[7] 马淳安. 有机电化学合成导论[M]. 北京: 科学出版社, 2002: 5-6.
[8] 蒲兰芳. 有机电解合成乙基香兰素[J]. 河南化工, 1997(8): 15.
[9] 其乐木格, 丁绍民, 宋华付. 用邻乙氧基苯酚电化学合成乙基香兰素的研究[J]. 化学研究与应用, 2001, 13(3): 340-342.
[10]刘万民, 陈范才, 惠海军, 等. 3-乙氧基-4-羟基苯乙醇酸在聚邻甲苯胺-Cu2+膜电极上的电氧化[J]. 化学研究, 2008, 19(3): 74-78.
[11]刘万民, 胡国荣, 肖 鑫, 等. 直接电氧化合成乙基香兰素[J]. 中南大学学报, 2012, 43(3): 842-847.
[12]刘万民, 陈范才, 叶一鸣, 等. 3-乙氧基-4-羟基苯乙醇酸的合成工艺研究[J]. 香料香精化妆品, 2005 (3): 17-19.
[13]查全性.电极过程动力学导论[M]. 北京: 科学出版社, 2002: 200-201.
[14]周仲柏, 陈永言.电极过程动力学基础教程[M]. 武汉: 武汉大学出版社, 1989: 85-86.
[15]李 荻.电化学原理[M]. 北京: 北京航空航天大学出版社, 2008: 217-218.
Electrooxidation of 3-Ethoxy-4-Hydroxy Mandelic Acid in Sulfuric Acid Solution at Platinum Electrode
LIU Wan-min,XU Lv, QIN Mu-lan, DENG Ji-yong, XIAO Xin
(School of Chemistry and Chemical Engineering, Hunan Institute of Engineering, Xiangtan 411104, China)
The electrooxidation process of 3-ethoxy-4-hydroxy mandelic acid (EHMA) at a Pt electrode is investigated by means of cyclic voltammograms and polarization curves. By determination of the cyclic voltammograms, it is found that the electrooxidation of EHMA is completely irreversible, controlled by the diffusion step, and its oxidation current peak appears at 1.35 V (vs.SCE). The results of linear fitting show that the plots of oxidation peak currents versus the EHMA concentrations in the range of 0.01~0.5 mol/L, the H2SO4concentrations in the range of 0~0.25 mol/L and the square roots of the scanning rates in the potential range of 0.05~2 V/s are almost linear. By determination of the polarization curves, it is indicated that the electrooxidation of 3-ethoxy-4-hydroxy mandelic acid is a first order reaction; the apparent activation energies are 61.799 and 52.780kJ/mol at the potentials of 1.2 V and 1.3 V, and the exchange current density is 1.20~2.04 ×10-6A/cm2in the temperature range of 35 ℃~50 ℃.
3-ethoxy-4-hydroxy mandelic acid; electrooxidation; cyclic voltammogram; polarization curve
2016-10-13
湖南省教育厅科研资助项目(15B054);湖南工程学院博士科研启动项目(09001003|14004).
刘万民(1979-),男,博士后,副教授,研究方向:电化学催化与电化学储能材料.
O646
A
1671-119X(2017)01-0054-06

