补肾化瘀方对PCOS大鼠子宫内膜整合素αvβ3及LIF表达的影响
罗 佩,侯丽莹,邓丽玲,赵 娜,全春梅,杨正望,余曦明*(.湖南中医药大学,湖南 长沙 4008;.湖南中医药大学第一附属医院妇产科,湖南 长沙 40007)
补肾化瘀方对PCOS大鼠子宫内膜整合素αvβ3及LIF表达的影响
罗 佩1,侯丽莹1,邓丽玲1,赵 娜1,全春梅1,杨正望2,余曦明1*
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院妇产科,湖南 长沙 410007)
目的 观察补肾化瘀方对多囊卵巢综合征(PCOS)大鼠子宫内膜整合素αvβ3及白血病抑制因子(LIF)的影响。方法 100只SD大鼠随机分为25只为空白对照组,75只为模型制备组,予颈背部皮下注射脱氢表雄酮(dehydroepiandrostexone,DHEA)溶液建立PCOS大鼠模型,判定造模成功后随机分为模型对照组、达英-35组、补肾化瘀方组,分别用蒸馏水、达英-35及补肾化瘀方对大鼠灌胃给药,连续灌胃21 d,停药7 d为1周期,3个周期后停药,按雌雄鼠1∶1合笼,并于妊娠第4天处死大鼠,采用免疫组化法检测PCOS大鼠子宫内膜整合素αvβ3及LIF的表达。结果 (1)与空白对照组比较,模型对照组、达英-35组、补肾化瘀方组整合素αvβ3表达均较低(P<0.05);与模型对照组比较,补肾化瘀方组整合素αvβ3较高(P<0.05),达英-35组整合素αvβ3较低(P>0.05)。(2)与空白对照组比较,模型对照组和达英-35组LIF较低(P<0.05);与模型对照组比较,补肾化瘀方组LIF较高(P<0.05)。结论 补肾化瘀方可提高PCOS大鼠子宫内膜整合素αvβ3及LIF的表达,这可能是其改善子宫内膜容受性的机制之一。
多囊卵巢综合征;子宫内膜容受性;整合素;白血病抑制因子;补肾化瘀
多囊卵巢综合征 (polycystic ovary syndrome, PCOS)是一种遗传异质性、发病多因性、临床表现多态性的内分泌紊乱及代谢异常性疾病,以高雄激素血症及持续性无排卵为主要病理生理特征,临床多表现为不孕、月经不调、肥胖、痤疮等。既往多囊卵巢综合征性不孕的治疗多从药物促排卵方向考虑,但据统计药物促排卵治疗后临床排卵率虽高(75%~80%),妊娠率却低于40%[1]。究其原因多与PCOS患者子宫内膜容受性下降有关。既往实验研究从肝论治,在一定程度可改善多囊卵巢综合征[2],但随着研究的深入加之前期研究基础[3],补肾化瘀方亦可有效改善PCOS患者卵巢局部微环境及子宫内环境。本实验通过观察补肾化瘀方对子宫内膜整合素αvβ3及LIF表达的影响,进一步研究该方对PCOS大鼠子宫内膜容受性的影响及其作用机制。
1 材料
1.1 动物与分组
选用21日龄SPF级SD大鼠100只,雌性,体质量(75±15)g,购自湖南斯莱克景达实验动物有限公司,合格证号SCXK(湘)2011-0003,饲养在湖南中医药大学实验动物中心SPF级动物实验室,许可证号SYXK(湘)2013-0005。环境温度20~26℃,湿度40%~60%,每天光照10 h,自由饮水,喂以颗粒饲料。
1.2 药物、试剂与仪器
补肾化瘀方处方为:紫石英15 g,补骨脂8 g,菟丝子8 g,桑寄生8 g,茺蔚子5 g,泽兰8 g,泽泻8 g,土鳖虫8 g,三七3 g,覆盆子8 g,莲子心3 g,甘草3 g,饮片由湖南中医药大学第一附属医院提供。浸泡30 min,煎煮2次药汁混合,滤过,于水浴锅内蒸发浓缩为含生药0.9 g/mL,灭菌分装,4℃冰箱冷藏备用。
达英-35(国药准字J20140114)由拜耳医药保健公司广州分公司提供。脱氢表雄酮由湖北芳通药业有限公司提供。注射用大豆油(Y12080204-3-07)由苏州捷易龙贸易有限公司提供。整合素αvβ3 及LIF试剂盒(K723318)购自北京中杉金桥生物技术有限公司。
轮转石蜡切片机(上海徕卡仪器有限公司RM2235),生物组织摊片机(金迪YD-A),电冰箱(海尔BCD-226SKA),电热恒温培养箱(上海一恒DNP-9162),微波炉(格兰仕),研究型显微镜(Motic BA410),Motic Images Plus 6.0计算机图像分析系统。
2 方法
2.1 PCOS模型制备与评价
21日龄SD大鼠苦味酸标记后按随机数字表法随机分为2组,即空白对照组25只,模型制备组75只,适应性喂养至23日龄。(1)参照李燕等[4]造模方法,模型制备组75只于每日上午10点颈背部皮下注射DHEA6 mg/(100 g·d)+0.2 mL大豆油,在溶剂用量恒定0.2 mL不变的基础上对DHEA注射液的配制进行调整。按DHEA6 mg/(100 g·d)+0.2 mL大豆油来换算,100 g体质量大鼠应配制注射液浓度为6 mg/0.2 mL,即30 mg/mL,将此作为DHEA注射液的标准浓度,注射量按0.2 mL/100 g体质量来计算。每日大鼠称质量后,配制当日DHEA溶液并予酒精灯加热溶解均匀,按不同大鼠质量抽吸不同体积的注射液即可;(2)空白对照组每日同时段颈背部皮下注射0.2 mL/100 g大豆油,连续20 d。自注射10 d开始每天下午4时进行1次阴道脱落细胞学观察,用光滑吸管取少量生理盐水,滴入大鼠阴道,吹打3~4次,吸出阴道液,涂于载玻片上直接光镜观察,判断其动情周期变化。阴道涂片显示模型制备组大鼠光镜下细胞总数少,白细胞为主,偶见有核上皮细胞提示其失去规律动情周期,空白对照组有规律动情周期。注射第20天当晚8时禁食,次日晨起各组随机抽取5只大鼠称质量,颈椎脱臼法处死大鼠,摘取双侧卵巢,以卵巢最大平面作为待检平面石蜡包埋,进行HE染色观察卵巢形态学变化,大鼠失去规律动情周期,卵巢呈多囊样改变,可判定造模成功。造模后将模型制备成功大鼠随机分为3组,尽量保证每组均衡,分别是模型对照组、达英-35组,补肾化瘀方组。不成功者剔除,保证每组20只。
2.2 给药
造模成功后,补肾化瘀方组每天按时灌服补肾化瘀方,1次/d,给药剂量参照《人和动物间按体表面积折算的等效剂量比率表》和《实验动物学》,按成人女性平均体质量60 kg体表面积换算,折合到大鼠用药剂量为0.88 g/(100 g·d),结合“1.2”所述中药汤剂浓度即1 mL/(100 g·d)。达英-35组每天灌服达英-35,临床剂量为1片/d,折合到大鼠约为0.1片/(kg·d),即1/99片,将1片达英-35溶于100 mL蒸馏水中,约为1 mL/100 g。空白对照组以与模型制备组同等量的蒸馏水灌胃,连续灌胃21 d,停药7 d为1个周期,共给药3个周期。停药5 d后按雌雄鼠1∶1的比例合笼,次日清晨检查大鼠阴道栓,发现阴道栓日记为妊娠第1天。
2.3 取材与指标测定
妊娠第4天清晨以颈椎脱臼法处死大鼠,摘取子宫及双侧卵巢,将其表面脂肪去除干净后,均以4%多聚甲醛固定,卵巢HE染色后在显微镜下行形态学观察。子宫内膜行免疫组化法检测整合素αvβ3、LIF,子宫内膜切片常规脱蜡至水,置于DTEA抗原修复液进行微波修复,3%H2O2去离子水孵育10 min,以阻断内源性过氧化物酶,PBS液冲洗,滴加一抗,稀释比均为1∶100,室温孵育1~2 h,PBS冲洗,滴加二抗,室温孵育20 min,PBS液冲洗,应用DAB溶液显色,自来水反复冲洗、复染、脱水、透明、封片。每组内每张切片随机选择5个400倍视野进行观察,采用Motic Images Plus 6.0计算机图像分析系统选取细胞质中相同的棕黄色作为判断所有照片阳性的统一标准,以切片背景的灰度值作背底校正,对每张照片进行分析,测定平均光密度值(average optical density,AOD)。
2.4 统计学分析
统计学软件SPSS 16.0处理有关数据,计量资料以均数“±s”表示。若数据符合正态性及方差齐性,则按照完全随机设计,采用单因素方差分析进行统计;若不满足正态性及方差齐性,则采用非参数检验的Kruskal-Wallis H检验,各组间两两比较用Nemenyi法。以P<0.05为差异有统计学意义。
3 结果
3.1 大鼠卵巢组织形态学
空白对照组卵巢肉眼观色泽较为红润。镜下可见不同发育阶段的卵泡,多层排列整齐的颗粒细胞,及多个黄体(图1-A);模型制备组肉眼观色泽较为苍白,镜下可见多个囊状扩张卵泡,其内卵母细胞及放射冠消失,颗粒细胞层数减少,且排列疏松(图1-B),结合“2.1”其动情周期失去规律变化,提示PCOS大鼠模型造模成功。
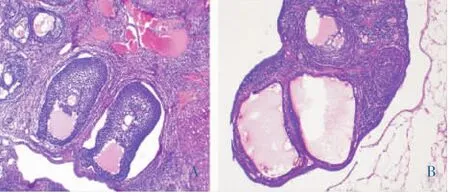
图1 各组大鼠卵巢组织形态(HE,×400)
3.2 各组大鼠子宫内膜整合素αvβ3的表达比较
整合素αvβ3主要表达于子宫内膜腺上皮细胞中(图2:A-D)。与空白对照组比较,模型对照组、达英-35组、补肾化瘀方组整合素αvβ3 AOD值均明显较低(P<0.01,P<0.05);与模型对照组比较,补肾化瘀方组整合素αvβ3 AOD值明显较高(P<0.05),达英-35组整合素αvβ3 AOD值差异无统计学意义(P>0.05)。见表1。
3.3 各组大鼠子宫内膜LIF的表达比较
LIF主要表达于子宫内膜腔上皮和腺上皮细胞中(图3:A-D)。与空白对照组比较,模型对照组、达英-35组LIF AOD值明显较低(P<0.01,P<0.05),补肾化瘀方组LIF AOD值差异无统计学意义 (P>0.05);与模型对照组比较,补肾化瘀方组LIF AOD值明显较高(P<0.01),达英-35组LIFAOD值差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠种植窗期子宫内膜整合素αvβ3及LIF的表达 (±s,AOD)
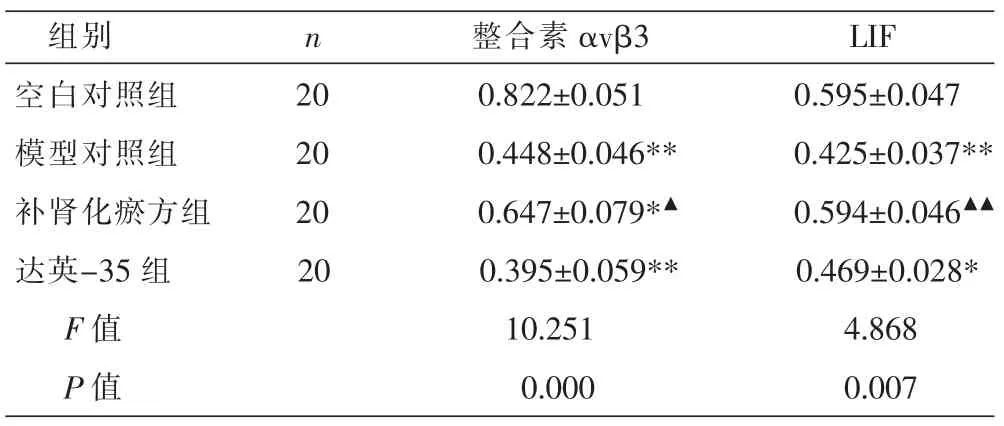
表1 各组大鼠种植窗期子宫内膜整合素αvβ3及LIF的表达 (±s,AOD)
注:与空白对照组比较,*P<0.05,**P<0.01;与模型对照组比较,▲P<0.05,▲▲P<0.01。
?
4 讨论
精子与卵子在输卵管壶腹部结合形成受精卵,4~5 d之后发育成桑葚胚或囊胚进入子宫腔并侵入子宫内膜称为胚胎着床。这是一个十分复杂的涉及到胚胎发育与子宫内膜容受状态同步化的过程。对于PCOS患者来说,完成这一过程需要克服排卵及子宫内膜容受性两大难题。研究表明多囊卵巢综合征占不排卵性不孕的50%~70%[1],以往助孕治疗以促排卵为主,但高排卵率低妊娠率[5],使研究者的目光转向如何改善PCOS患者子宫内膜容受性,以使其与胚胎发育同步化,进而提高妊娠率。子宫内膜容受性具有严格的时间及空间限制,在这一“种植窗”期内,子宫内膜通过一系列内分泌变化为受精卵的定位、粘附、侵入做好准备[6]。PCOS患者由于长期处于内分泌紊乱状态,使得子宫内膜的形态及一系列细胞因子、分泌蛋白紊乱,导致其容受性下降[7]。整合素及LIF是目前比较热门的反应子宫内膜容受性的标志物。

图2 各组大鼠子宫内膜种植窗期整合素αvβ3的表达(免疫组织化学法,×400)

图3 各组大鼠子宫内膜种植窗期LIF的表达(免疫组织化学法,×400)
整合素是细胞粘附分子家族中的一大分支,由α及β两个亚基构成,其通过Ca+介导细胞内、外环境之间的相互作用,参与细胞的增殖、分化、粘附、迁徙等过程,从而在包括精卵结合、胚胎着床等病理、生理过程中发挥重要功能[8]。大量的动物及临床试验也证实整合素αvβ3与子宫内膜容受性有密切关系,在高LH排卵峰后整合素αvβ3的表达显著增加,而在不孕女性中,如不明原因性不孕、输卵管积水、子宫内膜异位症等,其具有特异性低表达[9-10]。因此整合素αvβ3在种植窗期子宫内膜上的高表达是良好子宫内膜容受性的标志,通过监测整合素αvβ3可对临床上PCOS患者子宫内膜容受性及药物疗效进行有效的评价。本研究利用免疫组化法检测整合素αvβ3在种植窗期子宫内膜上的表达情况,结果表明整合素αvβ3主要表达于子宫内膜腺上皮细胞中,与空白对照组比较,其余各组整合素αvβ3表达明显降低,这与国内外实验研究一致,说明PCOS大鼠子宫内膜容受性下降。与模型对照组比较,补肾化瘀方组子宫内膜上整合素αvβ3的表达明显较高。因此我们认为补肾化瘀方可提高子宫内膜上整合素αvβ3的表达,这可能是其改善PCOS患者子宫内膜容受性的机制之一。
LIF是一种分泌型糖蛋白,属白介素-6家族,其受体分布十分广泛,且在不同的部位具有调节细胞增殖、分化等不同的生物活性。Vogiagis等[11]发现LIF表达量可随月经周期变化,在排卵之后LIF在子宫内膜上的表达达到高峰,参与诱导良好子宫内膜容受性的建立。有研究[12]显示子宫内膜上LIF及其受体的表达与胞饮突出现及衰退时间一致,并可定位表达于胚胎着床附近[13],LIF表达低下者其妊娠率低且胚胎着床后发育不良[14]。因此LIF可以作为判断子宫内膜容受性的细胞因子之一。本研究显示LIF主要表达于子宫内膜腔上皮和腺上皮细胞中,与空白对照组比较,模型制备组LIF表达均较低,表明PCOS大鼠LIF表达受限。与模型对照组比较,补肾化瘀方组LIF表达较高,提示补肾化瘀方改善子宫内膜内膜容受性可能与LIF表达增高有关。
中医认为肾为先天之本,元气之根,主藏精气,是人体生长、发育和生殖之根本。肾精者血之源,肾中阴精亏虚则冲任乏源,无以凝精受孕,卵子,内膜亦无生长发育之物质基础,故卵子难以发育成熟,内膜难以成易受之势。肾气,亦乃肾精所化之气,肾气亏虚,冲任不固,无以摄精受孕,气者亦是机体温煦气化的原动力,其温煦气化失司,一方面无以鼓舞肾精化生气血,另一方面如王清任《医林改错》曰:“元气既虚,必不能达于血管,血管无气,必停留而瘀”,肾气亏虚,气血运行无力,日久气血淤滞冲任胞宫,排卵乏力,内膜无以转化为分泌期,不能触发氤氲乐育之时,而致不孕。可见肾虚乃多囊卵巢综合征之根本病机,可兼有肝郁、血瘀、痰湿、痰瘀,故补肾乃其根本治则,可兼以疏肝、化瘀、祛痰、除湿。本研究采用导师多年来治疗PCOS基础方补肾化瘀方,方中补骨脂、紫石英补肾助阳,以行“善补阴者必于阳中求阴,则阴得阳升而泉源不竭”之效,此二药为君。菟丝子入肾经,润燥补虚,补而不峻,温而不燥,平调阴阳。桑寄生、覆盆子归肝肾二经,填精补血,滋补冲任。莲心清心安神,交通心肾,以对抗补骨脂、紫石英之温燥,上四味为臣药。泽兰、泽泻、三七、茺蔚子活血调经,以利肝肾之瘀滞。甘草调和诸药,纵观全方,具补肾益精,活血化瘀之功,使得阴阳平调,肾精肾气充足,冲任得养,气血调畅,卵子如期发育,内膜血运丰富,成易孕之势,进而提高妊娠率。
综上所述,补肾化瘀方对子宫内膜容受性具有积极影响,其可能机制是增强整合素αvβ3及LIF的表达。但胚胎着床过程十分复杂,子宫内膜容受性影响因素众多,目前发现的指标只能作为辅助评价指标,无法作为评价子宫内膜容受性的黄金标准,在后期研究中亟需发现可行的、有效的标志物以评价子宫内膜容受性,预测种植窗期,提高临床妊娠率。
[1]乐 杰.妇产科学[M].北京:人民卫生出版社,2008:313-316.
[2]侯丽莹,邓丽玲,罗 佩,等.丹栀逍遥散对多囊卵巢大鼠血清T、 AMH及卵巢局部AMH蛋白表达的影响.湖南中医药大学学报, 2017,37(2):141-144.
[3]余曦明.补肾化瘀方对PCOS大鼠卵巢颗粒细胞上ER和AR基因表达的影响[D].长沙:湖南中医药大学,2011:21-31.
[4]李 燕,张庆文,王红彬.脱氢表雄酮诱导SD大鼠多囊卵巢综合症模型的实验研究[J].中国医药科学,2013,4(7):35-37.
[5]Mitra S,Nayak PK,Agrawal S.Laparoscopic ovarian drilling: An alternative but not the ultimate in the management of polycystic ovary syndrome[J].J Nat Sci Biol Med,2015,6(1):40-48.
[6]谢 幸,苟文丽.妇产科学[M].北京:人民卫生出版社,2013:21-22.
[7]李 予,苏圣梅,杨冬梓.多囊卵巢综合征患者子宫内膜容受性的特点[J].生殖与避孕,2014,26(7):571-575.
[8]魏 勉,张晓梅.整合素αvβ3和骨桥蛋白在人子宫内膜容受性的建立和胚胎着床中作用机制研究进展 [J].现代妇产科进展, 2013,22(3):234-236.
[9]Seinivasan KR,Blesson CS,Fatima I,et al.Expression of αvβ3 integrin in rat endometrial epithelial cells and its functional role during implantation[J].Gen Comp Endocr,2009,160(2): 124-133.
[10]Xiao Y,Li T,Xia E,et al.Expression of integrin β3 and osteopontin in the eutopic endometrium of adenomyosis during the implantation window[J].Eur J Obstet Gynecol Reprod Biol, 2013,170(2):419-422.
[11]Vogiagis D,Marsh MM,et al.Leukemia inhibitory factor in hu man endometrium throughout the menstrual cycle[J].J Endocrinol,1996,148(1):95-102.
[12]Aghajanova L,Stavreus-Evers A,Nikas Y,et al.Coexpression of pinopodes and leukemia inhibitory factor,as well as its receptors,in human endometrium[J].Fertil Steril,2003,Suppl 1: 808-814.
[13]Hasegawa E,Ito H,Hasegawa F,et al.Expression of leukemia inhibitory factor in the endometrium in abnormal uterine cavities during the implantation window[J].Fertil Steril,2012,97: 953-958.
[14]管一春,杨雪峰,王兴玲,等.PCOS缓和子宫内膜白血病抑制因子的表达及意义[J].生殖与避孕,2011,31(6):409-414.
(本文编辑 杨 瑛)
Effects of Bushen Huayu Precription on the Expression of Endometrial Integrin αvβ3 and LIF in PCOS Rats
LUO Pei1,HOU Liying1,DENG Liling1,ZHAO Na1,QUAN Chunmei1,YANG Zhengwang2,YU Ximing1*
(1.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.Department of Gynecology and Obestrics,the First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410007,China)
Objective To explore the influence of Bushen Huayu prescription on endometrial integrin-αvβ3 and leukaemia inhibitory factor(LIF)in polycystic ovary syndrome(PCOS)rats.Methods One hundred SD rats were randomly devided into two groups of 25 rats in control group and 75 rats in model group.PCOS rat modules were to built by injecting dehydroepiandrostexone(DHEA)solution in the back of the neck subcutaneous of rats.After modules built successfully,the selected rats were randomly divided into model group,diane-35 group and Bushen Huayu prescription treatment group,given by gavage with distilled water,diane-35 and Bushen Huayu prescription separately for 21 d.Then stopped 7 d for a cycle. Drug withdraw after 3 discontinuous cycles,female rats were cohabited with male rats according to 1:1.The rats were executed after pregnancy for 4 d.The expressions of endometrial integrin-αvβ3 and LIF were detecting using immunohistomchemical method in PCOS rats.Results (1)Compared with the control group,the expressions of the integrin-αvβ3 were lower in model group,diane-35 group and Bushen huayu prescription group (P<0.05).Compared with the module group,the expressions of the integrin-αvβ3 were higher in Bushen Huayu prescription group (P<0.05)and were lower in diane-35 group (P>0.05). (2)Compared with the control group,the expressions of the LIF were lower in model group,diane-35 group (P<0.05).Compared with the module group,the expressions of the LIF were higher in Bushen Huayu prescription group(P<0.05).Conclusion Bushen Huayu prescription can increase the expressions of endometrium integrin-αvβ3 and LIF in PCOS rats,that may be one of the mechanisms of improving the receptivity of endometrium.
polycystic ovary syndrome;endometrial receptivity;integrin;leukemia inhibitory factor;tonifying kidney and removing blood stasis;Bushen Huayu prescription
R285.5
A
10.3969/j.issn.1674-070X.2017.03.006
2016-07-05
湖南省科技厅计划一般项目(2014TT2007)。
罗 佩,女,在读硕士研究生,研究方向:妇科生殖内分泌疾病。
*余曦明,女,实验师,E-mail:63175725@qq.com。
本文引用:罗 佩,侯丽莹,邓丽玲,赵 娜,全春梅,杨正望,余曦明.补肾化瘀方对PCOS大鼠子宫内膜整合素αvβ3及LIF表达的影响[J].湖南中医药大学学报,2017,37(3):254-258.

