中药菊花过氧化物酶酶学特性及炮制工艺的研究
苏 靖,刘守金*,朱晶晶,朱玉芸,(.安徽中医药大学,安徽 合肥 30000;.中国中医科学院中药研究所,北京 0070)
中药菊花过氧化物酶酶学特性及炮制工艺的研究
苏 靖1,刘守金1*,朱晶晶2,朱玉芸1,2
(1.安徽中医药大学,安徽 合肥 230000;2.中国中医科学院中药研究所,北京 10070)
目的 探讨中药菊花过氧化物酶酶学特性及炮制工艺。方法 以愈创木酚为底物,采用分光光度法测定菊花过氧化物酶的酶学特性,并比较不同加工工艺下菊花过氧化物酶学特性及总黄酮含量。结果 菊花反应时间不宜超过2 min,最适pH 7.0,最适温度36℃,100℃处理30 s后,过氧化物酶活性完全丧失。过氧化物酶催化的酶促褐变反应动力学符合米氏方程,动力学参数Km=1.58×10-2mol/L,Vmax=14.278 U/min。四种炮制工艺比较过氧化物酶的抑制效果为水蒸汽>微波干燥>80℃热风干燥>自然阴干。分光光度计法测定样品总黄酮含量,蒸制干燥>微波干燥>80℃热风干燥>自然阴干。结论 菊花过氧化物酶适应温度范围广,20~80℃,相对耐热性好。本研究可为中药菊花炮制工艺的改善提供理论参考。
菊花;过氧化物酶;酶学特性;炮制工艺;黄酮
中药菊花为菊科植物菊Chrysanthemum morifolium Ramat.的干燥头状花序[1]。菊花性能辛、甘、苦,微寒。归肺、肝经。功效,疏散风热,平抑肝阳,清肝明目,清热解毒[2]。9-11月花盛开时分批花采收后,阴
干或焙干,或熏、蒸后晒干,生用[3]。主产于浙江、安徽、河南等省。多栽培。因为菊花中的主要活性成分极易发生酶促褐变,即其所含的酚类物质在过氧化物酶、多酚氧化酶的作用下氧化成醌,再经聚合形成褐色物质,而产生颜色裂变,严重影响产品的外观和质量[4-5]。过氧化物酶酶学特性目前农作物报道多[6],香蕉[7-8]、雪莲果[9]、橄榄[10]、甘薯叶[11]、杨桃[12]等。针对菊花过氧化物酶的酶学特性鲜见报道[13]。菊花中目前知道的化合物主要是黄酮、多酚等[1],研究表明,不同干燥方法对菊花的多酚、黄酮类活性成分均有一定影响[4],菊花药材按产地和加工方法的不同,分为“亳菊”“滁菊”“贡菊”“杭菊”等,以亳菊和滁菊品质最优。我国菊花的药用类群通过人工长期栽培选育,已形成一些相对稳定的栽培变种,本实验通过对新栽培变种大马牙菊花过氧化物酶的部分酶学特性进行分析[14-15],探讨总黄酮的含量与酶的活性变化趋势关系,以期为菊花炮制工艺提供理论参考。
1 材料与方法
1.1 药材与试剂
菊花2015年11月6日-11月12日采自安徽亳州十九里镇农户地里,采集全花,经安徽普仁中药饮片有限公司质量负责人段体斌老师鉴定为大马牙菊花Dendranthema morifolium(Ramat.)Tzvel.Damay a'cv.nov,新栽培变种。在亳州安徽普仁中药饮片公司采用不同炮制方法制备,-80℃冰箱保存备用。愈创木酚:天津市光复精细化工研究所;二氧化硅:天津市永大化学试剂有限公司;过氧化氢、磷酸二氢钠、十二水合磷酸氢二钠:北京化工厂。
1.2 实验仪器
梅特勒-托利多XSE150分析天平 (瑞士苏黎世);TGL20MW台式高速冷冻离心机 (湖南赫西仪器装备有限公司);T6 UV-VIS分光光度计(北京普析通用仪器有限责任公司);电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂);EYELA水浴锅SB-1100(上海爱朗仪器有限公司);Agilent 1260高效液相色谱系统。
1.3 实验方法
1.3.1 菊花过氧化物酶粗酶液的提取 称取新鲜菊花0.5 g,加适量石英砂,5 mL pH 7.0磷酸缓冲液冰浴研磨。提取物在4℃条件下以6 000 r/min离心6 min,收集上清液作为粗酶液待测。
1.3.2 菊花过氧化物酶的活性测定 取光径1 cm比色皿2只,于1只加入50 mmol/L磷酸缓冲液(pH 7.0)50 μL,含有愈创木酚的反应混合液2.9 mL,过氧化氢60 μL,作为对照;另1只中加入酶液50 μL,含有愈创木酚的反应混合液2.9 mL和过氧化氢60 μL,立即开启秒表记录时间,于分光光度计上测量波长470 nm处吸光度值,每隔1分钟读数1次。以每分钟变化0.01为一个酶活性单位。1.3.3 反应时间对过氧化物酶的活性影响 按照“1.3.2”的测定方法,总反应体系分别反应1、2、3、4、5 min,测其吸光值。
1.3.4 pH对过氧化物酶活性的影响 配制pH值分别为5.29、5.59、5.91、6.24、6.47、6.64、6.81、6.98、7.17、7.38、7.73、8.04的磷酸缓冲液。按“1.3.2”的方法,在室温下测定不同pH值的吸光值。
1.3.5 反应温度对过氧化物酶活性的影响 按“1.3.2”方法建立反应体系,反应底物分别于20、30、40、50、60、70、80℃下预先保温10 min,再加入粗酶液50 μL,在波长470 nm处测定吸光值。
1.3.6 过氧化物酶的热稳定性研究 取等量粗酶液4份,在100℃水浴中分别热烫5、10、15、30 s,取出后迅速冷却,按“1.3.2”的方法测定不同热烫时间的吸光值。
1.3.7 底物浓度对过氧化物酶活性的影响 分别配制浓度为0.01%、0.02%、0.03%、0.04%、0.05%、0.06%的愈创木酚溶液为底物,按照“1.3.2”的测定方法,测其在最适温度、最适pH值及酶液浓度保持固定条件下的吸光值,计算酶的活性。
1.3.8 不同炮制工艺对过氧化物酶活性的影响 探讨水蒸气、80℃热风干燥、微波干燥、自然阴干四种炮制工艺,对过氧化物酶的活性抑制。按“1.3.1”“1.3.2”的方法,提取不同炮制工艺的粗酶液测定其吸光值。
1.3.9 总黄酮含量测定 取干燥菊花1 g,精密称定,加入30 mL 60%甲醇于60℃水浴中温浸1 h,直接加热回流45 min,过滤,滤液定容至50 mL。精确取出1 mL,减压浓缩至浸膏,用甲醇稀释至50 mL容量瓶中定容,摇匀后得甲醇提取液。以试剂为空白,用3 cm比色皿于510 nm处测定吸光度值,依据标准曲线方程计算出不同干燥方法所得样品中黄酮含量,分析不同炮制工艺干燥条件对黄酮的含量影响。标准曲线的建立:以芦丁标样进行总黄酮含量的测定,称取芦丁对照品制成浓度为0.148 0 mg/mL的标准溶液。按上述方法测定,分别移取标准样品0~5.0 mL,标准曲线方程为:
Y(mg/mL)=0.084 2X-0.000 68,R2=0.989 1其中X为吸光值。
1.4 数据处理
所有数据均采用Microsoft Excel进行数据分析。
2 结果与分析
2.1 菊花过氧化物酶反应进程曲线
由图1可见,在反应初期,即2 min内,随着反应的进行,OD值(产物生成量)呈直线上升,属于反应初速度。因此,本实验确定酶促反应时间以不超过2 min为宜。
2.2 pH对菊花过氧化物酶活性的影响
由图2可见,过氧化物酶在pH值为6.8时,酶活性最高,表明该酶的最适pH值为6.8,当pH值为5.3和8.0时,过氧化物酶的活性分别为最大时的30%和55%。

图1 POD反应进程曲线
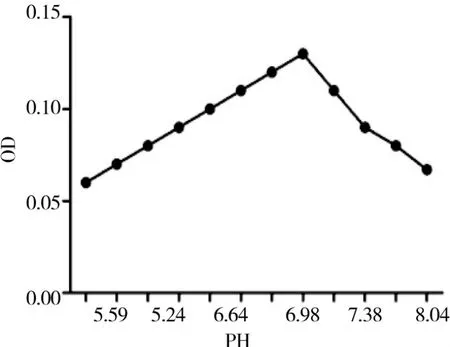
图2 pH对POD活性的影响
2.3 温度对菊花过氧化物酶活性的影响
由图3可以看出,36℃以下酶的活性逐渐升高, 36℃以上酶的活性逐渐降低。36℃吸光值达到峰值,酶的活性达到最高。当温度达到70℃时,过氧化物酶的相对活性是13.2%,当温度20℃时,过氧化物酶的相对活性是40.9%。
2.4 菊花过氧化物酶热稳定性
由图4可知,随着处理时间的增加,过氧化物酶活性迅速下降。15 s时,残存活性仅剩19.8%。30 s时,残存活性近乎为零。

图3 温度对POD活性的影响
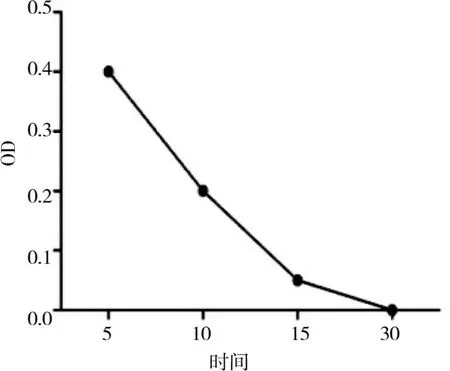
图 4 POD的热稳定性
2.5 菊花过氧化物酶酶促反应动力学
由图5可以看出,当底物浓度较低时 (0.01根据%),反应速率与底物浓度的关系呈正比关系,表现为一级反应。随着底物浓度的增加,反应速率不再按正比升高,反应表现为混合级反应。当底物浓度达到相当高时,底物浓度对反应速率影响变小,最后反应速率与底物浓度几乎无关,反应达到最大速率(Vmax),表现为零级反应。
Lineweaver-Burk双例数作图法方程式 1/V= Km/Vmax×1/[S]+1/Vmax,以1/V~1/[S]作图,得出一直线,如图6。得直线方程Y=0.004X+0.028,根据直线斜率和截距求得该反应的米氏常数Km=1.58×10-2mol/L,最大反应速率Vmax=14.278 U/min。动力学方程为V=14.278[S]/(0.015 8+[S])(U/min)拟和直线相关系数达到0.998,得到菊花的过氧化物酶的酶促反应动力学符合米氏方程。

图5 底物浓度对POD活性的影响

图6 POD酶促反应双倒数曲线
2.6 不同炮制工艺对菊花过氧化物酶的活性影响
由图7可见,水蒸气蒸30 s,酶的活性完全被抑制。反应活性与反应时间呈近直线关系,表示该炮制工艺受热均匀。

图7 水蒸汽对POD活性的影响
由图8可见80℃热风干燥,酶的活性在加工6 h后完全被抑制,反应活性与反应时间呈曲线关系,表示该酶耐热性高。
由图9可见微波干燥,酶的活性在加工12 min后完全被抑制,反应活性与反应时间不成直线关系,表明该炮制工艺受热不均匀。
由图10可见自然阴干过程,酶的活性一直存在。反应活性与反应时间成曲线关系,表明该炮制工艺酶的活性不能得到抑制。
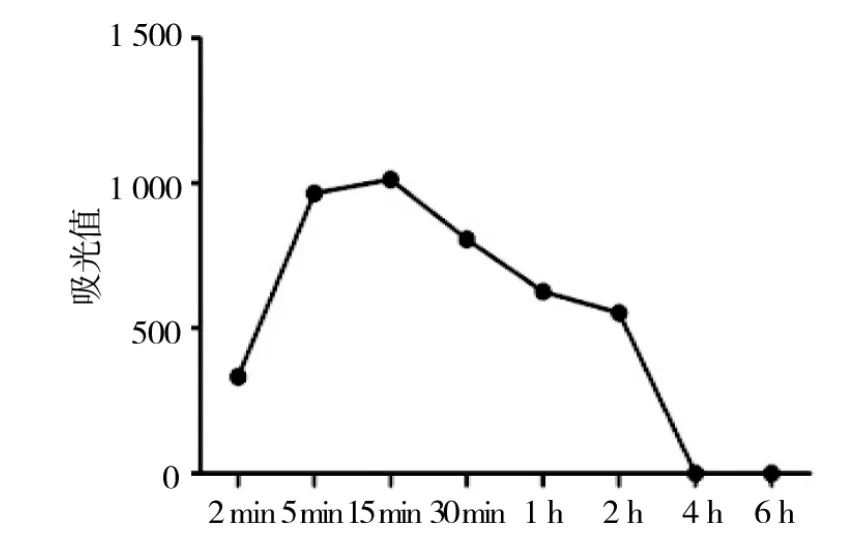
图8 80℃热风干燥对POD活性的影响
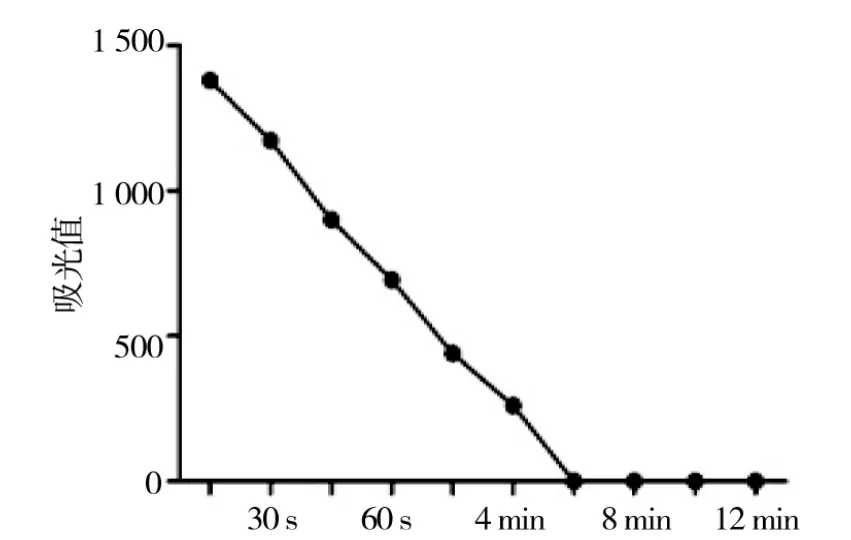
图9 微波干燥对POD活性的影响
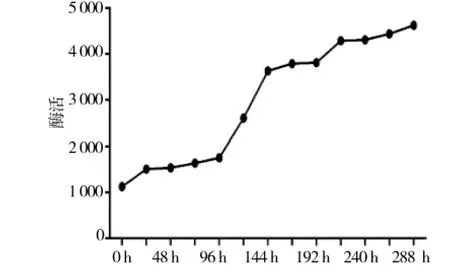
图10 阴干干燥对POD活性的影响
2.7 不同炮制工艺干燥总黄酮含量比较
由图11可见不同炮制工艺干燥总黄酮含量,蒸制干燥>微波干燥>80℃热风干燥>自然阴干。
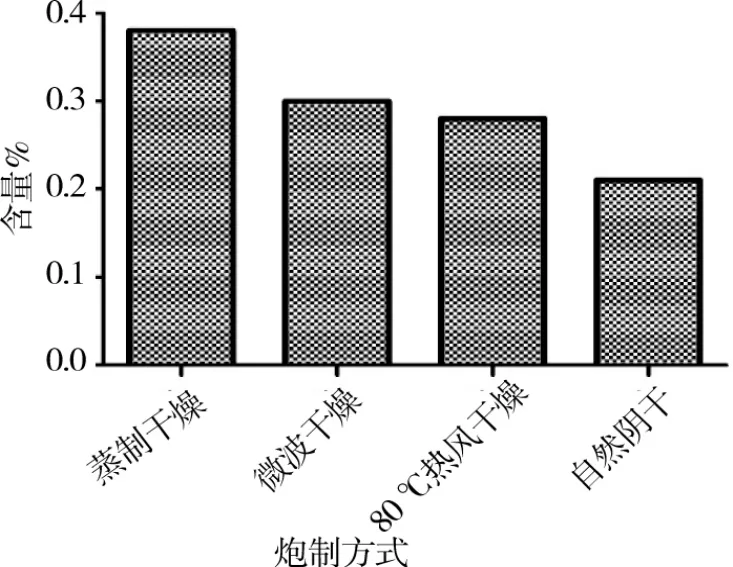
图11 不同炮制工艺对总黄酮含量的影响
3 结论与讨论
过氧化物酶是植物体内普遍存在且活性较高的一种酶,该酶催化以H2O2为氧化剂的氧化还原反应,在氧化其他物质的同时,将H2O2还原为H2O,用以清除细胞内的H2O2,是植物体内的保护酶之一,此外过氧化物酶与植物的呼吸作用、光合作用、生长素的氧化以及木质素的形成等有关,其活性随植物生长发育进程以及环境条件的改变而变化[14-15]。在H2O2存在下,它能催化酚类、从而导致组织褐变[14-17]。菊花过氧化物酶最适温度36℃,最适pH7.0,最适底物浓度0.03%。菊花过氧化酶耐热性高,80℃热风干燥6 h,酶的活性才完全抑制。对热敏感,100℃水蒸汽蒸,30 s酶活性则被钝化。对于酶促褐变,在适宜温度下,反应酶活性越强,对酶促褐变程度越高。在过氧化物酶活性测定系统中,以愈创木酚为底物的菊花过氧化物酶的Km=1.58×10-2mol/L。
通过紫外分光光度计测量显示,蒸汽干燥总黄酮含量最高,多酚氧化酶的活性趋势与黄酮含量有相关性,但仍需实验证明。黄酮类物质是菊花的主要成分之一,炮制工艺中微波干燥菊花受热不均匀[18-19],硫熏工艺在农产品及中药饮片加工中都是不推荐的[19-20],因此菊花的炮制工艺可通过闪速高温灭酶来抑制菊花酶促褐变。
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:292.
[2]高学敏.中药学.[M].北京:中国中医药出版社,2007:74-75.
[3]王德群,刘守金,梁益敏.中国菊花药用类群研究[J].安徽中医学院学报,2001,1(45):3-4.
[4]陈 平,张建博,龚建瑜,等.中药鲜品褐变机制及防控的研究进展[J].现代中医药,2016,9(36):5-6.
[5]冯 丽,宋曙辉,赵 霖,等.植物多酚种类及其生理功能的研究进展[J].江西农业学报,2007,19(10):105-107.
[6]韩 涛,李丽萍.果实和蔬菜中的过氧化物酶[J].食品与发酵工业,2000,26(1):69-73.
[7]Montgomery MW,Sgarbieri VC.Isoenzymes of banana polyphenoloxidase[J].Phytochemistry,1975,14(4):1245-1249.
[8]李 健,杨昌鹏,陈智理,等.3个香蕉品种果实过氧化物酶的特性分析[J].湖北农业科学,2011,50(15):3093-3101.
[9]周向军,高义霞,张生财.雪莲果过氧化物酶的特性和抑制研究[J].中国酿造,2011(1):109-112.
[10]谢 倩,陈清西,王 威,等.橄榄果实过氧化物酶和多酚氧化酶酶学特性研究[J].热带作物学报,2013,34(8):1519-1524.
[11]付伟丽,唐靓婷,王 松,等.甘薯叶过氧化物酶的分离纯化及其部分性质研究[J].食品科学,2010,31(7):223-227.
[12]杨昌鹏,胡艳妮,陈智理,等.杨桃多酚氧化酶的部分纯化及其特性研究[J].食品与发酵工业,2010,36(1):34-38.
[13]王婷婷,王少康,黄桂玲,等.菊花主要活性成分含量及其抗氧化活性的测定[J].食品科学,2013,32(2):23-26.
[14]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:164-165.
[15]张丽萍,杨建雄.生物化学简明教程(第4版)[M].北京:高等教育出版社,2009:159-160.
[16]Palma-Orozco G,Ortiz-Moreno A,Dorantes-Alvarez L,et al. Purification and partial biochemical characterization of Polyphenol oxidase from mamey(Pouteria sapota)[J].Phytochem, 2011,72:82.
[17]Cai F,Yang CO,Duan PP,et al.Purification and characterization of a novel thermal stable peroxidase from Jatropha curcas leaves[J].J mol catal B-enzym,2012,77:59.
[18]张晓辛,肖宏儒,曹曙明,等.利用微波—气流组合干燥技术干燥菊花的试验研究[J].农业工程学报,2000,16(4):129-131.
[19]梁迎暖,郭巧生,张重义,等.不同加工方法对怀菊品质的影响[J].中国中药杂志,2007,32(21):2314-2316.
[20]王 珊,郝丽娟,朱晶晶,等.硫磺熏蒸对杭白菊化学品质的影响[J].中国中药杂志,2014,39(8):1457-1462.
(本文编辑 杨 瑛)
Study on Characters of Peroxidase in Chinese Medicine Chrysanthemum and its Processing Technology
SU Jing1,LIU Shoujing1*,ZHU Jingjing2,ZHU Yuyun1,2
(1.Anhui University of Chinese Medicine,Hefei,Anhui 230000,China; 2.Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
Objective To observe the peroxidase(POD)character and processing technology of chrysanthemum.Methods The enzymatic characteristics of POD from chrysanthemum were investigated by spectrophotometry,with the guaiacol as substrate.The POD and total flavonoid content under different processing technology were compared.Results The reaction time for POD should not exceed 2 min,the optimum pH and temperature of POD were 7.0 and 36℃,respectively.The POD activity was completely inactivated when it was incubated at 100℃ for 30s.The reaction kinetic of enzymatic browning was accordant withkinetic parameters.The Km and Vmax were 1.58×10-2mol/L,14.278 U/min,respectively.Four processing methods show different effects on POD activity,and their inhibitory capacity was steaming drying>microwave drying> 80 ℃ hot air drying>natural shade drying.Conclusion The POD in chrysanthemum has a wide range of adapting temperature,20~80℃, and good relative thermal stability.This research can provide reference for the processing technology of chrysanthemum.
chrysanthemum;peroxidase;enzymatic characteristics;processing technology;flavonoids
R283
B
10.3969/j.issn.1674-070X.2017.03.007
2016-01-02
国家自然科学基金面上项目(81373960,81573600);国家中医药管理局行业专项(201307008-04)。
苏 靖,女,硕士研究生,研究方向:药用植物学与中药资源化学。
*刘守金,男,教授,博士研究生导师,E-mail:shjiuliu@sina.com。
本文引用:苏 靖,刘守金,朱晶晶,朱玉芸.中药菊花过氧化物酶酶学特性及炮制工艺的研究[J].湖南中医药大学学报,2017,37(3):259-263.

