人参皂苷Rg1对H2O2诱导的HT22细胞凋亡及胞内Ca2+变化的影响
刘晓丹,成绍武,范婧莹,宋祯彦,李 平,邓常清*(.湖南中医药大学 中西医结合心脑疾病防治湖南省重点实验室;.湖南中医药大学 中西医结合学院,.湖南中医药大学 医学院,湖南 长沙 408)
人参皂苷Rg1对H2O2诱导的HT22细胞凋亡及胞内Ca2+变化的影响
刘晓丹1,成绍武1,范婧莹2,宋祯彦1,李 平1,邓常清3*
(1.湖南中医药大学 中西医结合心脑疾病防治湖南省重点实验室;2.湖南中医药大学 中西医结合学院,3.湖南中医药大学 医学院,湖南 长沙 410218)
目的 研究人参皂苷Rg1对H2O2诱导的HT22细胞凋亡及胞内Ca2+浓度变化的影响。方法 以0、6.25、12.5、25、50、100μg/L人参皂苷Rg1预处理细胞24 h,采用Ca2+荧光染料探针Fluo-3/AM负载细胞1 h后,50 mmol/L H2O2刺激细胞,多功能酶标仪测定荧光强度,激光共聚焦显微镜实时监测[Ca2+]i变化,Hoechst 33258染色检测细胞凋亡。结果 H2O2可诱导细胞内Ca2+浓度增加(P<0.01),并增加细胞凋亡率(P<0.01)。不同浓度人参皂苷Rg1可呈剂量依赖性的抑制H2O2诱导的HT22[Ca2+]i增加(P<0.01),抑制细胞凋亡(P<0.01),以50μg/L的作用为最强(P<0.01)。结论 人参皂苷Rg1可通过降低H2O2诱导的HT22细胞内Ca2+水平的升高,抑制氧化应激引起的细胞凋亡。
人参皂苷Rg1;HT22细胞;细胞凋亡;Ca2+浓度
本文引用:刘晓丹,成绍武,范婧莹,宋祯彦,李 平,邓常清.人参皂苷Rg1对H2O2诱导的HT22细胞凋亡及胞内Ca2+变化的影响[J].湖南中医药大学学报,2017,37(3):236-239.
脑缺血发病率高、死亡率高、致残率高,严重威胁人类健康,且病理生理机制复杂,目前仍未完全清楚。近年来的脑缺血损伤的病理生理机制研究表明,神经细胞的胞外Ca2+内流增加可引发细胞变性,最后导致死亡;兴奋性氨基酸及多种神经毒素引起神经细胞变性死亡,总是伴随胞浆Ca2+超负荷现象,故认为细胞Ca2+信号转导异常是神经元变性的 “最后共同通道”[1]。
人参皂苷Rg1是人参、三七的主要有效成分,对心血管、中枢神经系统均有较强的保护作用,有研究发现[2-6],人参皂苷Rg1能够减轻脑缺血再灌注损伤,其机制可能与抑制神经细胞凋亡、抗氧化损伤等有关。本研究通过采取H2O2诱导的HT22细胞损伤模型,观察人参皂苷Rg1预处理对H2O2诱导的HT22细胞凋亡的影响,并通过分析细胞内[Ca2+]i的变化,探索人参皂苷Rg1抗HT22细胞凋亡的作用及与[Ca2+]i的关系,为人参皂苷Rgl在脑缺血的治疗应用上提供实验依据。
1 材料和方法
1.1 材料
1.1.1 药物与试剂 人参皂苷Rg1(批号:MUST-16022407),购自成都曼思特生物科技有限公司,纯度≥98%;H2O2(美国sigma公司),Fluo-3/AM((美国sigma公司),α-MEM培养基、胎牛血清、青链霉素溶液、PBS缓冲液、改良台式液均购自GIBCO公司。
1.1.2 细胞 HT22细胞,小鼠海马神经元细胞系,低分化,购自中南大学湘雅医学院。
1.1.3 主要仪器 激光共聚焦显微镜 (日本尼康,型号:A1+),多功能酶标仪 (德国BIOTEC,型号:CYTATION3),超净工作台(苏州,型号:8WJ-2F0),倒置显微镜(重庆,型号:XDS-1B),二氧化碳培养箱(德国贺利氏,型号:Heracel1)。
1.2 实验方法
1.2.1 HT22细胞培养 采用含10%胎牛血清,1%青链霉素溶液的α-MEM培养基,于37℃、5%CO2浓度及饱和湿度下的培养箱中培养,每天换液,待单层细胞生长至80%~90%融合后传代培养,所有实验采用对数生长期细胞。
1.2.2 人参皂苷Rg1最适浓度摸索 细胞共分为7组,正常组(α-MEM无血清培养基常规培养)、H2O2损伤组(加入50 mmol/L H2O2刺激细胞)、不同浓度人参皂苷Rg1(6.25、12.5、25、50、100 μg/L)组。细胞加入不同浓度人参皂苷Rg1处理24 h后,弃去培养基,用台式液洗涤2次,加入Fluo-3/AM工作液(荧光探针Fluo-3/AM在负载细胞时用台式液配制成终浓度为 5 μmol/L的工作液),37℃避光培养1 h,弃去荧光探针,用台式液洗涤2次,加入含终浓度为50 mmol/L H2O2的台式液继续孵育1 h。在多功能酶标仪下,选择激发波长488 nm进行扫描,读取荧光强度值。
1.2.3 激光共聚焦显微镜检测细胞内钙离子浓度 细胞分为3组,正常组(ɑ-MEM无血清培养基常规培养)、H2O2损伤组及人参皂苷Rg1组(加入上述实验摸索的人参皂苷Rg1最适浓度)培养24 h。Fluo-3/ AM负载1 h后,弃去荧光探针,用台式液洗涤2次,H2O2损伤组和人参皂苷Rg1组加入含终浓度为50 mmol/L H2O2的台式液,在激光共聚焦显微镜下观察选择贴壁良好、形态伸展、荧光强度较亮的细胞,设置扫描条件为488 nm波长激发、20%激光强度,同时采集DIC图像,每3分钟采集1张,连续扫描1 h,动态观察荧光强度变化情况。选取第1张图片,15、30 min和1 h4张图片利用Image J统计软件进行平均荧光强度分析。
1.2.4 Hoechst 33258染色检测细胞凋亡 细胞分组及处理同上,处理完成后,用PBS漂洗细胞2次,加入新鲜配置的4%多聚甲醛,4℃固定15 min;PBS洗2次后,加入终浓度为5 mg/L的Hoechst 33258室温下作用5 min。在倒置荧光显微镜下观察,随机选取5个200×镜下视野,计算凋亡细胞百分率。
1.3 统计学方法
2 结果
2.1 不同浓度人参皂苷Rg1对细胞内Ca2+浓度的影响
H2O2刺激后,荧光强度显著增高(P<0.01),提示细胞内Ca2+浓度水平显著增加。人参皂苷Rg1不同浓度组均能够显著抑制H2O2损伤后细胞荧光强度的增高(P<0.05-P<0.01),其中以50 μg/L浓度最为明显(见表1)。故在下面的实验中选择50 μg/L浓度的人参皂苷Rg1进行实验。
表1 不同浓度人参皂苷Rg1对H2O2诱导的HT22细胞内Ca2+的荧光强度值影响 (n=5,±s)

表1 不同浓度人参皂苷Rg1对H2O2诱导的HT22细胞内Ca2+的荧光强度值影响 (n=5,±s)
注:与正常组比较**P<0.05,与H2O2损伤组比较△P<0.05,△△P<0.01。
组别正常组H2O2损伤组6.25 μg/L浓度组12.5 μg/L浓度组25 μg/L浓度组50 μg/L浓度组100 μg/L浓度组F P荧光强度值7 814.6±430.62 45 496±156 5.1** 37 584±154 5.7△29 211±281 3.6△26 341±457.17△△16 015±108 8.3△△17 318±351.45△△23.268 0.019
2.2 激光共聚焦显微镜实时监测人参皂苷Rg1对H2O2诱导的HT22细胞内钙离子荧光强度动态变化
正常细胞胞浆内钙离子浓度较低,在488 nm激发光激发下发出较弱的绿色荧光,且随着时间的延长,荧光强度无变化(0、15、30 min和1 h)4个时间点荧光强度分别为 70.61、71.12、71.13、71.21);H2O2刺激后,细胞胞浆内钙离子浓度迅速增高,荧光强度显著增高,在30 min达到峰值(0、15、30 min和1 h 4个时间点荧光强度分别为 90.12、126.45、150.22、136.8)(P<0.05-P<0.01),50 μg/L浓度的人参皂苷Rg1能够有效抑制H2O2损伤后细胞荧光强度的增高 (0、15、30 min和1 h 4个时间点荧光强度分别为94、125.6、102、98.3)(P<0.05),见图1。
2.3 人参皂苷Rg1对H2O2诱导的HT22细胞凋亡的影响
Hoechst 33258染色结果显示,正常组细胞呈现弥漫均匀的低荧光强度,未见凋亡细胞。经H2O2刺激后,细胞呈现明显的凋亡特征,表现为细胞核浓缩、破裂,与正常组比较,细胞凋亡率显著升高,达(50.12±1.4)%(P<0.01),人参皂苷Rg1能够有效地抑制细胞凋亡,使凋亡细胞显著减少,细胞凋亡率为(22.04±2.8)%(P<0.01),见图2。
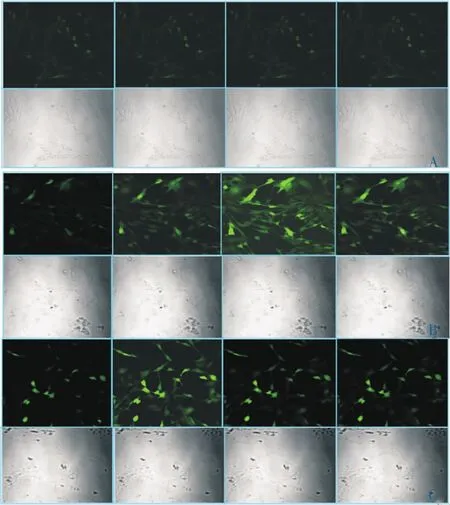
图1 激光共聚焦显微镜实时监测不同时间点人参皂苷Rg1对H2O2诱导的HT22细胞[Ca2+]i变化的影响(×200)

图2 Hoechst 33258染色检测人参皂苷Rg1对H2O2诱导的HT22细胞凋亡(倒置荧光显微镜×200)
3 讨论
脑缺血损伤机制复杂未明,脑缺血时神经元损伤因素包括兴奋性氨基酸释放过多、自由基产生增加以及能量代谢障碍等,大多都伴有胞浆内Ca2+浓度升高。现代研究发现[7],Ca2+超载可触发一系列下游反应,包括胱天蛋白酶的激活、ATP合成障碍、钙依赖性蛋白酶和核酸酸内切酶的激活等,而这些事件最终导致神经元的损伤和死亡,细胞内Ca2+超载是缺血性神经元损伤的共同径路。本研究发现,HT22细胞损伤后,细胞内Ca2+浓度明显增高,且随着钙离子浓度的增高,细胞凋亡率越高,表明钙超载可能是引起神经元死亡和损伤的重要途径。这与以往的研究相符[8-9]。
人参皂苷Rg1是存在于人参、三七的主要活性成分,现代药理研究发现,人参皂苷Rg1具有较强的抗疲劳、抗衰老、抗肿瘤、提高免疫力等药理作用。近年来,人参皂苷Rg1对心血管和中枢神经系统的保护作用,越来越受到国内外学者的关注。大量动物实验和体外细胞实验表明[10-13],人参皂苷Rg1能通过抑制神经元凋亡,减少谷氨酸释放,抗炎症反应、清除自由基、促进神经元修复和再生等机制改善脑缺血再灌注损伤。本研究通过H2O2建立HT22细胞氧化损伤模型,研究人参皂苷Rg1能否抑制钙超载,抑制氧化应激引起的神经细胞凋亡,从而减轻脑缺血损伤。研究表明,人参皂苷Rg1可成剂量依赖性的减轻氧化应激引起的神经细胞凋亡,其机制与抑制钙超载有关。
Fluo3-AM为一种脂溶性染料,自身不与Ca2+结合,在细胞内经脂解脱去脂基后生成游离Fluo3,后者是一敏感性钙指示剂,与游离的Ca2+特异性结合,并在一定波长激发后产生荧光,其荧光强度与Ca2+浓度成正比,因而荧光值可反应Ca2+浓度的变化情况。
H2O2是一类ROS,它不仅能直接氧化细胞膜上的脂质及蛋白,而且能自由穿过细胞膜和细胞内铁离子反应生成·OH等活性更强的自由基,导致系列反应。H2O2具有获得容易、性质稳定和操作简单等特点,因此目前H2O2是各类细胞氧化损伤模型中应用最为广泛的应激源之一[14],因此本项目用H2O2损伤细胞来建立HT22细胞氧化损伤模型是可行的。
[1]Matsude T,Arakawa N,Takuma K,et al.SEA0400,a novel and selective inhibitor of the Na+-Ca2+exchanger attenuates rep effusion injury in the vitro and in vivo cerebral ischemic models [J].J Pharmacol Exp Ther,2001,298(1):249-256.
[2]吴 露,黄小平,邓常清,等.人参皂苷Rg1对小鼠脑缺血再灌注后脑组织损伤及Nrf2/HO-1途径的影响[J].中国病理生理杂志,2013,29 (11):2066-2071.
[3]刘晓丹,邓常青.黄芪甲昔和三七总皂昔中有效成分抗PC12细胞氧化损伤的配任研究[J].湖南中医药大学学报,2012,32(1):8-12.
[4]于 利,刘 霞,包翠芬,等.人参皂苷Rg1对脑缺血再灌注大鼠大脑细胞死亡方式的影响[J].中国临床解剖学杂志,2013,31(5):555-559.
[5]陈 彦,吴鸿浩,何 斌,等.人参皂苷Rg1对大鼠海马神经元缺糖氧/复糖氧后钙内流的影响[J].中国急救医学,2012,32(11):1001-1004.
[6]屈惠莹,袁 静,包翠芬,等.人参皂苷Rg1对脑缺血再灌注大鼠nNOS、iNOS表达的影响[J].天津医药,2014,12(9):889-892,893.
[7]Szydlowska K,Fymianski M.Calcimn,ischemia and excitotoxicity[J].Cell,2010,47(2):122-129.
[8]李燕华,李瑶宣.脑缺血大鼠水通道蛋白-9 mRNA表达与钙离子浓度的改变及其关系[J].《临床神经病学杂志》,2008,21(2):129-132.
[9]石咏梅.脑缺血/再灌注神经元钙离子通道的研究进展[J].医学综述,2014,20(14):2507-2509.
[10]于 利,刘 霞,包翠芬,等.人参皂苷Rg1对脑缺血再灌注大鼠大脑细胞死亡方式的影响[J].中国临床解剖杂志,2013,31(5): 555-559.
[11]Xie CL,Li JH,Wang WW,et al.Neuroprotective effect of gin senoside-Rg1 on cerebral ischemia/reperfusion injury in rats by downregulating protease-activated receptor-1 expression[J].Life Sci.2014,121(2015):145-151.
[12]邹晓莉,杜继卫.人参皂苷Rg1对局灶性脑缺血大鼠iNOS和eNOS表达的影响[J].山东医药,2012,52(13):44-45.
[13]黄小平,卢金冬,丁 煌,等.黄芪和三七的主要有效成分配伍对脑缺血/再灌注小鼠NF-κB信号通路及炎性因子表达的影响[J].中国药理学通报,2015(1):141-146.
[14]张 斌,夏作理,赵晓民,等.氧化应激模型的建立及其评价[J].中国临床康复,2006,10(44):112-114.
(本文编辑 杨 瑛)
Effect of Ginsenoside Rg1on H2O2Induced Apoptosis and Intracellular Ca2+Concentration in HT22 Cells
LIU Xiaodan1,CHENG Shaowu1,FAN Jingying2,SONG Zhenyan1,LI Ping1,DENG Changqing3*
(1.Key Laboratory of Hunan Province of Rebrovascular Disease Prevention and Treatment of Integrated Traditional Chinese and Western Medicine,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.College of Integrated of Traditional Chinese and Western Medicine,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China; 3.Medical School,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
Objective To investigate the effect of ginsenoside Rg1on H2O2induced apoptosis and intracellular Ca2+concentration in HT22 cells.Methods Ginsenoside Rg1with 0,6.25,12.5,25,50 and 100μg/L were used to pre-processing HT22 cells for 24 h,separately.Ca2+fluorescent probe Fluo-3/AM was used to load cells for 1h.Then using 50 mmol/L H2O2stimulate cells.The fluorescence intensity was measured for microplate reader, [Ca2+]i changes were monitored by scanning confocal microscopy.Apoptosis were tested by Hoechst 33258 staining.Results The Ca2+concentration (P<0.01)and apoptosis (P<0.01)induced by H2O2increased significantly.Different concentrations of ginsenoside Rg1showed dose dependent inhibition in increasing the HT22[Ca2+]i (P<0.01)and apoptosis(P<0.01)induced by H2O2,and the concentation of 50μg/L shows strongest effect(P<0.01).Conclusion The ginsenoside Rg1could inhibit apoptosis of oxidative apoptosis by reducing the cellular Ca2+level induced by H2O2.
ginsenoside Rg1;HT22 cell;apoptosis;Ca2+concentration
R285.5
A
10.3969/j.issn.1674-070X.2017.03.002
2016-08-30
国家自然科学基金项目(81473581),湖南省教育厅项目(14C0859),中西医结合防治心脑疾病的相关基础研究湖南省高校科技创新团队项目(2015CXTD),中西医结合基础湖南省重点学科开放基金项目。
刘晓丹,女,硕士,实验师,研究方向:心脑疾病中西医结合防治研究。
*邓常清,男,博士,教授,博士研究生导师,E-mail:dchangq@@sohu.com。

