钨钴硬质合金职业接触者血清KL-6水平的分析*
王乐乐,张雪艳,王忠旭,唐仕川,彭仁和,胡双球,何卫红,孙 康,贾 光
(1.北京大学 公共卫生学院,北京 100191;2. 中国疾病预防控制中心 职业卫生与中毒控制所,北京 100050;3.北京市劳动保护科学研究所,北京 100054;4.湖南省职业病防治院,湖南 长沙 410007;5.株洲市职业病防治中心,湖南 株洲 412000)
0 引言
硬质合金作业劳动者长期接触硬质合金粉尘(主要成分碳化钨、钴)可引起肺部炎症和纤维化病变,严重时可导致硬金属肺病[1-2],属于我国法定职业病。KL-6(krebs. von den lungen-6)为人II型肺泡细胞表面抗原,研究表明KL-6水平升高与肺损伤程度相关[3],间质性肺疾病、急性肺损伤、炎症、纤维化等患者均伴有外周血清KL-6升高的现象。本研究通过横断面流行病学调查,在作业场所钨钴暴露评价基础上,分析硬质合金作业劳动者和对照人群外周血清KL-6水平,并探讨多种因素对血清KL-6水平的影响。
1 对象与方法
1.1 研究对象
选取湖南株洲4家硬质合金企业中从事车间生产的劳动者作为接触组,选取企业的行政管理人员、科研人员和同一时期在株洲市职业病防治所体检的其他行业无呼吸系统毒物接触的工作人员作为对照组。通过问卷调查了解研究对象基本信息,排除信息不全和有明确呼吸系统疾病的工人。最终接触组纳入407名劳动者,对照组297名。
1.2 生产环境监测
依据《GBZ/T 160-2004-工作场所空气有毒物质测定》中的方法,测定生产车间空气中钨、钴的8 h时间加权平均浓度,所有接触组岗位均测定钨浓度,代表性岗位测定了钴浓度。
1.3 肺功能检测
由株洲市职业病防治所检测研究对象肺通气功能,包括VC,FVC,FEV1,FEV1/FVC等4个指标。
1.4 标本采集
采集空腹静脉血3 mL,分离血清,-80℃储存,待测。
1.5 实验方法
KL-6采用竞争法酶联免疫吸附实验测定,酶标仪为美国ThermoMultiskan MK3全自动酶标仪,试剂盒为上海蓝基生物科技有限公司人II型肺泡细胞表面抗原ELISA试剂盒。
1.6 统计学处理

2 结果分析
2.1 企业生产工艺
本研究4家企业生产硬质合金均为碳化钨-钴硬质合金,其主要成分为碳化钨和钴,生产工艺流程基本相同,见图1。

图1 硬质合金生产流程Fig.1 Production flow chart of tungsten carbide-cobalt alloy
2.2 研究对象基本情况
对研究对象的性别、吸烟、饮酒、年龄、工龄、血清KL-6水平进行统计分析,结果如表1、表2。性别、年龄在接触组与对照组之间差异无统计学意义,而工龄、吸烟、饮酒情况在2组间存在差异且有统计学意义,接触组的工龄(11.9±9.4a)高于对照组(10.2±9.1a),接触组的吸烟率(53.3%)和饮酒率(44.5%)高于对照组的吸烟率(43.7%)和饮酒率(33.3%)。接触组血清KL-6水平(2.01±0.89 ng/mL)显著高于对照组(1.65±0.97 ng/mL)。
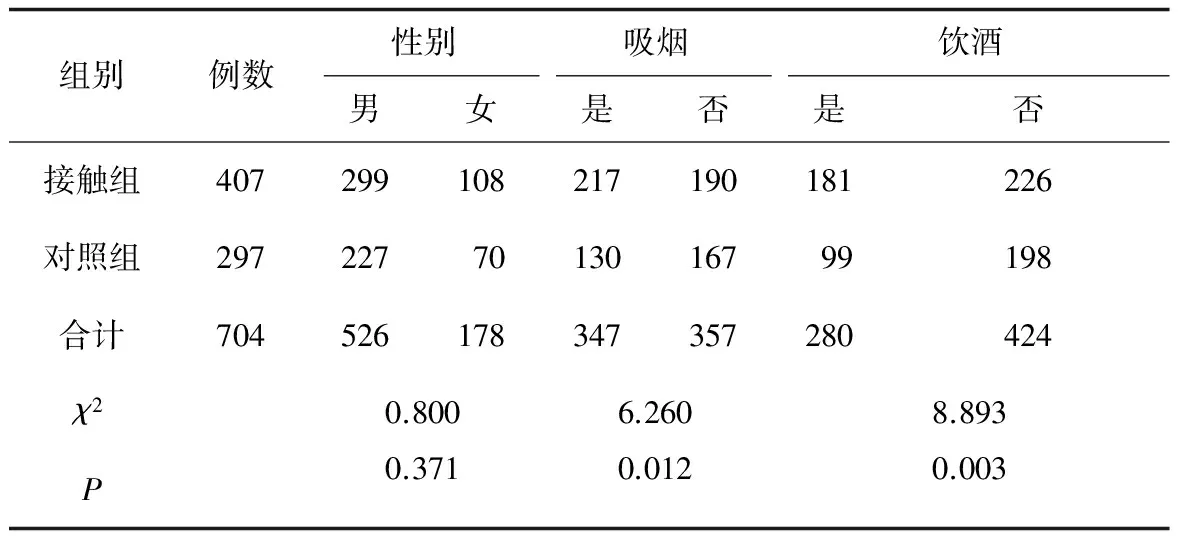
表1 研究对象性别、吸烟、饮酒情况比较

表2 研究对象年龄、工龄、血清KL-6比较
2.3 研究对象肺功能
对研究对象肺功能数据进行比较分析,结果如表3。接触组与对照组只有FEV1/FVC(%)差异有统计学意义,接触组此比值高于对照组,但是接触组与对照组所有肺功能数据均在正常范围内。
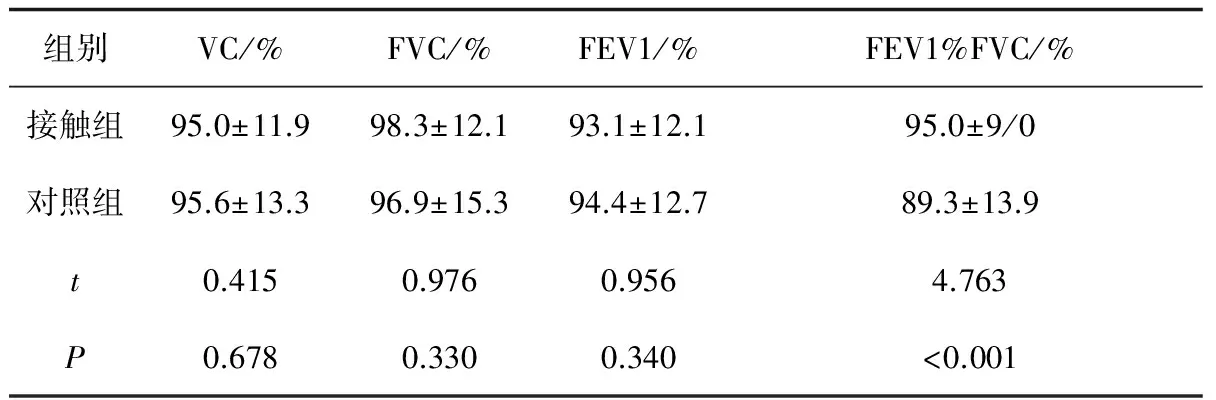
表3 研究对象肺功能比较
2.4 吸烟、饮酒对研究对象血清KL-6水平的影响
根据问卷,吸烟定义为一生中连续或累积吸烟6个月及以上,是否饮酒设置经常、偶尔、否3个选项,将选择经常定义为饮酒。对接触组和对照组分别按照吸烟与不吸烟、饮酒与不饮酒分组,讨论吸烟、饮酒因素对劳动者血清KL-6水平的影响,结果如表4、表5。接触组与对照组中吸烟与不吸烟者血清KL-6水平差异无统计学意义;接触组与对照组中饮酒者血清KL-6水平高于不饮酒者,但只在接触组中差异有统计学意义。

表4 吸烟对研究对象血清KL-6水平的影响

表5 饮酒对研究对象血清KL-6水平的影响
2.5 年龄、工龄对研究对象血清KL-6水平的影响
将所有劳动者按年龄、工龄分组,分析年龄、工龄对血清KL-6水平的影响,结果如表6、表7。无论接触组还是对照组,不同年龄组的劳动者血清KL-6水平差异无统计学意义。不同工龄组的劳动者血清KL-6水平差异有统计学意义,接触组与对照组中工龄6~15 a的劳动者血清KL-6水平高于其他工龄组。

表6 不同年龄组研究对象血清KL-6水平比较

表7 不同工龄组研究对象血清KL-6水平比较
2.6 不同岗位钴与钨的8 h时间加权平均浓度
测定生产车间空气中钨、钴的8 h时间加权平均浓度(PC-TWA),接触组18个岗位均测定了钨浓度,其中9个岗位测定了钴浓度,结果如表8。

表8 各岗位钴与钨及其化合物8 h时间加权平均浓度
我国规定PC-TWA钴为0.05 mg/m3,钨为5 mg/m3。本研究中喷雾干燥、湿磨2个岗位钴浓度高于国家限值,其他岗位钴浓度低于国家限值;所有岗位钨浓度均低于国家限值。
2.7 钴浓度对研究对象血清KL-6水平的影响
依据表7,将钴浓度超过国家限值的喷雾干燥、湿磨2个岗位划为钴高浓度组,其余7个低于国家限值的岗位划为钴低浓度组,分析不同的钴接触水平对接触组血清KL-6的影响,结果如表9。接触不同浓度钴的劳动者血清KL-6水平差异有统计学意义,高浓度钴接触劳动者血清KL-6水平高于低浓度组。

表9 环境钴浓度对研究对象血清KL-6水平的影响
3 讨论
硬质合金生产中存在大量粉尘,其主要成分为碳化钨和钴。硬质合金粉尘对呼吸系统具有毒性效应,细胞实验表明硬质合金粉尘可降低呼吸系统细胞存活率[4-5],动物实验表明硬质合金粉尘可造成动物肺的炎症反应和组织纤维化[6-7],流行病学调查显示接触硬质合金粉尘可造成工人从支气管肺泡炎到末期肺纤维化的肺实质病理变化过程,严重可发展为硬金属肺病[8-10]。
KL-6为人II型肺泡细胞表面抗原,是1985年Kohno在研究肺部恶性肿瘤时发现的一种高分子量糖蛋白[11],主要表达于II型肺泡上皮细胞和支气管上皮细胞。正常生理情况下KL-6在外周血循环中浓度较低,当发生某些病理状态时,肺泡受损,肺泡I型上皮细胞死亡后,肺泡基底膜上的II型上皮细胞再生,表达KL-6增加,同时被释放出来,从肺部渗入血液中[12]。KL-6的水平可反映肺损伤的程度,已有研究证明在间质性肺疾病患者血清及肺泡灌洗液中KL-6水平较健康人明显升高,血清KL-6被证明是放射性肺炎、特发性肺间质纤维化、过敏性肺炎等间质性肺病的敏感标志物[13-14]。
本研究中,接触组与对照组肺功能只有FEV1/FVC(%)差异有统计学意义,但是接触组与对照组所有肺功能数据均在正常范围内,说明在本研究的暴露浓度下,硬质合金粉尘接触并未对劳动者肺功能指标造成显著影响。但接触组血清KL-6水平高于对照组,提示接触硬质合金粉尘对劳动者肺造成损伤,血清KL-6水平比肺功能指标更加敏感。在分析各因素影响时,吸烟并未对劳动者血清KL-6产生显著影响,而饮酒者在接触组和对照组中血清KL-6均高于不饮酒者,且在接触组中差异有统计学意义,提示饮酒可能是加重硬质合金粉尘造成劳动者肺损伤的1个因素。我们未发现年龄对劳动者血清KL-6有显著影响,但工龄对血清KL-6水平有显著影响,接触组和对照组中工龄6~15 a的劳动者血清KL-6水平均高于其他工龄组。
既往研究发现,钴尘的细胞毒性、对动物的肺损伤要高于碳化钨粉尘,Sabbioni等[15]发现钴与白蛋白结合,形成钴结合蛋白,作为半抗原,促使IgE升高,引起I型超敏反应。有研究者认为钴是硬质合金粉尘的主要危害因素。本研究结果与之相符,在钴高浓度组,劳动者血清KL-6水平显著高于低浓度组。
4 结论
1)接触硬质合金粉尘可导致劳动者血清KL-6水平升高。
2)饮酒可能是加重硬质合金粉尘造成肺损伤的1个危险因素。
3)钴尘可能是硬质合金粉尘造成肺损伤的主要危害因素。
4)年龄、吸烟因素对硬质合金劳动者血清KL-6水平无显著影响。
[1]Ruediger H. W. Hard metal particles and lung disease: coincidence or causality?[J]. Respiration, 2000,67(2):137-138.
[2]Montero M. A, de Gracia J, Morell F. Hard metal interstitial lung disease[J]. Arch Bronconeumol, 2010,46(9):489-491.
[3]Ohnishi H. Yokoyama A, Kondo K, et al. Comparative study of KL-6, surfactant protein-A, s surfactant protein-D, and monocyte chemoattractant protein-1 as serum markers for interstitial lung diseases[J]. Am J ResPirCrit Care Med,2002,165(3):378-381.
[4]Bastian S, Busch W, Kühnel D, et al.Toxicity of tungsten carbide and cobalt-doped tungsten carbide nanoparticles in mammalian cells in vitro[J]. Environ Health Perspect, 2009, 117(4): 530-536.
[5]ArmsteadAL, Arena CB, Li B. Exploring the potential role of tungsten carbide cobalt (WC-Co) nanoparticle internalization in observed toxicity toward lung epithelial cells in vitro[J]. Toxicol Appl Pharmacol, 2014,278(1): 1-8.
[6]LasfarguesG, LisonD, MaldagueP, et al.Comparative study of the acute lung toxicity of pure cobalt powder and cobalt-tungsten carbide mixture in rat[J]. ToxicolApplPharmacol, 1992,112(1): 41-50.
[7]LasfarguesG,LardotC,DelosM, et al.The delayed lung responses to single and repeated intratracheal administration of pure cobalt and hard metal powder in the rat[J]. Environ Res, 1995, 69(2): 108-121.
[8]van den Eeckhout AV, Verbeken E, Demedts M, et al. Pulmonary pathology due to cobalt and hard metals[J]. Rev Mal Respir, 1989,6(3):201-207.
[9]Auchincloss JH, Abraham JL, Gilbert R, et al. Health hazard of poorly regulated exposure during manufacture of cemented tungsten carbides and cobalt[J].Br J Ind Med, 1992,49(12):832-836.
[10]邹世渠,邹彤彤,马伏生等.硬质合金粉尘致肺纤维化作用的流行病学调查[J]. 中华预防医学杂志,1995,29(2):70-72.
ZOU Shiqu, ZOU Tongtong, MA Fusheng, et al. An epidemiologic study on pulmonary fibrosis caused by hard alloy dust[J]. Chinese Journal of Preventive Medicine, 1995,29(2):70-72.
[11]Kohno N, Akiyama M, Kyoizumi S, et al. Detection of soluble tumor associated antigens in seraand effusions using novel monoclonal antibodies, KL-3 and KL-6, against lung adenocarcinoma[J]. JPn J ClinOncol,1988,18(3):203-206.
[12]Zhang Y, Kaminski N, Biomarkers in idiopathic pulmonary fibrosis [J]. CurrOpinPulm Med, 2012,18,(5):441-446.
[13]Ichiyasu H, Ichikado K, Yamashita A, et al. Pneumocyte biomarkers KL-6 and surfactant protein D reflect the distinct findings of high-resolution computed tomography in nonspecific interstitial pneumonia [J]. Respiration, 2012, 83(3):190-197.
[14]Huang H, Peng X, Nakajima J. Advances in the study of biomarkers of idiopathic pulmonary fibrosis in Japan [J]. Biosci Trends, 2013, 7(4):172-177.
[15]Sabbioni E, Minoia C, Pictra R, et al. Metal determinations in biological specimens of discased and non-discased hard metal workers[J]. Sci Total Environ,1994,150(1-3):41-54.

