胃癌组织中microRNA-210的表达与临床病理因素及预后关系的研究
俞鹏飞,杜义安,杨立涛,戴丐国,黄 灵
浙江省肿瘤医院腹部外科,浙江 杭州 310022
胃癌组织中microRNA-210的表达与临床病理因素及预后关系的研究
俞鹏飞,杜义安,杨立涛,戴丐国,黄 灵
浙江省肿瘤医院腹部外科,浙江 杭州 310022
背景与目的:miR-210与胃癌的发生、发展密切相关,但其作用机制及临床意义仍不明确。该研究旨在探讨miR-210在胃癌组织中的表达情况及其临床意义。方法:采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测78例胃癌组织及相应的癌旁组织中miR-210的表达情况,分析其与临床病理因素及预后的关系。结果:RTFQ-PCR检查结果发现,miR-210在胃癌组织中的表达高于癌旁组织,两者相比差异有统计学意义(P<0.05)。miR-210的表达与肿瘤大小、淋巴结转移及TNM分期密切相关,而与患者年龄、性别、肿瘤的分化程度及浸润深度等无关。miR-210低表达患者5年生存率为48.2%,miR-210高表达患者5年生存率为30.4%,差异有统计学意义(χ2=4.216,P=0.040)。结论:miR-210在胃癌组织中的表达明显高于癌旁正常组织,可能与胃癌的发生、发展及预后有关。miR-210有望成为胃癌新的诊断标志物及治疗靶点。
胃癌;microRNA-210;转移;预后
胃癌是我国最常见的肿瘤之一,死亡率在全部恶性肿瘤中排第三位[1],侵袭和转移是导致胃癌预后不良的主要原因[2]。MicroRNA (miRNA,miR)是近年来发现的一种有重要功能的非编码RNA,miR通过与目标mRNA的3’非编码区相互作用广泛参与基因的表达调控,在恶性肿瘤的发生、发展中起到重要作用[3]。miR-210是一种受缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)调控的miR[4],既往研究发现miR-210在肝癌等多种肿瘤中表达上调[5-7],发挥癌基因的作用。但到目前为止,miR-210与胃癌临床病理因素及与预后关系仍不明确。本文旨在检测胃癌组织中miR-210的表达水平,研究其与胃癌的临床病理特征及预后的关系。
1 资料和方法
1.1 临床资料
收集2009年1月—2010年12月在浙江省肿瘤医院腹部外科接受治疗的胃癌患者组织标本共78例。入院后行标准的胃癌根治手术,在肿瘤标本离体30 min内,从切除的胃癌组织中留取肿瘤标本,同时在距肿瘤切缘大于2 cm处留取非肿瘤组织作为对照。所有患者手术前均未接受放化疗。本研究所收集的组织标本均在浙江省肿瘤医院生物样本标本库登记,经浙江省肿瘤医院伦理委员会同意。患者的临床资料见表1。
1.2 方法
1.2.1 总RNA的提取
采用TRIzol试剂(美国Invitrogen公司)提取组织RNA,将最终获得的RNA溶于无RNase水中,于-80 ℃保存。采用紫外分光光度计检测其纯度,用1.5%琼脂糖凝胶电泳鉴定样品的完整性。
1.2.2 RTFQ-PCR检测miR-210的含量
逆转录反应依照NCodeTMVILOTMmiRNA cDNA合成试剂盒(购自美国Invitrogen公司)合成cDNA,进行实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测。以 U6 作为内参基因,U6正义链为5’-CTCGCTTCGGCAGCACA-3’,U6 反义链为5’-AACGCTTCACGAATTTGCGT-3。miR-210正义链为5’-GTGCAGGGTCCGAGG T-3’,miR-210反义链为5’-TATCTGTGCGTG TGACAGCGGCT-3’。结果采用ABI 7900统计软件进行分析, 实验重复3次。miR-210的相对表达水平采用 2-△CT法,取U6作为内参,以miR-210/U6基因的比值作为miR-210的表达含量。
1.3 统计学处理
采用SPSS 19.0统计软件对资料进行统计学分析。计数资料用χ2检验,计量资料用t检验,并用Kaplan-Meier法及log-rank法进行生存分析和生存率比较,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-210在胃癌及癌旁非肿瘤组织中的表达情况
胃癌组织中miR-210的相对表达量为4.42±3.56,癌旁非肿瘤组织中相对表达量为2.98±1.50,两者相比差异有统计学意义(P<0.05,图1)。

图 1 miR-210在胃癌及癌旁组织中的表达情况Fig. 1 The expression of miR-210 in gastric cancer and adjacent nontumorous tissues
2.2 miR-210的表达与胃癌临床病理特征之间的关系
78例患者按照不同的临床病理因素进行重新分组统计分析,每组胃癌患者的组织标本中的miR-210表达水平见表1。结果显示,miR-210在肿瘤大于等于5 cm患者中的表达明显高于肿瘤小于5 cm的患者,有淋巴结转移患者明显高于无淋巴结转移患者,Ⅲ、Ⅳ期的表达明显高于Ⅰ、Ⅱ期,差异有统计学意义;而与患者年龄、性别,分化程度及浸润深度等无关(P>0.05)。

表 1 miR-210的表达与胃癌患者临床病理指标的相关性Tab. 1 Correlation of miR-210 expression with clinicopathological parameters in patients with gastric cancer
2.3 miR-210的表达与患者预后的关系
根据胃癌患者中miR-210表达水平差异(平均差异大于2倍)将患者分成低表达组(n=21)和高表达(n=57)两组。结果显示,miR-210低表达组3年生存率为66.7%,5年生存率为48.2%,miR-210高表达组3年生存率为57.1%,5年生存率为30.4%,miR-210低表达组3年及5年生存率均高于miR-210高表达组,其中5年生存率的差异有统计学意义(χ2=4.216,P=0.040)。
3 讨 论
胃癌是我国常见的消化道恶性肿瘤,就诊时多数已属进展期,获得根治性手术切除的比例较少,且术后局部复发及远处转移的发生率高,治疗效果差,已成为严重威胁人类健康的恶性肿瘤之一[8]。但到目前为止,胃癌发生、发展的相关机制仍不明确。近些年的研究表明,miR在恶性肿瘤的发生及侵袭转移中可能起到了重要作用[9]。miR通过与靶基因 3’非翻译区结合,导致RNA诱导的沉默复合体(RNA-induced silencing complex, RISC)降解靶mRNA或阻碍其翻译,并且参与到包括肿瘤在内的多种疾病过程中[3,10]。miR-210是目前所知受缺氧调控最明显的miR,在缺氧状态下miR-210的异常表达与多种肿瘤的发生、发展密切相关[4]。既往的研究发现,miR-210在胰腺癌和肝癌等消化系统肿瘤中表达上调,且与患者预后相关[5,11]。miR-210与胃癌的发生、发展也有着密切的关系。Du等[12]的研究表明,miR-210的甲基化与幽门螺旋杆菌的感染有关,并可能在胃癌的形成中起到重要作用。Rotkrua等[9]的研究发现弥漫型胃癌小鼠血清中miR-210较对照组明显升高,并可作为早期监测肿瘤的可靠指标。
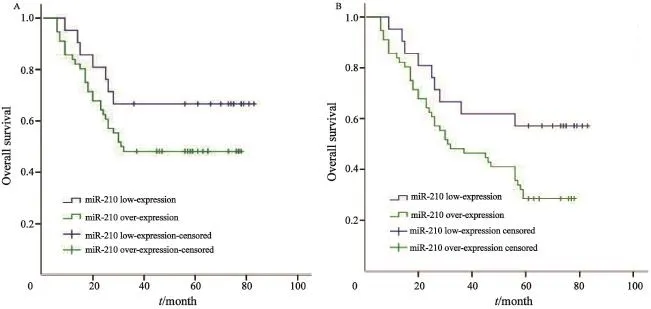
图 2 miR-210高表达组和低表达组之间生存时间的比较Fig. 2 Comparison of survival time between miR-210 over-expression and low-expression groups
在本研究中,miR-210在胃癌组织中的表达明显高于癌旁组织,差异有统计学意义(P<0.05),提示胃癌的发生、发展可能与miR-210表达上调有关。我们进一步分析miR-210的表达与胃癌患者临床病理特征及预后的关系,发现miR-210的表达与患者的年龄、性别、分化程度及浸润深度等无关(P>0.05),而与肿瘤大小、淋巴结转移状态、TNM分期及5年生存率有关(P<0.05)。以上研究表明miR-210可能作为一种癌基因参与胃癌的发生、发展过程,并与其预后密切相关。因此,在胃癌的治疗中,我们是否可以通过抑制miR-210的表达,抑制其癌基因的作用从而达到治疗疾病的目的,这也为胃癌的治疗提供了新的靶点。当然,在本研究中也存在一些不足,比如样本量偏小,以及没有进一步研究miR-210下游通路或靶基因,这些都有待于进一步的改进和完善。
本研究通过检测miR-210在胃癌组织中的表达情况,初步证实miR-210与胃癌的发生、发展密切相关,并可作为判断预后的可靠指标,有望为胃癌的治疗提供新的靶点。
[1] LAM J K, CHOW M Y, ZHANG Y, et al. siRNA versus miRNA as therapeutics for gene silencing[J]. Mol Ther Nucleic Acids, 2015, 4(9): 252.
[2] AFONSO-GRUNZ F, MÜLLER S. Principles of miRNA-mRNA interactions: beyond sequence complementarity[J]. Cell Mol Life Sci, 2015, 72(16): 3127-3141.
[3] ZHAO W, ZHAO J J, ZHANG L, et al. Serum miR-21 level: a potential diagnostic and prognostic biomarker for non-small cell lung cancer[J]. Int J Clin Exp Med, 2015, 8(9): 14759-14763.
[4] QIN Q, FURONG W, BAOSHENG L. Multiple functions of hypoxia-regulated miR-210 in cancer[J]. J Exp Clin Cancer Res, 2014, 33(1): 1-10.
[5] YING Q, LIANG L, GUO W, et al. Hypoxia-inducible microRNA-210 augments the metastatic potential of tumor cells by targeting vacuole membrane protein 1 in hepatocellular carcinoma[J]. Hepatology, 2011, 54(6): 2064-2075.
[6] WANG Z, CAI Q, JIANG Z, et al. Prognostic role of microRNA-21 in gastric cancer: a meta-analysis[J]. Med Sci Monit, 2014, 20: 1668-1674.
[7] LIU L, YE J X, QIN Y Z, et al. Evaluation of miR-29c, miR-124, miR-135a and miR-148a in predicting lymph node metastasis and tumor stage of gastric cancer[J]. Int J Clin Exp Med, 2015, 8(12): 22227-22236.
[8] 陈万青, 郑荣寿, 张思维, 等. 2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤, 2016, 25(1): 1-8.
[9] ROTKRUA P, SHIMADA S, MOGUSHI K, et al. Circulating microRNAs as biomarkers for early detection of diffuse-type gastric cancer using a mouse model[J]. Br J Cancer, 2013, 108(4): 932-940.
[10] MOTAWI T K, RIZK S M, IBRAHIM T M, et al. Circulating microRNAs, miR-92a, miR-100 and miR-143, as noninvasive biomarkers for bladder cancer diagnosis[J]. Cell Biochem Funct, 2016, 34(3): 142-148.
[11] GREITHER T, GROCHOLA L F, UDELNOW A, et al. Elevated expression of microRNAs 155, 203, 210 and 222 in pancreatic tumors is associated with poorer survival[J]. Int J Cancer, 2010, 126(1): 73-80.
[12] DU Y, LIU Z, GU L, et al. Characterization of human gastric carcinoma-related methylation of 9 miR CpG islands and repression of their expressions in vitro and in vivo[J]. BMC Cancer, 2012, 12: 249.
Expression of microRNA-210 in gastric cancer and its relationship with clinicopathological factors and prognosis
YU Pengfei, DU Yian, YANG Litao, DAI Gaiguo, HUANG Ling (Department of Abdominal Surgery, Zhejiang Cancer Hospital, Hangzhou 310022, Zhejiang Province, China) Correspondence to: DU Yian E-mail: ypfzmu@163.com
Background and purpose: miR-210 was closely related to the occurrence and development of gastric cancer, but its mechanism and clinical significance were still not clear. The purpose of this study was to explore the expression of miR-210 in gastric cancer tissues and its clinical significance. Methods: The expression of miR-210 was detected in gastric cancer tissues and the corresponding adjacent tissues. The relationship between the expression of miR-210 and clinical pathological factors and prognosis was analyzed. Results: Real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) showed that the expression of miR-210 in gastric cancer was higher than that in adjacent tissues, and there was a significant difference between the two groups (P<0.05). The expression of miR-210 was closely related to tumor size, lymph node metastasis and TNM stage, but was not related to age, gender, tumor differentiation and depth of invasion. The 5-year survival rate of patients with low miR-210 expression was 48.2%, whereas the 5-year survival rate of patients with high miR-210 expression was 30.4% (χ2=4.216, P=0.040). Conclusion: The expression of miR-210 in gastric cancer was higher than that in adjacent tissues, and maybe related to the development and prognosis of gastric cancer. miR-210 is expected to be a new diagnostic marker and therapeutic target for gastric cancer.
Gastric cancer; MicroRNA-210; Metastasis; Prognosis
10.19401/j.cnki.1007-3639.2017.03.006
R735.2
A
1007-3639(2017)03-0197-04
2016-08-10
2016-12-02)
浙江省自然科学基金(LY14H160007)。
杜义安 E-mail:ypfzmu@163.com

