4种人肾细胞癌原位移植裸鼠模型建立方法的比较
赵佩佩,陈晓静,王巧玲,赵 雪,赵亚男,刘培峰,戴慧莉
1.上海交通大学医学院附属仁济医院肾脏科,上海200127;
2.上海交通大学医学院附属仁济医院中心实验室,上海200127
4种人肾细胞癌原位移植裸鼠模型建立方法的比较
赵佩佩1,2,陈晓静2,王巧玲1,2,赵 雪2,赵亚男2,刘培峰2,戴慧莉1,2
1.上海交通大学医学院附属仁济医院肾脏科,上海200127;
2.上海交通大学医学院附属仁济医院中心实验室,上海200127
背景与目的:肾细胞癌是最常见的肾脏恶性肿瘤,起病隐匿,恶性程度高。研究旨在建立成功率高、稳定的人肾细胞癌原位动物造模方法。方法:采用人肾细胞癌细胞(786-0、ACHN)进行细胞悬液原位注射法、皮下成瘤后引瘤原代细胞悬液原位注射法、皮下成瘤后引瘤组织块原位移植肾包膜下法及皮下成瘤后引瘤组织块原位移植肾周筋膜内法建立原位移植裸鼠模型,采用PET/CT、H-E染色、免疫组织化学染色及血清生化检测等手段观察成瘤率及肿瘤生长情况,评估4种方法的建模效果。结果:人肾细胞癌皮下移植瘤裸鼠模型,ACHN组成瘤率(90%)高于786-0组(30%);人肾细胞癌原位移植裸鼠模型,786-0原位注射组、ACHN原位注射组、ACHN皮下移植瘤引瘤后原代细胞原位注射组、ACHN组织块肾包膜下包埋组和ACHN组织块肾周筋膜内包埋组的成瘤率分别为33%、80%、90%、100%和20%,其中以ACHN皮下成瘤后引瘤组织块原位移植肾包膜下法成瘤率最高,影像学及病理组织学检查结果显示符合低分化肾细胞癌。结论:成功建立4种人肾细胞癌原位移植裸鼠模型,其中以ACHN皮下成瘤后引瘤组织块原位移植肾包膜下法成瘤效果最佳,为肾细胞癌发病机制及靶向治疗的进一步研究提供理想的动物模型。
肾细胞癌;裸鼠;原位移植;PET/CT;ACHN细胞
肾细胞癌(renal cell carcinoma,RCC)作为肾脏最常见肿瘤,占成人恶性肿瘤的3%~4%,发病率以每年1.6%的速度增长。肾细胞癌起病隐匿[1],约30%的患者在初诊及手术时即已出现局部进展或远处转移,对放化疗不敏感,预后较差[2]。为进一步研究肾癌发病机制,改善临床治疗效果,肾癌动物模型的构建是十分必要。
前期研究表明,肾包膜下原位注射肾癌细胞是最常用的原位肾癌建模方法[3-6],但此法易发生细胞溢出,造成严重腹水,影响建模效果。后研究人员开发了肿瘤组织块包埋种植法,并成功在兔中建立了肾癌原位模型[7],但其移植癌病理分型显示为鳞癌,与人肾癌的常见的病理类型不一致。在此基础上,我们采用BALB/c裸鼠对上述方法进行改进,并新增两种建模方法(引瘤后原代细胞注射法、引瘤后组织块肾周筋膜法)建立了人肾细胞癌原位动物模型,后对动物模型进行影像学检查[8-9]和组织病理学检查[10-12],评价4种方法的建模效果。
1 材料和方法
1.1 实验动物
BALB/c裸鼠,4周龄,雄性,体质量10~15 g,购自上海斯莱克实验动物有限责任公司。受试动物饲养于上海市仁济医院实验动物中心SPF级无菌独立送风IVC笼中,每笼5只。饲以专门为小鼠配制的消毒饲料,自由饮用纯净水。动物实验室内温度保持在约23 ℃,相对湿度40%~70%。
1.2 实验细胞
人肾细胞癌ACHN和786-0细胞均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。培养基为含10%胎牛血清(购自美国Gibco公司)的DMEM培养基(购自美国Gibco公司)。培养基为含10%胎牛血清(购自美国Gibco公司)的RPMI-1640培养基(购自美国Gibco公司)。细胞均培养于37 ℃、CO2体积分数为5%的培养箱中,每2~3 d传代1次。
1.3 主要试剂
异氟烷购自中国深圳市瑞沃德公司,水合氯醛购自国药集团化学试剂有限公司,4%多聚甲醛购自北京鼎国昌盛生物技术有限责任公司,30%过氧化氢溶液购自生工生物工程(上海)股份有限公司,牛白蛋白(Albumin from bovine serum,BSA)购自国药集团化学试剂有限公司,DAB染色试剂盒购自美国Dako公司,Vimentin兔单克隆抗体购自美国Cell Signaling Technology公司,抗细胞角蛋白(cytokeratin 8,CK8)抗体购自美国Abcam公司,猪抗兔IgG/HRP二抗、兔抗鼠免疫球蛋白/HRP二抗购自基因科技(上海)股份有限公司。
1.4 人肾细胞癌皮下移植裸鼠模型的建立
在无菌条件下将贴壁培养的人肾细胞癌细胞系786-0和ACHN细胞消化成细胞悬液,细胞活力测定大于95%,进行细胞计数,调整两种细胞悬液的细胞密度为5×107个/mL,将上述细胞悬液注射至裸鼠左侧和右侧背部皮下,每侧每只0.1 mL(即每只5×106个细胞),制成皮下移植瘤,每种细胞系注射10只裸鼠。
1.5 人肾细胞癌原位移植裸鼠模型的建立
1.5.1 人肾癌细胞系细胞悬液原位注射法
取对数生长期细胞,用0.25%的胰酶消化,重悬。进行细胞活力测定和细胞计数,后用0.9%氯化钠溶液调整活细胞密度至5×107个/mL。
裸鼠采用3.5%水合氯醛溶液腹腔注射(0.01 mL/g)进行麻醉,后固定裸鼠并消毒。沿腹正中线剪开皮肤与腹膜,裸露右侧肾脏。用1 mL无菌注射器吸取调整好细胞活力和浓度的细胞悬液,从肾下极进针,穿过肾实质直到肾上极包膜下,注射成功的标志为肾实质肿胀,肾包膜颜色变白,注射剂量为0.01 mL/只(即每只5×105个细胞),每种细胞系注射10只裸鼠。术后缝合皮肤后置于SPF条件下继续饲养。
1.5.2 皮下成瘤后引瘤原代细胞悬液原位注射法
采用脱颈椎法处死1.4中荷瘤裸鼠,在无菌条件下取出瘤体,去除结缔组织,用眼科剪反复剪切,剪碎后用200目细胞滤网过滤后得到单个细胞悬液,将获得的单个细胞悬液置于培养瓶中进行常规培养[13]。待细胞生长至足够数量时,按1.5.1中方法收集细胞,调整活细胞密度至5×107个/mL。
按1.5.1中方法将上述细胞悬液注射至裸鼠右肾包膜下,共注射10只裸鼠。
1.5.3 皮下成瘤后引瘤组织块原位移植肾包膜下法
采用脱颈椎法处死1.4中荷瘤裸鼠,在无菌条件下剥离瘤体,去除结缔组织、凝血块等,含100 U/mL青霉素、100 μg/mL链霉素的0.9%氯化钠溶液冲洗,使用眼科剪及手术刀片将肿瘤组织切成1 mm×1 mm×1 mm大小碎块,置于含双抗的0.9%氯化钠溶液中待用。
按1.5.1中方法暴露裸鼠右侧肾脏。在肾包膜上开2~3 mm的切口,后将处理的RCC组织块经切口放入肾包膜下,并注意远离切口。后取肾周脂肪组织覆盖切口,加压缝合。术后缝合皮肤后置于SPF条件下继续饲养。共处理10只裸鼠。
1.5.4 皮下成瘤后引瘤组织块原位移植肾周筋膜内法
同1.5.3准备移植用肿瘤组织块,按1.5.1中方法暴露裸鼠右侧肾脏。切开肾周筋膜2~3 mm,夹取肿瘤组织块放入腹膜后肾窝,缝合肾周筋膜和皮肤后置于SPF条件下继续饲养。共处理10只裸鼠。
1.6 肾细胞癌原位裸鼠模型成瘤性检测
1.6.1 体质量监测
自原位接种日起每周对裸鼠称重,连续监测6周,观察裸鼠体质量变化。
1.6.2 影像学检测
从原位接种后第2周起,每隔7 d随机选取各实验组中2只裸鼠行PET/CT扫描,评估肿瘤生长情况,连续检测4周。
1.6.3 组织学检查
从建模后第2周开始,每周每组随机处死1只裸鼠,解剖剥离其肾脏、肝脏、肺、脾脏、心脏等主要器官,观察器官的解剖学变化。并将上述器官用4%多聚甲醛固定,石蜡包埋、切片,行苏木精-伊红染色(H-E染色):脱蜡、复水后用苏木精染细胞核,伊红染细胞质和细胞外基质,中性树胶封片后在光镜下观察拍照;免疫组织化学染色:脱蜡、复水、3%过氧化氢溶液浸泡、抗原修复、1%BSA封闭后,用一抗Vimentin(1∶100)、CK8(1∶50)4 ℃温育过夜,随后用HRP标记的二抗温育,DAB显色,中性树胶封片后,在光镜下观察拍照。
1.6.4 血清采集与检测
采集各组裸鼠血样,室温下静置30 min,后经1 174×g离心10 min,离心所得上清检测肌酐、尿素氮、尿酸、谷丙转氨酶、谷草转氨酶、总蛋白、白蛋白、球蛋白和总胆红素等血液学指标。
1.7 统计学处理
采用Graphpad Prism软件(Graphpad Software)进行统计分析,计量资料采取t检验。P<0.05为差异有统计学意义。比较不同组间差异来确定不同处理方式下肾细胞癌成瘤率和转移率,评判几种建模方法的效果。
2 结 果
2.1 动物模型生长情况
2.1.1 肾细胞癌皮下移植裸鼠模型
皮下成瘤时间4周,4周内786-0组和ACHN组在皮下接种后无死亡。皮下成瘤实验结果显示,786-0组成瘤率为30%(3/10),ACHN组成瘤率为90%(9/10)。因786-0组皮下移植成瘤率较低,在建立肾细胞癌原位移植裸鼠模型时,引瘤后原代细胞悬液原位注射法、组织块原位移植肾包膜下法和肾周筋膜内法中所用瘤块均为采用ACHN细胞系进行皮下移植瘤接种所得。
2.1.2 肾细胞癌原位移植裸鼠模型
2.1.2.1 肾癌细胞系(786-0和ACHN)细胞悬液原位注射法
两种细胞系(786-0和ACHN)的20只裸鼠均安全度过手术期。自原位接种日起连续观察6周,786-0原位注射组在建模后第2周有1只裸鼠死亡,其余9只裸鼠成瘤率为33%(3/9);ACHN原位注射组裸鼠成瘤率为80%(8/10)。
2.1.2.2 皮下成瘤后引瘤原代细胞悬液原位注射法
10只裸鼠均安全度过手术期。自原位接种日起连续观察6周,无裸鼠死亡,成瘤率为90%(9/10)。
2.1.2.3 皮下成瘤后引瘤组织块原位移植肾包膜下法
该组裸鼠中有1只在手术后立即死亡,余裸鼠安全度过手术期。自原位接种日起连续观察6周,裸鼠无死亡,成瘤率为100%(9/9)。
2.1.2.4 皮下成瘤后引瘤组织块原位移植肾周筋膜内法
该组裸鼠均安全度过手术期。自原位接种日起连续观察6周,无裸鼠死亡,成瘤率为20%(2/10)。
2.2 体质量变化情况
造模初期,裸鼠体质量随时间呈上升趋势。但随着肾脏原位肿瘤的生长,ACHN组织块肾包膜下包埋组、ACHN原位注射组和ACHN皮下移植瘤引瘤后原位注射组裸鼠的体质量在造模14天后呈下降趋势;786-0原位注射组在造模21天后呈下降趋势。而ACHN组织块肾周筋膜内包埋组裸鼠的体质量未见明显下降(图1)。
2.3 PET/CT观察与评估
建模后第14天,各组PET/CT成像均未见明显18F-FDG异常浓聚影。造模后第21天,ACHN原位注射组、ACHN皮下移植瘤引瘤后原位注射组和ACHN组织块肾包膜下包埋组PET/CT成像可见在右肾出现高于左肾的异常浓聚影。建模后第28天,786-0原位注射组、ACHN原位注射组、ACHN皮下移植瘤引瘤后原位注射组和ACHN组织块肾包膜下包埋组PET/CT成像可见右肾出现高于左肾的异常浓聚影。ACHN组织块肾周筋膜内包埋组PET/CT成像双肾未见明显差异(图2)。

图 1 肾细胞癌原位移植裸鼠模型对裸鼠体质量的影响Fig. 1 The weight of nude mice of RCC orthotopic models
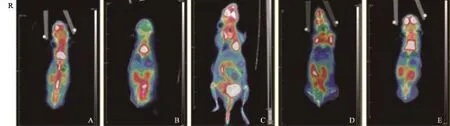
图 2 建模后第28天5组裸鼠的PET/CT成像图Fig. 2 PET/CT images of mice models at day 28 after orthotopic implantation
2.4 裸鼠肾脏解剖结果
建模后第14天,解剖裸鼠后发现ACHN原位注射组、ACHN皮下移植瘤引瘤后原代细胞悬液原位注射组和ACHN组织块肾包膜下包埋组的右侧肾脏出现肉眼可见的肿瘤结节、质韧、色白、边缘不规则,左侧肾脏未见明显异常。786-0原位注射组和ACHN组织块肾周筋膜内包埋组的右侧肾脏未见明显结节,与左侧肾脏无肉眼可见差异。5组裸鼠的小肠、肝脏、肺等无明显肉眼可见转移灶。建模后第21、28天(图3),除ACHN组织块肾周筋膜内包埋组外,其余实验组裸鼠的右侧肾脏均可见色白、边缘不规则的肿瘤灶,左侧肾脏并未见明显异常,裸鼠的小肠、肝脏、肺等无明显肉眼可见转移灶。肾癌细胞系细胞悬液原位注射组中,ACHN细胞系较786-0细胞系成瘤时间更短,成瘤效果较好。

图 3 建模后第28天5组裸鼠模型的肾脏解剖图Fig. 3 Photographs of the resected kidneys of mice models at day 28 after orthotopic implantation
2.5 组织学检测
2.5.1 H-E染色检测
建模后,从第14天起,每周每组随机选取1只裸鼠,剥离其心、肝、脾、肺和肾等主要器官,样本石蜡包埋切片行H-E染色。建模后第14天,光镜下可见ACHN原位注射组、ACHN皮下移植瘤引瘤后原位注射组和ACHN组织块肾包膜下包埋组右侧肾脏组织出现癌症病灶,其余两组左右侧肾脏未见明显差异。建模后第28天,786-0原位注射组、ACHN原位注射组、ACHN皮下移植瘤引瘤后原位注射组和ACHN组织块肾包膜下包埋组右侧肾脏组织均出现异常癌症病灶。癌细胞体积较大,形态不规则,胞质透明。细胞核染色质多呈粗颗粒状,形态不一,可见病理性核分裂象。ACHN组织块肾周筋膜内包埋组右侧肾脏组织在建模后第14、21和28天均未见癌症病灶。786-0原位注射组、ACHN组织块肾包膜下包埋组的部分小鼠肝脏可见肝细胞坏死、大量炎症细胞浸润。其余各组裸鼠的肝脏、肺、脾脏、心脏组织未见明显转移性肿瘤灶及炎性坏死灶(图4)。
2.5.2 免疫组织化学检测
从建模后第14天起,每周每组随机选取1只裸鼠,解剖其心、肝、脾、肺和肾等器官做石蜡包埋切片,行Vimentin、CK8染色。结果显示,建模后第14天,除ACHN组织块肾包膜下包埋组外,余各组右肾与左肾无明显差异,呈Vimentin(-)和CK8(-);建模后第21天,仅ACHN原位注射组、ACHN皮下移植瘤引瘤后原位注射组和ACHN组织块肾包膜下包埋组右侧肾脏组织呈Vimentin(+)和CK8(+),3组裸鼠左侧肾脏Vimentin和CK8染色均为阴性表达;建模后第28天,除ACHN组织块肾周筋膜内包埋组外,其余各组裸鼠右侧肾脏组织呈Vimentin(+)和CK8(+),左侧肾脏组织呈Vimentin(-)和CK8(-)(图5)。
2.6 血清学检测
血清生化检测结果示建模后第21天,ACHN组织块肾包膜下包埋组谷丙转氨酶和谷草转氨酶异常升高,与正常裸鼠相比差异均有统计学意义(P<0.05);786-0原位注射组谷草转氨酶异常,与正常裸鼠相比差异有统计学意义(P<0.05)。建模后28天,786-0原位注射组、ACHN组织块肾包膜下包埋组的谷草转氨酶异常升高,ACHN组织块肾包膜下包埋组的谷丙转氨酶异常升高,与正常裸鼠相比差异有统计学意义(P<0.05),其余3组裸鼠的谷丙转氨酶和谷草转氨酶未见异常增高。5组裸鼠的肌酐、尿素氮、尿酸、总蛋白、白蛋白、球蛋白和总胆红素未见明显异常(图6)。

图 4 建模后第28天5组裸鼠模型的肾脏、肝脏、肺、脾脏和心脏Fig. 4 H-E staining of the resected kidneys, liver, lung, spleen and heart of mice models at day 28 after orthotopic implantation
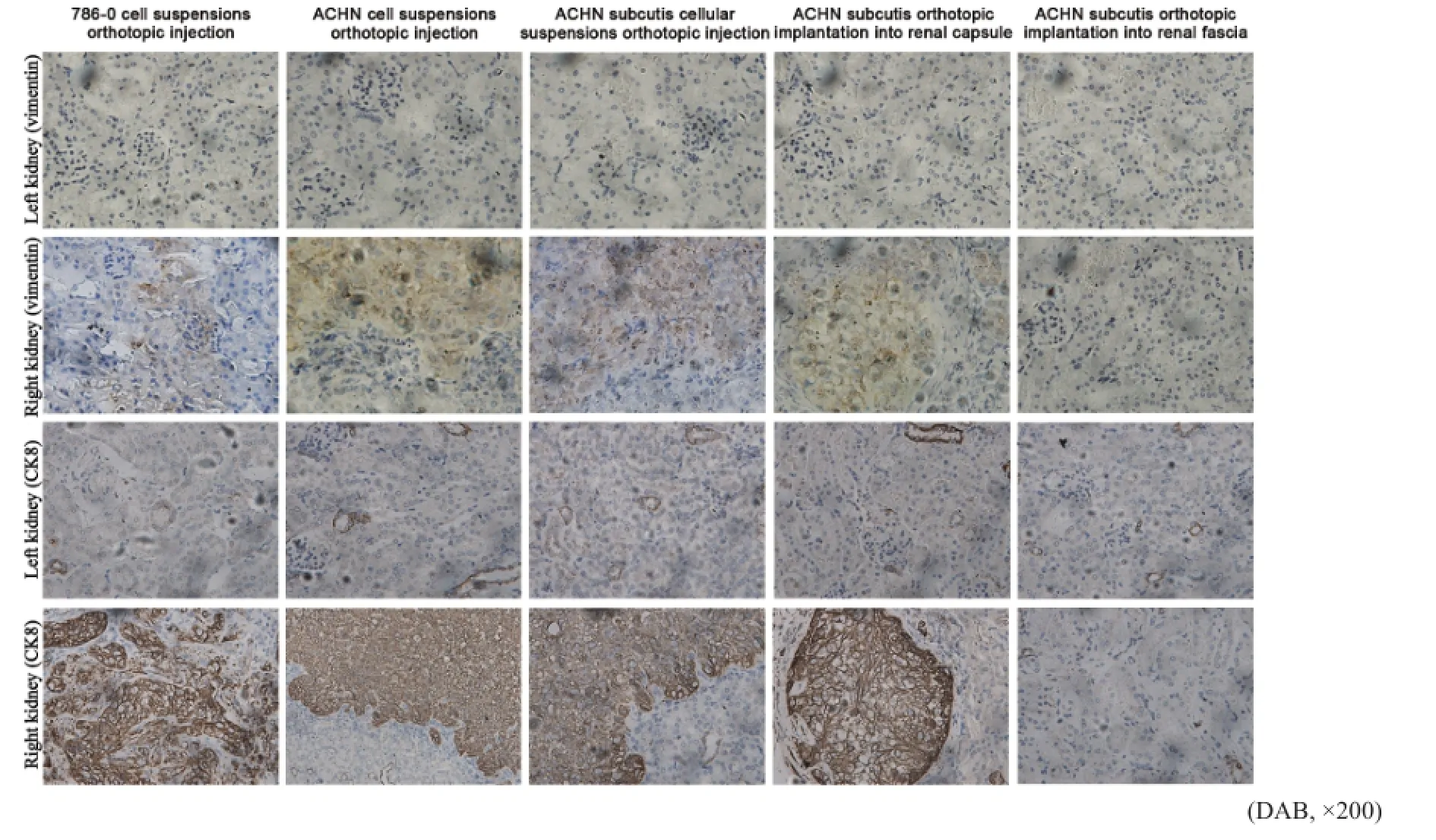
图 5 建模后第28天5组裸鼠模型双侧肾脏的免疫组织化学染色Fig. 5 Immunohistochemistry of the resected kidneys of mice models at day 28 after orthotopic implantation

图 6 建模后第0、14、21和28天5组裸鼠模型的血液生化指标Fig. 6 Blood biochemistry analysis of mice models at different time points of 0, 14, 21 and 28 days
3 讨 论
肾细胞癌为泌尿系统常见的恶性肿瘤之一,其发病率和死亡率以每十年2%~3%的概率增长,加之其起病隐匿,恶性程度高,约50%的患者在首诊、手术切除后发生转移[14]。因此,深入研究肾细胞癌的发病机制,开发有效的临床治疗方法迫在眉睫,而建立良好的动物模型是进行这些研究的基础和保障。
肿瘤动物模型建立的成功与否,主要取决于建模所用细胞系的侵袭性及所采用的建模方法。常用的肾癌细胞系包括:786-0细胞系[3,15]、ACHN细胞系[5,16]和RENCA细胞系[17]等,在本研究中,我们采用了786-0细胞系和ACHN细胞系。786-0细胞系来源于一个原发性透明细胞癌患者,而ACHN细胞系源自一肾腺癌伴癌性胸水患者,其恶性程度更高,具有更强侵袭性。实验结果也显示,ACHN细胞的皮下成瘤率远高于786-0细胞。
与常用的皮下移植瘤模型相比,原位移植瘤模型能更好的模拟肿瘤体内生长尤其是转移情况,实际应用价值更高。目前在结直肠癌等肿瘤的研究中,已经开始使用原位移植动物模型进行癌症发病机制和治疗方法的研究。在肾癌研究中,谭晓洁等[18]利用手术切除的患者肿瘤组织块,进行了人肾细胞癌原位移植裸鼠模型的构建。本研究综合前期研究结果,对已有建模方法进行总结和改进,建立了4种人肾细胞癌原位移植裸鼠模型。成瘤率由高到低依次为皮下成瘤后引瘤组织块原位移植肾包膜下法、皮下成瘤后引瘤原代细胞悬液原位注射法、ACHN原位注射法、786-0原位注射法和皮下成瘤后引瘤组织块原位移植肾周筋膜内法。肾癌组织块移植由于保留了肾癌组织的完整结构,使其中生长因子、血管生成因子及各种刺激因子得以保留,所以其成瘤效果最好。而原位注射法所用细胞在收集时经历的胰酶消化可能对细胞有一定损伤,分散后的细胞丢失了细胞间质中的生长因子等活性物质,同时原位注射细胞悬液易发生漏出,这些均影响了该法的建模效果[19]。皮下成瘤后引瘤组织块原位移植肾周筋膜内法成瘤效果最差,分析其原因可能是由于肾周筋膜内法是将肿瘤组织块置于肾周脂肪层和肾筋膜之间,与肾包膜下包埋法相比,组织块距离肾实质更远,肿瘤细胞更难侵入正常组织;同时,肾周脂肪层较疏松,对肾癌组织块的固定性较差。
影像学检查是肿瘤诊断的重要手段,其中PET/CT由于其高特异性及高敏感性越来越多被用于临床诊断。与正常组织相比,肿瘤组织的糖酵解明显增加,显像剂18F-FDG摄取增加,成像时呈现异常浓聚影。本研究各实验组中,成瘤肾脏均出现明显异常浓聚影。而裸鼠脑部、脊柱旁侧也出现了异常浓聚影,这与检查时环境温度较低、棕色脂肪代谢增多有关。此外,由于18F-FDG是经过泌尿系统排泄,膀胱、输尿管处也表现轻微异常聚影[20]。
影像学、组织学及血液学检查结果表明,2种人肾癌细胞系,无论是皮下成瘤还是细胞悬液原位注射成瘤,ACHN细胞系从成瘤率、成瘤效果来看,均优于786-0细胞系。同时,本研究中的4种原位建模方法中以皮下成瘤后引瘤组织块原位移植肾包膜下法的成瘤率高、成瘤效果最好,这为进一步研究人肾细胞癌的发病机制及有效治疗方法提供良好的动物模型。
[1] BLEUMER I, OOSTERWIJK E, DE MULDER P, et al. Immunotherapy for renal cell carcinoma[J]. Eur Urol, 2003, 44(1): 65-75.
[2] GUPTA K, MILLER J D, LI J Z, et al. Epidemiologic and socioeconomic burden of metastatic renal cell carcinoma (mRCC): a literature review[J]. Cancer Treat Rev, 2008, 34(3): 193-205.
[3] WANG Q, WANG S, SUN S Q, et al. The effects of RNA interference mediated VEGF gene silencing on biological behavior of renal cell carcinoma and transplanted renal tumor in nude mice[J]. Cancer Biomark, 2016, 16(1): 1-9.
[4] XU L, TONG R, COCHRAN D M, et al. Blocking plateletderived growth factor-D/platelet-derived growth factor receptor β signaling inhibits human renal cell carcinoma progression in an orthotopic mouse model[J]. Cancer Res, 2005, 65(13): 5711-5719.
[5] GUO K, HUANG P, XU N J, et al. A combination of YM-155, a small molecule survivin inhibitor, and IL-2 potently suppresses renal cell carcinoma in murine model [J]. Oncotarget, 2015, 6(25): 21137-21147.
[6] KUDO-SAITO C, WANSLEY E K, GRUYS M E, et al. Combination therapy of an orthotopic renal cell carcinoma model using intratumoral vector-mediated costimulation and systemic interleukin-2 [J]. Clin Cancer Res, 2007, 13(6): 1936-1946.
[7] 陈 凡, 刘光香, 纪长威, 等. 兔VX-2原位肾癌模型的建立[J]. 中华实验外科杂志, 2011, 28(4): 634-636.
[8] KANG D E, WHITE R L Jr, ZUGER J H, et al. Clinical use of fluorodeoxyglucose18F positron emission tomography for detection of renal cell carcinoma [J]. J Urol, 2004, 171(5): 1806-1909.
[9] 林乐军, 谭贵萍, 李善春, 等. PET/CT联合MRI在肾细胞癌诊断中的临床价值[J]. 滨州医学院学报, 2012, 35(1): 44-45, 54.
[10] STEINERT P M, ROOP D R. Molecular and cellular biology of intermediate filaments [J]. Annu Rev Biochem, 1988, 57: 593-625.
[11] SKINNIDER B F, FOLPE A L, HENNIGAR R A, et al. Distribution of cytokeratins and vimentin in adult renal neoplasms and normal renal tissue: potential utility of a cytokeratin antibody panel in the differential diagnosis of renal tumors [J]. Am J Surg Pathol, 2005, 29(6): 747-754.
[12] WALDHERR R, SCHWECHHEIMER K. Co-expression of cytokeratin and vimentin intermediate-sized filaments in renal cell carcinomas. Comparative study of the intermediatesized filament distribution in renal cell carcinomas and normal human kidney [J]. Virchows Arch A Pathol Anat Histopathol, 1985, 408(1): 15-27.
[13] 刘小珍, 郑智国, 凌志强. 肿瘤细胞原代培养与保存[J].中国肿瘤, 2015, 24(4): 276-283.
[14] CHIONG E, TAY M H, TAN M H, et al. Management of kidney cancer in Asia: resource-stratified guidelines from the Asian Oncology Summit 2012[J]. Lancet Oncol, 2012, 13(11): e482-e491.
[15] KOBAYASHI M, MORITA T, CHUN N A, et al. Effect of host immunity on metastatic potential in renal cell carcinoma: the assessment of optimal in vivo models to study metastatic behavior of renal cancer cells[J]. Tumour Biol, 2012, 33(2): 551-559.
[16] 王 江, 陈安民, 郭风劲, 等. 人ACHN肾癌裸鼠荷瘤模型建立及相关特性研究[J]. 肿瘤学杂志, 2008, 14(6): 466-469.
[17] WYSOCKI P J, KAZIMIERCZAK U, SUCHORSKA W, et al. Gene-modified tumor vaccine secreting a designer cytokine hyper-interleukin-6 is an effective therapy in mice bearing orthotopic renal cell cancer[J]. Cancer Gene Ther, 2010, 17(7): 465-475.
[18] 谭晓洁, 侯建国, 贺松琴, 等. 人肾细胞癌原位移植裸鼠模型的建立及转移相关基因表达分析[J]. 第二军医大学学报, 2006, 27(3): 263-267.
[19] AN Z, JIANG P, WANG X, et al. Development of a high metastatic orthotopic model of human renal cell carcinoma in nude mice: benefits of fragment implantation compared to cell-suspension injection [J]. Clin Exp Metastasis, 1999, 17(3): 265-270.
[20] 许长磊, 尹吉林, 王欣璐.18F-FDG 与11C-乙酸盐 PET 及PET/CT显像在肾癌诊断中的应用[J]. 华南国防医学杂志, 2013, 27(6): 440-443.
A comparative study of four methods of establishing orthotopic human renal cell carcinoma models in nude mice
ZHAO Peipei1,2, CHEN Xiaojing2, WANG Qiaoling1,2, ZHAO Xue2, ZHAO Yanan2, LIU Peifeng2, DAI Huili1,2(1. Department of Nephrology, Renji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China; 2. Department of Central Laboratory, Renji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China)
DAI Huili E-mail: dhl_sh@163.com
Background and purpose: Renal cell carcinoma is the most common form of kidney cancer, characterized by lack of early symptoms and high malignancy. This study aimed to establish orthotopic nude mice models of human renal cell carcinoma with high success rate and good repeatability. Methods: The four types of methods which were adopted to establish the orthotopic models of renal cell carcinoma were orthotopic injection of 786-0 and ACHN cell suspensions, orthotopic injection of primary cell suspensions obtained from the subcutaneous tumor tissues, renal subcutis orthotopic implantation into renal capsule and surgical subcutis orthotopic implantation into renal fascia. To gain insights into the tumorigenicity and the growth of transplantation tumors, the imageological examination (PET/CT), histological examination (H-E staining, immunohistochemistry staining) and biochemical analysis of blood were carried out. Results: In terms of the subcutaneous transplantation of human renal cell carcinoma models in nude mice, tumorigenic rate of ACHN cells (90%) was higher than that of 786-0 cells (30%). The tumorigenic incidences of 786-0 cell suspensions orthotopic injection, ACHN cell suspensions orthotopic injection, ACHN subcutis cellular suspensions orthotopic injection, ACHN subcutis orthotopic implantation into renal capsule and renal fascia were 33%, 80%, 90%, 100% and 20%, respectively. ACHN subcutis orthotopic implantation into renal capsule was the mosteffective approach. Imageological and histological results accorded with poorly differentiated renal cell carcinoma. Conclusion: Four orthotopic nude mice models of human renal cell carcinoma were successfully established. Among these methods, ACHN subcutis orthotopic implantation into renal capsule is the most effective approach, which provides an ideal model for the research on biological behavior of human renal cell carcinoma and its treatment.
Renal cell carcinoma; Nude mice; Orthotopic transplantation; PET/CT; ACHN cells
10.19401/j.cnki.1007-3639.2017.03.003
R737.11
A
1007-3639(2017)03-0177-09
2016-09-01
2016-12-30)
上海市科学技术委员会科研计划项目(15140902700)。
戴慧莉 E-mail: dhl_sh@163.com

