离子液体提取医药级磷脂酰胆碱的研究
张康逸,宋范范,高玲玲,何梦影
(河南省农业科学院 农副产品加工研究中心,河南郑州 450002)
离子液体提取医药级磷脂酰胆碱的研究
张康逸,宋范范*,高玲玲,何梦影
(河南省农业科学院 农副产品加工研究中心,河南郑州 450002)
以大豆粉末磷脂为原料,采用混合溶剂萃取技术,研究了医药级磷脂酰胆碱的制备方法。首先通过单因素实验考察了混合溶剂1-乙基-3-甲基咪唑六氟磷酸盐([Emim]PF6)-甲醇的溶剂比、料液比、萃取温度、萃取时间等因素对提取效果的影响,并在此基础上进行优化。响应面结果表明:萃取时间60.12 min,[Emim]PF6-甲醇混合溶剂比2.95∶1(v/v),料液比1∶7.50(g/mL),萃取温度30.53 ℃,磷脂酰胆碱的纯度为87.65%,提取率为70.76%。再将磷脂酰胆碱经过氧化铝色谱柱纯化,最终产品的纯度可达98.85%。
大豆粉末磷脂,磷脂酰胆碱,离子液体
磷脂酰胆碱(phosphatidylcholine,PC)的应用范围非常广泛,被应用于食品、医药[1-2]、保健[3-4]、化妆品、饲料等领域。能够抑制乙醇引起的肝纤维化和肝硬化,有效防止肝脏病变[5-7],能使血浆中胆固醇水平有效降低,预防心血管疾病[8],提高大脑活性[9],增强记忆力[10-11]。高纯度的PC是医药工业中优质乳化剂和制备脂质体的关键基础原料,近几年来国内外对医药级PC的市场需求也逐渐增多。
国内关于医药级PC的制备研究较少,医药级PC的生产标准仍未出台,但在进口药品注册标准中明确规定了PC的限度为72%~85%。尽管国内有少数企业和研究机构在医药级PC制备方面进行了研究和开发,但其质量一直不合格,故我国的医药级PC仍然需要进口。目前,PC的提纯方法主要包括溶剂萃取法[12-13],低温冷冻法[14-15],超临界CO2萃取法[16-17],柱层析法[18-19]以及高效液相色谱法[20]等。溶剂萃取法操作工艺简便,但可能会涉及到毒性溶剂及环境问题。然而,单纯一种溶剂在萃取过程中往往会存在局限性,复配的混合溶剂会呈现单一溶剂所不能呈现的优点,代玲莉[21]研究了单一溶剂和混合溶剂对PC的提取率和选择性的影响,结果表明,混合溶剂的综合性能大大优于单一溶剂。低温冷冻法利用溶解度的差异对原料进行萃取后再进行冷冻纯化,虽然步骤比较简化,但产品的纯度和回收率不高。超临界萃取法也存在纯度低、收率低及设备投资大的问题,柱层析法和高效液相色谱法制备的产品虽然纯度相对较高,但溶剂的损耗过大,且存在环境污染的潜在问题。
目前溶剂法制备PC多采用乙醇多次萃取法,但是乙醇对PC的选择性不好,在溶解PC的同时也会溶解其他一些磷脂成分。Tremblay等人[22]研究发现在低浓度下乙腈对PC具有非常高的选择性。离子液体作为新型溶剂,与传统溶剂相比具有选择性高、溶解能力强、结构可设计、无毒等多种优点[23],已被用于很多萃取工艺和催化反应中[24-25]。本研究采用离子液体(1-乙基-3-甲基咪唑六氟磷酸盐,简称[Emim]PF6)和甲醇的混合溶剂为萃取剂,考察了[Emim]PF6-甲醇溶剂比、料液比、萃取温度、萃取时间等因素对提取效果的影响,并结合响应面实验设计软件对萃取条件进行优化,以期为PC的纯化工艺提供一种新思路。
1 材料与方法
1.1 材料与仪器
大豆粉末磷脂(纯度≥96%,PC30%、磷脂酰乙醇胺25%、磷脂酰肌醇25%、溶血磷脂酰乙醇胺0.5%) 河南新百维食品科技有限公司;甲醇(分析纯)、乙醇(分析纯) 烟台双双化工有限公司;1-乙基-3-甲基咪唑六氟磷酸盐(分析纯) 上海成捷化学有限公司;正己烷(分析纯) 烟台双双化工有限公司;甲醇(色谱纯) 美国honeywell公司;Al2O3(100~200目) 上海五四化学试剂有限公司;PC(99%)标准品 Sigma公司(St. Louis,MO,USA)。
1260 型高效液相色谱仪 安捷伦科技有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;202-00A台式电热恒温干燥箱 中国天津泰斯特仪器有限公司;JW-1042低速离心机 安徽嘉文仪器装备有限公司;FD-100S真空冷冻干燥机 北京惠诚佳仪科技有限公司;层析柱(Φ15 mm×50 cm) 郑州兴华玻璃仪器厂。
1.2 实验方法
1.2.1 色谱条件 色谱柱型号:Agilent ZORBAX RX-SIL(4.6×250 mm,5 μm);柱温:35 ℃;流速:1.0 mL/min;流动相:A:甲醇,B:甲醇∶水(8∶1,V/V);进样量5 μL。流动相:溶剂A(甲醇∶水=8∶1,V/V),溶剂B(甲醇),流速1.0 mL/min;洗脱梯度:0~10.0 min,60%~40% A;10.0~20.0 min,40% A;20.0~20.1 min,40%~60% A;20.1~25 min,60% A[26]。
1.2.2 PC标准曲线的绘制 将PC标准品配成1、1.5、2、2.5、3、3.5 mg/mL不同浓度标准溶液,用HPLC-ELSD测定峰面积,以峰面积对浓度做标准曲线。得出回归方程,由回归方程计算出PC纯度为:Y(%)=C×V×D×100/M。
式中,Y为纯度,%;C为待测溶液中PC的浓度,mg/mL;V为待测溶液的体积,mL;D为稀释倍数;M为样品质量,g。
1.2.3 PC提取方法 取5.0 g粉末磷脂置于圆底烧瓶中,加入25 mL混合溶剂,连接冷凝管后置于恒温加热磁力搅拌器下搅拌,萃取温度为30 ℃,提取时间60 min,反应结束后,收集萃取液。向萃取液中加入定量的正己烷进行反萃取,离子液体相处理后可循环利用,通过旋蒸回收溶剂,即得到产物,溶解定容后进行HPLC-ELSD分析,计算PC的提取率。

1.2.4 单因素实验 以大豆粉末磷脂为原料,[Emim]PF6-甲醇混合溶剂为萃取剂。在[Emim]PF6-甲醇混合溶剂比3∶1(V/V),料液比1∶7.5(g/mL),温度30 ℃,提取时间60 min的条件下进行萃取,离心,将上清液旋蒸浓缩。分别考察[Emim]PF6-甲醇混合溶剂比1∶1、2∶1、3∶1、4∶1、5∶1及8∶1(V/V),料液比1∶5、1∶7.5、1∶10、1∶12.5、1∶15(g/mL),温度20、25、30、35、40 ℃,时间10、30、60、110、240 min对分离效果的影响,每组实验重复3次。
1.2.5 响应面实验 采用Design Expert 8.0.6软件进行响应面设计,根据Box-Behnken的中心组合设计原理,以溶剂比、料液比及温度3个因素为自变量,以PC纯度为考察指标来进行响应面优化。溶剂比、料液比及温度3个自变量分别以A、B、C表示,以PC纯度Y作为考察指标,因素及水平见表1。
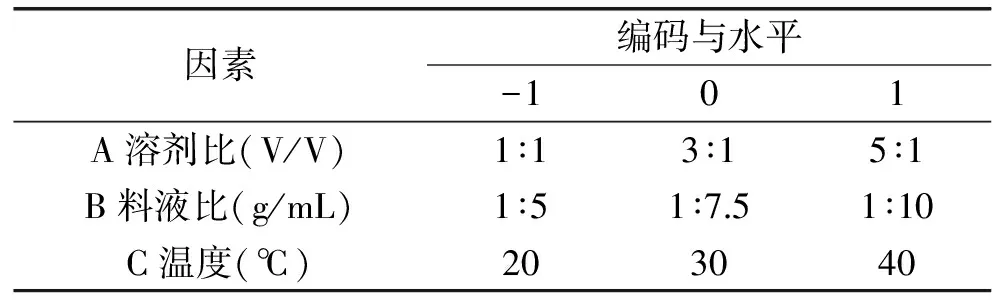
表1 响应面实验因素水平表Table 1 Factors and levels of response surface experimental
1.2.6 层析柱的制备 将活化过的氧化铝加入无水乙醇制成浆状,装柱,洗涤,平衡。
1.2.7 水分测定方法 采用GB 5009.3-2010;过氧化值测定方法采用GB/T 5538-2005。
1.3 数据统计分析
响应面实验结果利用Design Expert 8.0.6软件进行分析,建立回归方程并作等高线和3D曲面图,对因素间的交互作用进行分析和评价,得到最佳工艺组合。其他实验结果用Microsoft Excel进行统计分析。
2 结果与分析
2.1 PC标准曲线的制作
由1.2.2的方法制得的标准曲线方程为Y=12.2819X-5.7906(R2=0.9926),二者呈良好的线性关系(见图1)。
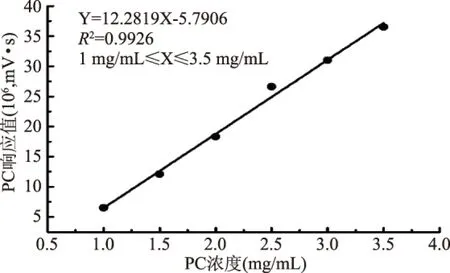
图1 PC标准曲线Fig.1 The standard curve of PC
2.2 PC提取条件的初步选择
2.2.1 溶剂比对PC提取效果的影响 由图2看出,[Emim]PF6-甲醇溶剂比对PC纯度的影响比较大,随着溶剂比的增大,即[Emim]PF6体积分数的增加,PC的纯度逐渐增大,在溶剂比4∶1时纯度达到最大,继续增大溶剂比PC纯度开始下降。由于[Emim]PF6对磷脂中PC的选择性较高,故随着[Emim]PF6体积分数的增加,PC的纯度随之增大,当[Emim]PF6体积分数达到一定程度后,会溶解磷脂中的磷脂酰乙醇胺等其他组分,故纯度逐渐下降。在几种溶剂比下,提取率基本维持在67%~72%左右。故选择4∶1为最佳[Emim]PF6-甲醇溶剂比。
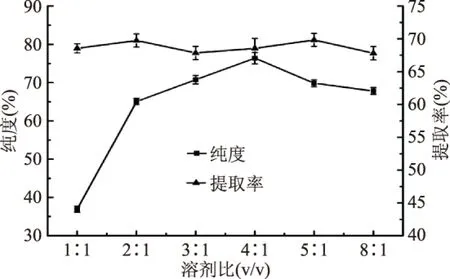
图2 溶剂比对纯度和提取率的影响Fig.2 The influence of solvent ratio on the purity and extracting yield of PC
2.2.2 料液比对PC提取效果的影响 由图3可知,料液比为1∶7.5(g/mL)时的PC纯度达到最大,随着料液比的继续增加,PC纯度逐渐下降,这是因为过多的溶剂会促使粉末磷脂中磷脂酰肌醇和磷脂酰乙醇胺溶解,即会使整个溶剂体系对PC的选择性降低,导致溶剂体系中PC的含量相对下降,故纯度降低。但过量的溶剂会造成资源的浪费,并增加溶剂回收过程中的工作量。因此,在本实验条件下,选择1∶7.5(g/mL)为最佳料液比。
2.2.3 温度对PC提取效果的影响 由图4可知,随着温度的升高,PC的纯度呈先上升后下降的趋势,当温度为30 ℃时,PC的提纯效果达到最好,为85.71%。这是因为温度的适当升高,有助于增加溶质分子的热运动,增大分子的动能,提高分子的传质速率,增加溶质在溶剂中的溶解能力,提高溶解度;但是PC在溶剂中的溶解是一个放热的过程,当温度上升幅度较大时,PC溶解放热成为影响其溶解的主要因素,溶解程度随温度升高而减小,故当温度高于30 ℃时PC纯度逐渐下降。提取率一般会随着温度升高而增加,因为温度升高后分子扩散作用加剧,从而使磷脂能过多溶解在溶剂中,继续升高温度会导致料液间出现汽化层,阻碍分子的扩散[27]。此外,由于[Emim]PF6的黏度较大,甲醇的存在会适当降低体系的黏度,利于传质,温度升高后甲醇挥发,体系粘度增大,分子扩散能力变差,不利于萃取的进行。由于在30 ℃和35 ℃时提取率差别不大,故本实验选择30 ℃为最佳提取温度。
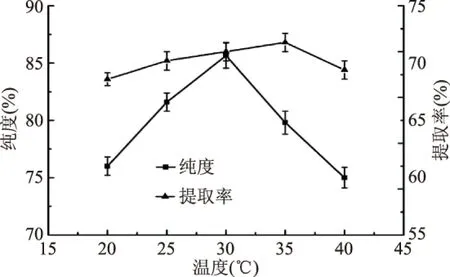
图4 温度对纯度和提取率的影响Fig.4 The influence of temperature on the purity and extracting yield of PC
2.2.4 时间对PC提取效果的影响 溶质在溶剂中充分溶解需要一定的时间,但是随着溶质的溶解,溶剂中溶质的浓度逐渐增大,溶质分子的传质推动力减小,不利于溶质的溶解。由图5可以看出,提取时间为60 min时PC纯度达到最高,随后纯度开始下降。这是因为随着时间的延长,溶剂挥发严重,导致体系黏度增加,不利于PC的溶解,且长时间的萃取会促使部分PC氧化[28-29]。随着提取时间的延长,提取率呈逐渐下降的趋势,这主要是由于溶剂挥发后磷脂在溶剂体系中的溶解程度相对下降。因此,综合纯度和提取率来看,PC的最佳提取时间选择60 min。

图5 时间对纯度和提取率的影响Fig.5 The influence of time on the purity and extracting yield of PC
2.3 响应面设计及结果分析
2.3.1 响应面设计及结果 由于在单因素实验过程中发现各因素水平的变化对提取率的影响并不明显,故响应面实验中只选取PC的纯度为考察指标。由单因素实验结果可知,时间在60~120 min内PC的纯度变化不太明显,故响应面实验以溶剂比、料液比及温度3个因素为自变量来进行设计优化,实验设计及结果见表2。
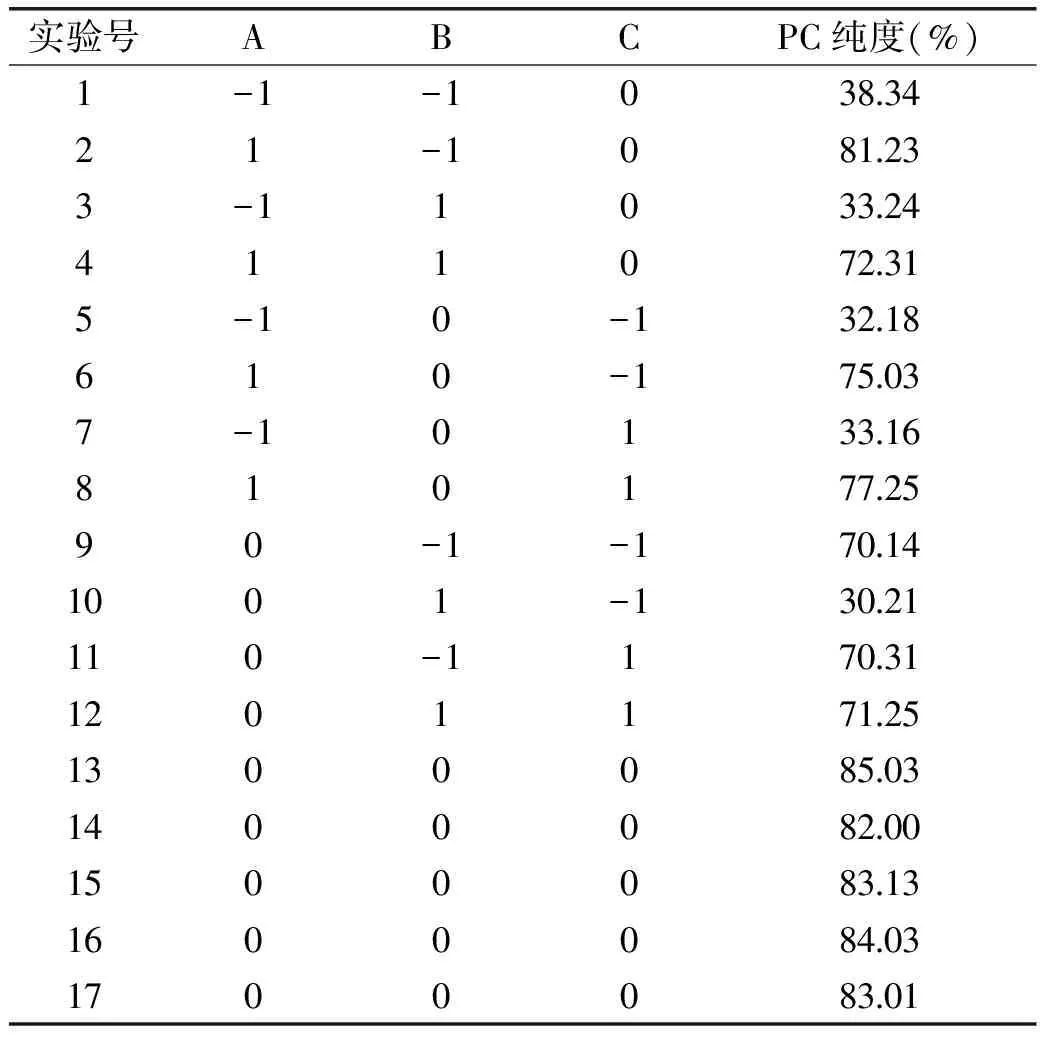
表2 实验设计及结果Table 2 Experimental design and results
2.3.2 数学模拟及方差分析 对表2中响应面实验结果的相关数据进行方差分析和多元回归拟合分析,方差分析及回归系数的显著性分析采用F检验,p-value(Prob>F)判定某模拟项为显著项,方差分析结果见表3,PC纯度对自变量A、B、C的二次多项回归方程式为:
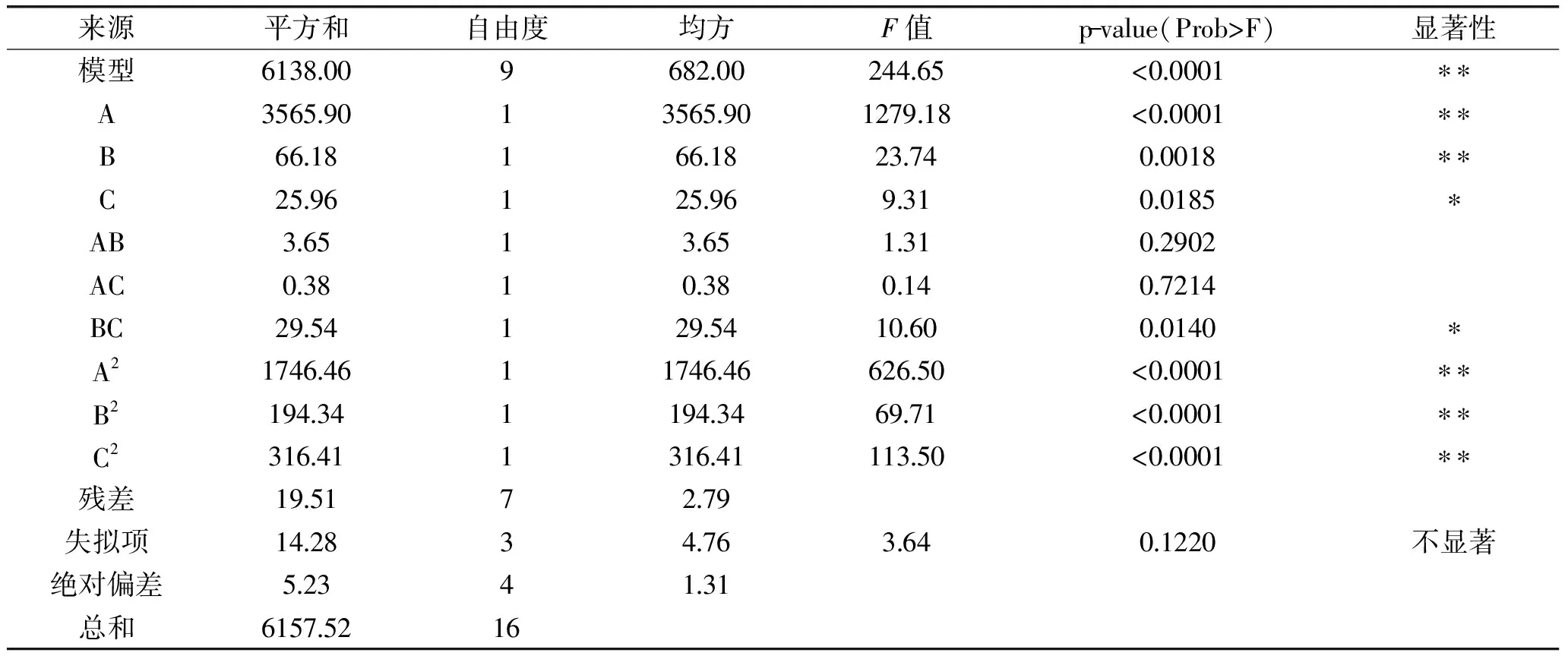
表3 二次模型ANOVA分析表Table 3 ANOVA for quadratic model
Y(%)=83.44+21.11A-2.88B+1.80C-0.96AB+0.31AC+2.72BC-20.37A2-6.79B2-8.67C2
由表3可知,回归模型的显著性水平p<0.0001,说明此模型极显著,失拟项p=0.1220>0.05,影响不显著,回归方程R2=0.9968,表明该模型拟合效果好,可以用该回归方程对实验结果进行分析,并能够对该萃取法制备PC的实际情况进行预测。检验结果表明,溶剂比、料液比、温度的一次项和二次项为显著项,料液比和温度的交互项显著,3个因素对PC纯度影响大小的顺序为:溶剂比>料液比>温度。
各个因素之间的交互作用响应面图如图6所示,溶剂比对PC的影响极其显著,料液比和温度的交互影响显著,表现为曲线比较陡峭。溶剂比与温度、溶剂比与料液比的交互影响不显著,表现为曲线比较平滑。由图6a可以看出,在溶剂比为3∶1~5∶1和料液比1∶6~1∶8时,PC的纯度较高,当料液比一定时,随着溶剂比的增加,PC的纯度出现逐渐增高的趋势,当溶剂比一定时,PC的纯度随料液比的变化趋势不明显,证明溶剂比对PC纯度的影响较大。由图6b可以看出,当溶剂比一定时,温度的变化对PC纯度的影响并不明显,溶剂比对PC纯度的影响要大于温度对PC纯度的影响。由图6c可以看出,当温度一定时,随着料液比的增加,PC纯度出现先增加后减小的趋势,当料液比一定时,随着温度的增加,PC纯度同样出现先增加后减小的趋势,这是因为适宜的温度可以减小体系的黏度,利于PC的萃取,温度过高时,甲醇会有一定程度的挥发,料液比的增加虽会在一定程度对体系进行稀释,但PC的相对浓度会下降,而其他组分会一定程度的溶解进溶剂体系中,这一点在液相色谱图检测结果中得到证实。
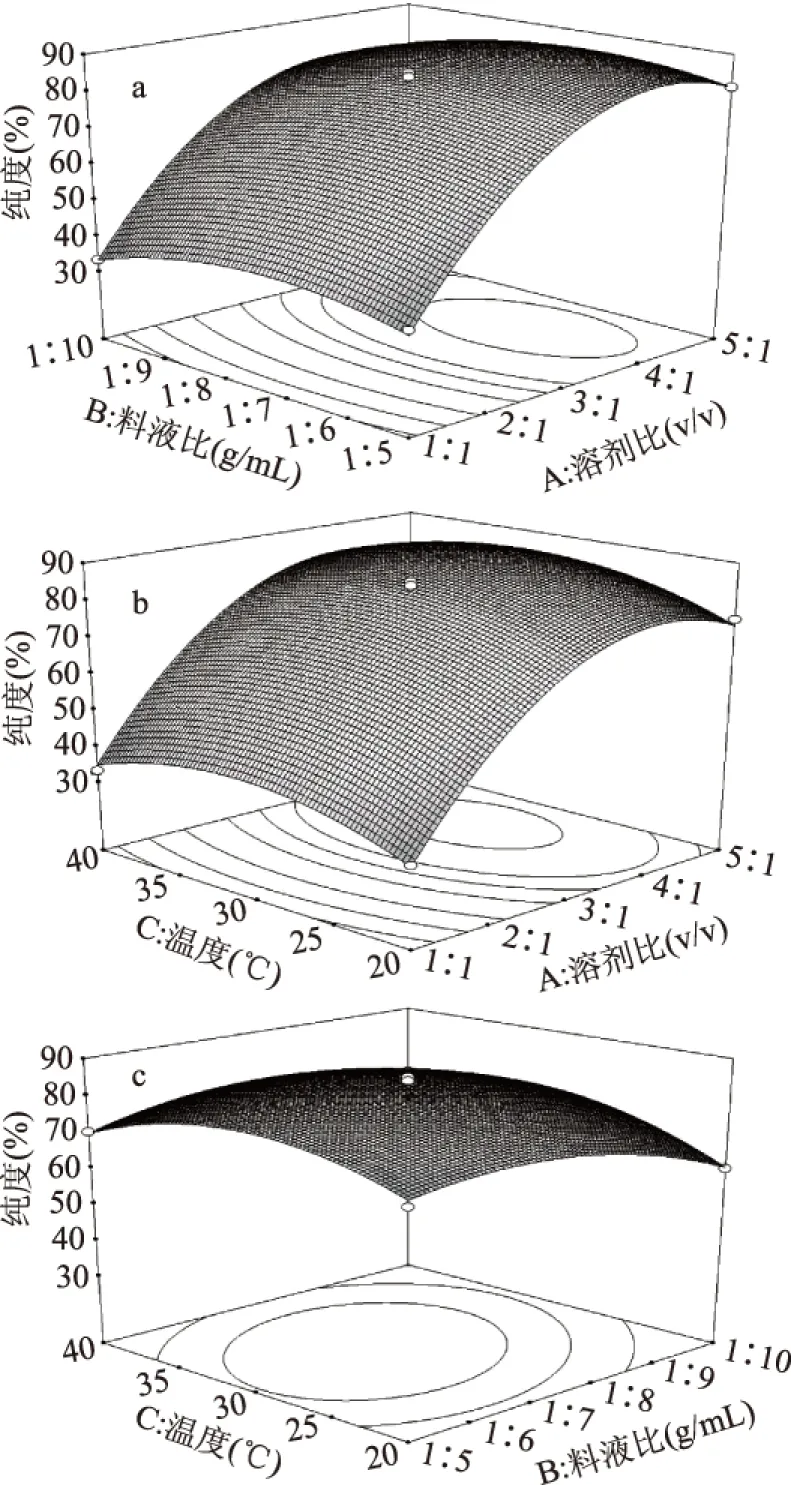
图6 各因素交互作用的响应面图Fig.6 Effect of the interaction between different factors注:a溶剂比和料液比的交互作用,b溶剂比与温度的交互作用,c料液比和温度的交互作用。
2.3.3 模型的验证 根据响应面优化的解决方案中选取的最优反应条件为:萃取时间60.12 min,[Emim]PF6-甲醇混合溶剂比2.95∶1(V/V),料液比1∶7.50(g/mL),萃取温度30.53 ℃。在此最佳反应条件下,经过三次重复验证实验得到PC的纯度为87.65%±2.1%(预测值为89.56%),提取率为70.76%±1.7%。这说明实验结果与模型预测结果具有良好的相关性,因此,该模型可以较成功地预测PC的制备过程。
2.4 PC的柱色谱纯化
将最优方案萃取后的PC用无水乙醇溶解后上氧化铝层析柱,采用无水乙醇做洗脱剂,收集洗脱液并将其真空浓缩、冷冻干燥得到医药级PC产品,最终产品的纯度可达98.85%,回收率为85.23%,水含量为1.91%,过氧化值2.37 mmol/kg,产品的液相色谱图见图7。
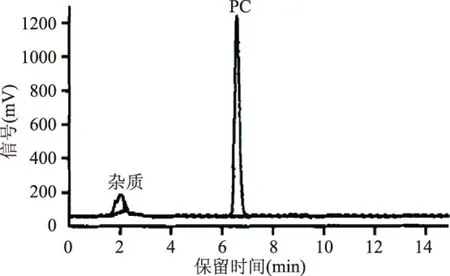
图7 PC纯化后的液相色谱图Fig.7 Chromatograms of purified PC
3 结论
本实验采用[Emim]PF6-甲醇混合溶剂作为萃取剂分离纯化PC,该方法制备的PC纯度比文献中同样采用乙腈-甲醇体系作为萃取剂所得的PC纯度(72.8%)[21],高出约15%,明显优于传统有机溶剂萃取法。经过氧化铝色谱柱纯化后,最终产品的纯度可达98.85%。
此外,本研究引入了新型溶剂离子液体[Emim]PF6代替了有机溶剂,降低了体系的毒性,[Emim]PF6-甲醇体系的分离也更为简单,通过控制温度就可实现甲醇的回收,离子液体经过简单处理后就可以循环使用。根据离子液体可设计的特点,后期将寻找合适的离子液体替代体系中的有机溶剂。
[1]陆文达,郑卫琴,李剑英,等. 注射用富含卵磷脂蛋黄磷脂制备研究[J]. 粮食与油脂,2010(3):39-41.
[2]Chagnon M S. Electromagnetic wave absorbing,surface modified magnetic particles for use in medical applications,and their method of production:US,5441746[P]. 1995-08-15.
[3]胡小中. 磷脂酰胆碱的生理功能和作用机理[J]. 粮油食品科技,2011,19(4):42-44.
[4]Amselem S,Aviv H,Friedman D,et al. Submicron emulsions as vaccine adjuvants:US,WO1995011700[P]. 1995-05-04.
[5]Porta E A. Dietary modulation of oxidative stress in alcoholic liver disease in rats[J]. Journal of Nutrition,1997,127(5):912-915.
[6]Yokoyamah,Ishii H. Recent progression in research on alcoholic liver disease[J]. Nihon Rinsho,1997,55(20):479-490.
[7]Liang H Q,Rye K A,Barter P J. Remodeing of reconstituted high density lipoproteins by lecithin:cholesterol acyltransferase[J]. The Journal of Lipid Research,1996,37(9):1962-1970.
[8]池莉平,谭剑斌,陈瑞仪. 大豆卵磷脂调节血脂作用的动物实验研究[J]. 海峡预防医学杂志,2007,13(2):51-52.
[9]秦晓健,马挺军,贾昌喜. 大豆卵磷脂抗疲劳活性研究[J].中国农学通报,2010,26(12):48-50.
[10]Safford F. Testing the effects of dietary lecithin on memory in the elderly:An example of social work/medical research collaboration[J]. Research on Social Work Practice,1994(4):349.
[11]池莉平,朱展鹰,黄俊明,等. 大豆卵磷脂改善记忆作用动物实验研究[J]. 中国热带医学,2006,6(11):1945-1946.
[12]安红,夏海涛,邓启刚,等. 乳化萃取技术抽提大豆磷脂中的磷脂酰胆碱[J]. 分析化学,2003,31(7):824-827.
[13]刘玉兰,彭茗辉,王飞运,等. 芝麻卵磷脂提取工艺条件研究[J]. 中国油脂,2014,39(8):78-80.
[14]肖文婷,张帆,李燕,等. 低温沉淀法提取高纯度蛋黄卵磷脂的工艺研究[J].食品工业科技,2013,34(15):256-258.
[15]李桂华,王成涛,方芳,等. 乙醇冷冻法纯化大豆磷脂酰胆碱研究[J]. 粮食与油脂,2010(5):17-19.
[16]吕维忠,钟振声,黄少烈. 超临界CO2萃取大豆磷脂的工艺研究[J]. 食品科学,2000,21(3):28-30.
[17]杨文梅,陈学珍,马挺军,等. 超临界CO2萃取法提取大豆卵磷脂的研究[J]. 北京农学院学报,2012,27(1):55-59.
[18]汪燕,刘元法,金青哲,等. 柱层析法制备高纯磷脂酰胆碱[J]. 中国油脂,2007,32(7):60-62.
[19]张牧焓,王道营,卞欢,等. 氧化铝柱层析纯化鸭肝卵磷脂的工艺研究[J]. 南方农业学报,2014,45(6):1054-1059.
[20]董晓渭,冯学伟,李桂贞. 高效液相法测定大豆磷脂中的磷脂酰胆碱[J]. 华东理工大学学报:自然科学版,2006,26(3):315-317.
[21]代玲莉,陈福明. 混合溶剂提取法从粉末磷脂中分离磷脂酰胆碱的研究[J]. 中国油脂,2002,27(5):74-76.
[22]Tremblay P A,Kearns J J. Process for purification ofphospholipids:US,4714571[P].1987-12-22.
[23]侯玉翠,刘克文,杨春梅,等.离子液体和超临界CO2两相体系[J].化学通报·网络版,2005(1).
[24]张之达,陈吉平,李长平,等.离子液体微波辅助萃取川芎中内酯类化合物[J].过程工程学报,2010,10(3):498-502.
[25]李庆龙,曲有乐,欧阳小琨.离子液体微波辅助萃取金银花中绿原酸的研究[J].浙江海洋学院学报(自然科学版),2010,29(1):30-33.
[26]宋范范,张康逸,张薇薇,等. 无水乙醇萃取联合氧化铝柱层析制备高纯磷脂酰胆碱[J]. 食品科学,2015,36(10):6-10.
[27]边晶晶,谢晶,陈舜胜,等. 南美白对虾虾头中磷脂提取工艺的优化[J]. 食品科学,2011,32(24):11-15.
[28]安红,宋伟明,张宏波. 磷脂化学及应用技术[M]. 北京:中国计量出版社,2006.
[29]杨文鸽,娄永江,桑卫国. 正交实验优化马面鲀Navodon septentrionalos卵巢磷脂的提取条件[J]. 浙江海洋学院学报,2001,20(1):35-37.
Study on extraction of pharmaceutical grade phosphatidylcholine by ionic liquid
ZHANG Kang-yi,SONG Fan-fan*,GAO Ling-ling,HE Meng-ying
(Institute of Agricultural Products Processing,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
The phosphatidylcholine was purified from soybean lecithin powder by mixed solvent. The influence factors(mixing solvent ratio of 1-ethyl-3-methylimidazolium hexafluorophosphate([Emim]PF6)and methanol,solid-liquid ratio,extracting temperature and extracting time)of separation were investigated by single factor experiment. The purified phosphatidylcholine products(with purity 87.65% and extracting yield 70.76%)were obtained based on response surface experiment at the conditions as follows:extracting time 60.12 min,mixing solvent ratio of[Emim]PF6and methanol 2.95∶1(v/v),solid-liquid ratio 1∶7.50(g/mL),and extracting temperature 30.53 ℃. The phosphatidylcholine was purified by aluminum column chromatography and the purity of final product was 98.85%.
soybean lecithin powder;phosphatidylcholine;ionic liquid
2016-04-08
张康逸(1981-),男,博士,副研究员,研究方向:脂质化学,E-mail:kangyiz@163.com。
*通讯作者:宋范范(1988-),女,硕士,研究方向:脂质化学,E-mail:495536703@qq.com。
河南省农业科学院科研发展专项资金项目(YCY20167822);河南省农业科学院自主创新基金项目(豫财科【2015】183号)。
TS229
B
1002-0306(2017)07-0235-06
10.13386/j.issn1002-0306.2017.07.038

