药用昆虫金环胡蜂及其混伪品DNA条形码鉴别研究*
许凯歌,陈壮志,杨自忠,郭云胶,李成功,赵昱,张成桂
(1.大理大学云南省昆虫生物医药研发重点实验室大理671000;2.北京华大蛋白质研发中心有限公司北京101318;3.大理大学中国西南药用昆虫及蛛形类资源开发利用2011协同创新中心大理671000;4.大理大学药学与化学学院大理671000;5.德宏师专食用昆虫研究所德宏678400)
药用昆虫金环胡蜂及其混伪品DNA条形码鉴别研究*
许凯歌1,4**,陈壮志1,2,杨自忠1,3,郭云胶3,5,李成功1,3,赵昱1,3,张成桂1,3
(1.大理大学云南省昆虫生物医药研发重点实验室大理671000;2.北京华大蛋白质研发中心有限公司北京101318;3.大理大学中国西南药用昆虫及蛛形类资源开发利用2011协同创新中心大理671000;4.大理大学药学与化学学院大理671000;5.德宏师专食用昆虫研究所德宏678400)
目的:以COI序列作为DNA条形码对药用昆虫金环胡蜂及其混伪品进行物种鉴别,探讨快速、准确鉴别金环胡蜂及其混伪品的方法。方法:以COI条形码序列为基础,对金环胡蜂及其近缘种混伪品黄纹大胡蜂进行总DNA提取、PCR扩增和双向测序,并比对GenBank中金环胡蜂及其混伪品的COI序列,继而用MEGA6.06软件对所有序列进行分析、计算种内及种间遗传距离,并用邻接(Neighbor-Joining,NJ)法构建出系统进化树。结果:金环胡蜂及黄纹大胡蜂COI序列扩增成功。金环胡蜂与其混伪品COI序列种间最小遗传距离为0.152±0.017,远大于金环胡蜂种内的最大遗传距离0.009±0.004。构建出的系统进化树图也明确显示,各物种都形成了独立的分支。结论:基于COI序列的DNA条形码技术可有效鉴别药用昆虫金环胡蜂及其混伪品,为其质量控制和市场监管提供了新的技术手段,保证金环胡蜂相关药材的安全性。
金环胡蜂DNA条形码COI序列物种鉴别
金环胡蜂(Vespa mandarinia Smith)为膜翅目(Hymenoptera)胡蜂科(Vespidae)胡蜂属(Vespa)中体型最大、性情凶猛的捕食性肉食昆虫,俗称“虎头蜂”[1],也称中华大虎头蜂、斑胡蜂、桃胡蜂、人头蜂等。其幼虫、全体、蜂毒及蜂巢均可入药,药材名大黄蜂(全体)、大黄蜂子(幼虫)、露蜂房(蜂巢),主治风湿痹痛,是常见民间中药[2]。金环胡蜂泡酒制成的蜂毒酒能够祛风湿,治急性和慢性风湿痛以及风湿性关节炎,与其幼虫(大黄蜂子)功效相同[3,4],在中国民间有着悠久的使用历史。对胡蜂科昆虫药理活性研究中,发现产自云南省的不同种胡蜂体内能够分泌不同强度的活性多肽,可用于制备防治缺血性心脑血管疾病及由脑梗塞损伤带来的偏瘫后遗症等[5-8]。
胡蜂具有较高的药用及食用价值,但由于缺乏权威、便捷的物种鉴定手段,导致大量混伪品涌入药材市场。入药胡蜂的种类不同,其所含的有效成分和药用功效也会有所不同,因此不宜彼此混淆和替代,而需要给予准确的鉴定和细致的划分。传统的物种鉴定主要依赖于专业的昆虫分类学家花费大量时间和精力整理积累后所描述的形态特征,不仅费时费力,也常受主观因素干扰,极易混淆出错[9]。而且种类相近昆虫的卵、蛹、幼虫、成虫的虫体形态特征差异小,有些特征在不同的发育时期不够稳定,在鉴定分类上增加了难度[10]。另外,传统形态学鉴定是基于物种形态特征的细微差别,如果物种在贮藏、加工炮制的过程中形态被破坏,会大大降低鉴定结果的可信度[11]。金环胡蜂常以幼虫和炮制品入药,药材在加工、贮藏的过程中会造成虫体残破,致使以传统形态学的方法鉴别金环胡蜂及其混伪品面临巨大的挑战,因此需要建立一种更加快速和准确的方法。
近年来,通过测定某一个或几个基因片段的核苷酸序列进行物种鉴定和区分的DNA条形码(DNA barcode)技术得到了迅速的发展和应用[12,13]。2003年,PaulHebert首次提出将一段长度约为650 bp的线粒体细胞色素C氧化酶I(MitochondrialCytochrome Coxidase Subunit I,COI)基因片段作为动物的分子鉴定标记。研究发现利用物种间COI基因序列的变异能够较好地鉴别物种,随后COI基因被公认为动物界中标准的DNA条形码基因[14]。本研究利用COI序列对药用昆虫金环胡蜂及其常见混伪品进行DNA条形码鉴别研究,以期为金环胡蜂药材快速准确鉴定提供分子水平的依据和方法,也为临床用药安全奠定基础。
1 材料与方法
1.1 主要仪器与试药
MyCycler Thermal Cycler型PCR仪(美国BIORAD生命医学产品有限公司,序列号:580BR 12204);DYCP-31DN电泳仪(北京市六一仪器厂,批号:20130816);InGeniusLHR凝胶成像系统(美国基因有限公司,序列号:SYIGLHR/1478);HWS12恒温水浴锅(上海一恒科技有限公司生产,序列号:131022035)。
2×Taq PCR MasterMix(内含0.1U Taq聚合酶,500μmol·L-1脱氧核糖核苷三磷酸(dNTP),20mmol·L-1三羟甲基氨基甲烷-盐酸[Tris-HCl,pH=8.3),100mmol·L-1氯化钾(KCl),3mmol·L-1氯化镁(MgCl2)](北京天根生化科技有限公司,批号:03106);引物LCO1490(由生工生物工程(上海)股份有限公司合成,批号:8400432886);引物HCO2198(由生工生物工程(上海)股份有限公司合成,批号:8405504355);DNAMarker D(100-2 000 bp)(包括100、250、500、750、1 000、2 000 bp的DNA片段,BBI生命科学有限公司生产,批号:B415KAO150);TE缓冲液(北京天根生化科技有限公司,批号:03211)。
1.2 材料
本实验所用金环胡蜂及其混伪品总计4个种21份样品,其中包括12份实验样品和9份GenBank序列,经中国科学院昆明动物研究所董大志教授鉴定,标本均保存于大理大学昆虫生物医药研究院。金环胡蜂及其混伪品详细信息见表1。

表1 实验样品(金环胡蜂及其混伪品)及GenBankk来源序列信息
1.2 方法
1.2.1 总DNA提取方法
从无水乙醇中取出实验样品,每只昆虫均舍弃腹部,取其胸部或头部肌肉组织约0.1 g,并进行唯一性编号。然后,对实验样品的肌肉组织进行总DNA提取,具体步骤如下:
(1)研磨及水浴
将昆虫肌肉组织剪碎,加入480μL的STE溶液(0.05mol·L-1Tris-HCl,pH=7.0-8.0;0.1mol·L-1EDTA,pH=7.0-8.0;0.1mol·L-1NaCl)、60μLSDS(5%)溶液和60μL蛋白酶K溶液(2mg·L-1),用石英杵研磨彻底,放入56℃恒温水浴锅中,消化至混合液变清亮为止。
(2)酚抽提
在混合液中加入500μL平衡酚溶液,上下颠倒10次,10 000 rpm离心10min,取上清液。酚抽提操作两次。
(3)氯仿∶异戊醇(24∶1)抽提
步骤(2)中得到的上清液中加入500μL的氯仿∶异戊醇,上下颠倒10次,10 000 rpm离心10min,取上清液。
(4)沉淀DNA
往步骤(3)中得到的上清液中加入1mL预冷无水乙醇(-20℃)并冻存于-20℃冰箱2 h,12 000 rpm离心10min,弃上清液。
(5)洗涤DNA
用1mL 70%乙醇洗涤步骤(4)得到的沉淀,离心,弃上清液,洗涤两次。
(6)溶解DNA
取80-100μL的TE缓冲液溶解步骤(5)得到的沉淀,然后置于4℃冰箱备用。
1.2.2 PCR扩增及测序
以提取的总DNA为模板,运用COI序列通用引物进行扩增。DNA模板2μL;正向引物为LCO1490:5′-GGTCAACAAATCATAAAGATATTGG-3′,反向引物为HCO2198:5′-TAAACTTCAGGGTGACCAAAAAATCA-3′,各2μL(10μmol·L-1)(上海生工生物工程股份有限公司合成);PCR扩增体系50μL:含有双蒸水(dd H2O)19μL,2·Taq PCRMasterMix25μL(内含0.1U Taq聚合酶,500μmol·L-1脱氧核糖核苷三磷酸(dNTP),20mmol·L-1三羟甲基氨基甲烷-盐酸(Tris-HCl,pH= 8.3),100mmol·L-1氯化钾(KCl),3 mmol·L-1氯化镁(MgCl2)。PCR扩增程序为:首先94℃预变性3.5min;然后94℃变性35 s,49℃退火35 s,72℃延伸45 s,共33个循环;最后72℃延伸5min,置4℃保存。
用凝胶电泳检测PCR扩增产物。琼脂糖凝胶浓度为1.2%,以D2000 DNA Ladder为分子量标记,将扩增出700 bp左右条带的PCR产物寄到测序公司进行双向测序。
1.2.3 数据处理
利用DNAStar软件对测序结果进行序列拼接并辅以手工校对,将引物序列去除,然后在NCBI(National Center for Biotechnology Information)库中以BLAST(Basic Local Alignment Search Tool)法进行相似性搜索,确保得到的COI序列是本研究的目的序列。最后,将所有序列用软件MEGA(Molecular Evolutionary Genetics Analysis)6.06比对,分析其特异性位点并基于K2P模型进行遗传距离分析。同时,用邻接法(Neighbor-Joining,NJ)构建系统进化树,利用Bootstrap(1 000次重复)检验各分支的支持率。
2 结果与分析
2.1 药用昆虫金环胡蜂DNA提取与PCR扩增
实验结果表明,金环胡蜂、黄纹大胡蜂的COI基因片段都可用通用引物扩增出来。PCR产物可以用来测序,测序成功率为100%。
2.2 COI序列特征分析
将所有序列输入MEGA6.06软件中的Align by ClustalW进行多重比对,去除冗余位点,最终得到长度为633-660 bp的COI序列,序列中GC含量(碱基G和C含量的总和)的范围为29.4%-31.9%,平均含量仅为30.9%,明显小于序列中AT含量(碱基A和T含量的总和)的平均值,存在明显的A、T偏向性(表2)。所有样品COI序列中含有保守位点254,变异位点428,自裔位点23,简约信息位点405,分别占整个序列的37.24%、62.76%、3.7%、64.49%(表3)。另外,COI序列的碱基转换与颠换比值R的平均值为1.016±0.371,大于Holmquist[15]认为的临界值(约为0.4),说明基因序列的突变未达到饱和,适用于系统发育分析。

表2 金环胡蜂及其混伪品序列中COI基因片段分析
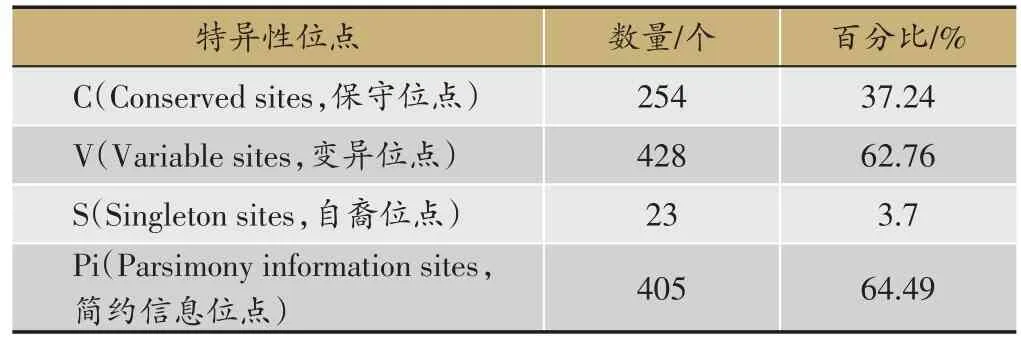
表3 COI序列特异性位点分析
2.3 金环胡蜂及混伪品种内及种间遗传距离分析
基于K2P(Kimura's two Parameter)模型计算金环胡蜂及混伪品种内及种间遗传距离,结果如表4所示。由表4可知,所有胡蜂样品的种内平均距离为0.005±0.002,种内最大距离为0.019±0.006;种间平均距离0.737±0.060,种间最小距离为0.152±0.017。金环胡蜂种内平均距离为0.004±0.002,远小于种间平均距离,种内最大距离0.009±0.004也远小于种间最小距离,说明COI基因作为DNA条形码可以区分金环胡蜂与其混伪品。另外,所有胡蜂样品的种内平均距离远小于种间平均距离;并且所有胡蜂样品的种内最大距离也远小于种间最小距离,说明COI基因作为DNA条形码不仅可以区分金环胡蜂与其混伪品,也能将不同种的混伪品彼此区分开来。

表4 种内与种间遗传距离分析
2.4 邻接法构建系统进化树分析
基于运用K2P模型计算出的遗传距离,通过邻接法(NJ)构建金环胡蜂及其混伪品的系统进化树,同时利用自检举(Bootstrap)1 000次重复检验各分支的支持率,结果见图1。由图1可以看出,8个金环胡蜂样品及4个GenBank登录号样品聚成单系,形成一个独立的分支,三种混伪品胡蜂也各自聚成单系,都形成了独立的分支。由此可以看出,此COI序列作为DNA条形码适用于金环胡蜂及其混伪品的鉴定。
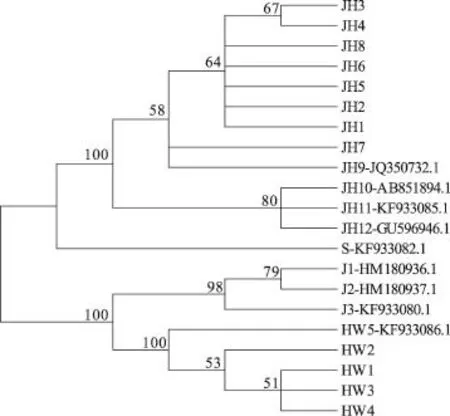
图1 基于COI序列和K2P模型构建的金环胡蜂及其混伪品的系统进化树
3 讨论
3.1 COI序列作为DNA条形码鉴定物种的适用性与局限性
在分子鉴定工作中使用的常见DNA条形码有线粒体基因18S rRNA、16S rRNA、12S rRNA和COI基因等,而COI基因较rRNA基因有许多优点:相对保守性同时有足够的变异,序列长度合适且可以运用通用引物进行扩增[16],近年来在不同的生物类群中应用该基因鉴定的有效性得到了越来越多的验证。另外,由于本研究使用的金环胡蜂、黄纹大胡蜂样品均非新鲜昆虫,提取的总DNA降解严重,但是扩增效果仍是十分稳定并且成功测得序列,其或因COI基因是线粒体DNA,相对于核DNA拷贝数多且基因组片段小,对降解后DNA进行PCR扩增时所受的影响较小。该结果也说明了以线粒体基因COI序列作为DNA条形码标准片段的优越性和适用性。而且,本研究根据COI序列差异得到所有胡蜂样品种内最大距离为0.019± 0.006,明显小于种间最小距离0.152±0.017,种内与种间距离不存在重叠部分,即存在条形码间隙(Barcoding Gap),满足了DNA条形码有效鉴定物种的条件,进而表明了COI序列适用于该物种鉴定的内在特征。同时,由邻接法构建的系统进化树可以看出,COI序列作为DNA条形码能够进行物种水平的分类鉴定。
尽管如此,COI序列作为DNA条形码鉴定物种也存在一定的局限性,例如Spering[17]统计了一系列昆虫COI序列的信息,认为至少有25%的物种不易由DNA条形码方法进行鉴定和区分。另外,COI序列长度仅为650 bp左右,信息位点数目有限,随着分类阶元的升高,序列变异会趋于饱和,碱基的转换颠换比值将小于临界值,此时就不再适用于分子鉴定分析,也即COI序列作为DNA条形码对昆虫属内阶元具有较为准确的鉴定效力,而对昆虫科内及更高阶元的鉴定分析并无太大的参考价值。
3.2 DNA条形码分子鉴定方法的优势与展望
相比于以往的分子生物学鉴定方法,如限制性内切酶片段长度多态性(Restriction Fragment Length Polymorphism,RFLP)、随机扩增多态性DNA标记(Random Amplified Polymorphic DNA,RAPD)、微卫星标记等,DNA条形码技术显示出通用性高、重复性强的明显优势。DNA条形码分子鉴定方法简单、高效、准确性强,使昆虫药材的鉴定过程日趋标准化和系统化,可为保证药用胡蜂金环胡蜂及其它昆虫药材用药安全和市场监管提供新的方法和思路。
截至目前,用于分子鉴定的DNA条形码多为线粒体DNA,鉴定效力较易受到物种间的基因杂交、渗透的影响。另外,DNA条形码数据库虽然在近几年得到迅猛发展,但仍有所欠缺,许多物种仍未能实行序列比对鉴定。本研究中的金环胡蜂DNA条形码基因片段虽然在全球最大的基因网站GenBank上有丰富的记载,但其它胡蜂比如三齿胡蜂、褐胡蜂、拟大胡蜂等几乎没有相关记载。而不同的胡蜂种类,又具有不同的药用功效和活性成分,因此,药用特种昆虫开发国家地方联合工程研究中心在研究了胡蜂药材药理作用及有效部位的同时[5-8],更致力于发挥DNA条形码技术在药材辨伪及物种鉴定方面的作用[18,19],一方面增加核基因分子标记的应用,解决基因杂交、渗透造成鉴定失误的问题,使鉴定结果更加科学合理;另一方面,坚持完善DNA条形码数据库,可以展开国际合作与交流,多边参与,资源共享,以求达到DNA条形码数据库高质量高库容的要求。
1张佑祥,易浪波,李艳丽,等.金环胡蜂食用虫态矿质元素含量分析.湖南农业科学,2012,11:98-100.
2张玉姐.药用胡蜂养殖技术.农村新技术,2006,3:15-16.
3蔡政.药用胡蜂的养殖价值和产品采集.安徽农业,2000,3:31.
4国家药典委员会.中华人民共和国药典(一部).北京:中国医药科技出版社,2010:875.
5肖怀,巫秀美,王斌,等.侧狭腹胡蜂属昆虫蜂毒多肽有效部位及其制备和医药用途.CN 103638060A,2014-03-19.
6杨毅梅,高孟婷,王斌,等.大胡蜂属昆虫中多肽有效部位的制备方法及医药用途.CN 103665136 A,2014-03-26.
7巫秀美,刘正文,刘衡,等.具有抗血栓形成作用的黄胡蜂属昆虫中多肽有效部位.CN 103638059 A,2014-03-19.
8杨永寿,陆丽,王建超,等.异腹胡蜂属昆虫蜂毒多肽有效部位及其抗心脑血栓用途.CN 103665099 A,2014-03-26.
9李青青,段焰青,叶辉,等.一种快速鉴别夜蛾科害虫的分子生物学方法.CN 102373292 A,2012-03-14.
10方义亮,张建庆,高博,等.基于DNA条形码登革热传播媒介白纹伊蚊标准基因及应用.CN 104789666A,2015-07-22.
11李振国,陈艳明,务勇圣.一种水蛭的DNA条形码分子鉴定方法. CN 103898235 A,2014-07-02.
12 Hebert P D,Penton E H,Burns JM,et al.Ten species in one:DNA barcoding reveals cryptic species in the neotropical skipper butterfly Astraptesfulgerator.Pro NatlAcad SciUSA,2004,101(41):14812-14817.
13辛天怡,雷美艳,宋经元.中药材DNA条形码鉴定研究进展.中国现代中药,2015,17(2):170-176.
14 Hebert P D,Ratnasingham S,Dewaard J R.Barcoding animal life:cytochrome c oxidase subunit I divergences among closely related species.Proc Biol Sci,2003,Suppl:S96-S99.
15 HolmquistR.Transitionsand transversions in evolution to understanding. Mol PhylogenetEvol,1983,19(2):134-144.
16肖金花,肖晖,黄大卫.生物分类学的新动向——DNA条形编码.动物学报,2004,50(5):852-855.
17 Sperling F.DNA barcoding:Deus ex Machina.New Biol Survey CAN, 2003,22(2):50-53.
18陈壮志,何苗,张成桂,等.基于COI及Cytb基因的6种蜚蠊分子系统关系.广州化工,2016,44(10):48-51.
19陈壮志,杨志斌,李贵轲,等.基于COI和18SrRNA基因对蜚蠊物种进行分子鉴定.广州化工,2016,44(13):104-107,133.
Identification ofM edicinal Insect Vespamandarinia from ItsAdulterants Using DNA Barcode
Xu Kaige1,4,Chen Zhuangzhi1,2,Yang Zizhong1,3,Guo Yunjiao3,5, LiChenggong1,3,Zhao Yu1,3,Zhang Chenggui1,3
(1.Yunnan ProvincialKey Laboratory ofEntomological BiopharmaceuticalR&D,DaliUniversity,Dali671000,China; 2.Beijing Protein Innovation Company Limited,Beijing 101318,China;3.Yunnan Provincial2011Collaborative Innovation CenterforEntomoceutics,DaliUniversity,Dali671000,China;4.CollegeofPharmacy and Chemistry,Dali University,Dali671000,China;5.InstituteofEdible Insects,Dehong NormalCollege,Dehong 678400,China)
This study aimed at exploring a fastmethod to accurately identify the medicinal insect Vespa mandariniaSmith from its adulterants using DNA barcode and COI sequences.The extracted DNAs from V.mandarinia and its adulterants V.soror were amplified by polymerase chain reaction(PCR)and sequenced bilaterally based on COI barcode sequence investigation.The information of the COI sequencesof V.mandarinia and V.soror were gathered from GenBank. All the sequences were compared and analyzed,and their intraspecific and interspecific genetic distances were calculated using MEGA 6.06.In addition,the phylogenetic treewas established with neighbor-joining(NJ)method.Asa result,the COI sequences of V.mandarinia and V.soror were successfully amplified.Theminimum interspecific distance between V.mandarinia and its adulterants was 0.152±0.017,being considerably larger than themaximal intraspecific distance between V.mandarinia,0.009±0.004.The constructed phylogenetic tree showed an independentbranch for each species.Itwas concluded that the DNA barcode based on COI sequence can efficiently identify V.mandarinia and its adulterants.This study provided an innovative tool for the quality control and market regulation of Chinese materia medica,securing the safemedication of V.mandarinia.
Vespamandarinia,DNA barcoding,COI sequence,species identification
10.11842/wst.2017.02.020
R931.5
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-11-07
修回日期:2016-12-21
*国家自然科学基金委地区基金(81360679):金黄虎头蜂蜂毒抑制类风湿性关节炎炎症和血管生成的作用机制及物质基础研究,负责人:张成桂;云南省科技厅云南省昆虫生物医药研发重点实验室专项经费(2015DG030),负责人:赵昱;云南省教育厅、财政厅2011协同创新中心项目([2012]25),负责人:赵昱。
**通讯作者:张成桂,副教授,硕士生导师,主要研究方向:微生物与生化药学。

