人自体脂肪间充质干细胞治疗骨关节炎的临床研究
韩健,殷振华,李富航,张亚军,陈轲,王炜,董辉辉,刘一海,李永恒,汪玉良
(1.兰州大学第二临床医学院骨科,甘肃 兰州 730030;2.陕西省咸阳市第一人民医院骨一科,陕西 咸阳 712000)
人自体脂肪间充质干细胞治疗骨关节炎的临床研究
韩健1,2,殷振华2,李富航2,张亚军2,陈轲2,王炜2,董辉辉2,刘一海2,李永恒2,汪玉良1*
(1.兰州大学第二临床医学院骨科,甘肃 兰州 730030;2.陕西省咸阳市第一人民医院骨一科,陕西 咸阳 712000)
目的 探讨人自体脂肪间充质干细胞(adipose derived stem cells,ADSCs)复合玻璃酸钠、富血小板血浆(platelet rich plasma,PRP)注射治疗膝关节骨关节炎的安全性和有效性。方法 取人腹部脂肪组织,分离获取ADSCs,经体外培养获得足量的ADSCS,并以流式细胞仪检测其表面标志物,分析成软骨细胞分化能力。选择咸阳市第一人民医院骨科中心门诊30例膝关节轻中度骨关节炎患者,关节腔内注射人ADSCs复合玻璃酸钠、富血小板血浆,评价观察干预前、后的患者是否有不良反应以及膝关节活动度的评分、疼痛视觉模拟评分(visual analogue scale,VAS)、核磁共振下膝关节面。结果 人腹部脂肪组织分离出来的ADSCs均阳性表达CD105、CD29,阴性表达CD45、CD34,体外具有良好的成骨、成脂、成软骨能力;临床治疗干预后患者无不良反应,膝疼痛减轻,关节活动度较前增大,核磁共振可见关节面斑片状影较治疗前显著减少,低信号区显著减少,未见明显关节腔积液,关节面厚度增加。结论 关节腔注射ADSCs复合玻璃酸钠、富血小板血浆治疗骨关节炎能有效改善患者膝关节活动度,减少疼痛,提高生活质量,通过核磁共振发现关节面厚度增加,延缓关节退化。
脂肪间充质干细胞;软骨细胞;OA
骨关节炎(osteoarthritis,OA))是一种退行性关节疾病,又称退行性关节炎或骨关节疾病,是一种中老年人群中的常见病。患者机体软骨组织蜕变中过程,常伴随有免疫反应产生的各种炎症因子。该疾病在软骨组织发生改变后,会导致患者关节疼痛,关节僵硬及功能丧失,严重影响人们的生活质量,并增加了生活负担。研究表明,导致OA发生的因素有很多,包括年龄、职业、生活习惯、四头肌薄弱、关节受力异常及稳定性减弱、肥胖、遗传、外伤、内分泌紊乱、生长因子及免疫因子缺乏等。疾病初期以保守治疗为主,发展后期为关节置换[1]。
随着再生医学技术的发展,细胞工程技术和组织工程技术已经在软骨缺损治疗领域得到10多年安全性和有效性检验,有些已经通过FDA认证,并且已经初步开始商业化,比如美国健赞公司的基质诱导自体软骨细胞移植等[2]。脂肪间充质干细胞(adipose derived stem cells,ADSCs)取材来源方便,且具有多能性,已经得到很多专家的关注[3]。但因体外培养ADSCs涉及到伦理学,因此本试验采用直接提取分离的方法来验证ADSCs治疗OA临床安全性和有效性。在实验室通过对人腹部脂肪进行体外分离培养,诱导成脂、成骨、成软骨以及细胞表面标记鉴定ADSCs,观察其成软骨活性。临床抽取患者腹部脂肪组织,体外分离纯化,复合玻璃酸钠、自体富含血小板血浆(platelet rich plasma,PRP),注射到患者患有OA的关节腔,初步探讨患者自体ADSCs治疗OA的安全性和有效性。
1 资料与方法
1.1 材料
1.1.1 本试验所用脂肪组织取自于人体腹部脂肪(患者来自咸阳市第一人民医院),均取得知情同意。胎牛血清(fetal bovine serum,FBS)(杭州四季青),四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)(南京建成),达尔伯克必需基本培养基(dulbecco minimumessential medium,DMEM)粉剂(GIBCO,美国);I型胶原酶(Sigma,美国);玻璃酸钠(景峰制药)。
1.1.2 临床患者信息 患者为咸阳市第一人民医院骨科中心自2014年8月至2015年8月的门诊患者,膝关节骨关节炎30例,否认高血压、糖尿病、脑梗塞等慢性病,试验前同意参加临床试验并签署书面知情同意书,充分了解试验伦理批件。治疗期间资料均完整。采用自体对照。女性21例,男性9例;年龄为40~65岁,平均约48.4岁;病程2~12年,平均5.6年。此临床试验患者治疗前患者膝关节无有创检查及手术史。
1.1.3 临床患者骨关节炎诊断参考标准 a)发病年龄大于或等于40岁;b)膝关节轻度静息痛,活动后加重;c)晨僵小于30 min;d)关节弹响及关节压痛;e)关节活动度下降;f)X线片示膝关节非对称性间隙变窄,软骨下骨硬化;g)关节肿大。
1.2方法
1.2.1 人腹部ADSCs的分离培养 无菌条件下取人腹部脂肪组织,0.1%I型胶原酶、37℃消化45 min,终止消化,筛网过滤后1 200 rpm离心10 min收集沉淀。DMEM培养液(含10%胎牛血清)重悬细胞,以2×104/cm2密度接种至培养皿中;在条件为37℃、5%CO2的培养箱中培养,48h后首次换液,弃去未贴壁细胞。待细胞生长至80%~90%融合时传代,隔天更换培养液。
1.2.2 ADSCs定向诱导分化
1.2.2.1 成脂肪细胞诱导 a)取第3代的人脂肪间充质干细胞,以4.0×104/mL密度接种于预先放置了细胞爬片的孔板中,继续培养。待细胞爬满玻片后换成脂诱导培养基(高糖DMEM、10%胎牛血清、1 mmol/L地塞米松、10 mg/L胰岛素、50 mmol/L 3-异丁基-1-甲基黄嘌呤(3-Isobutyl-1-methylanxthine,IBMX)、吲哚美辛0.2 mmol/L)。诱导分化2周,每3天换液1次,倒置相差显微镜观察。b)组织学染色检测:取成脂诱导2周后的爬片,10%甲醛溶液固定10 min后水洗,油红O染液染色[4]10~15 min,纯化水清洗后显微镜下观察并拍照。
1.2.2.2 成骨细胞诱导 a)取第3代的人脂肪间充质干细胞,以4.0×104/mL密度接种于预先放置了细胞爬片的孔板中,持续培养。待细胞爬满玻片后用换成骨诱导培养基(达氏修正依氏培养基、10% FBS、地塞米松1 mmol/L、Vc 50 μg/ mL、β-磷酸甘油10 mmol/L)。诱导分化2周,每3天换液1次,倒置相差显微镜观察。b)组织学染色检测:取成骨诱导2周后的爬片,10%甲醛溶液固定10 min后水洗,茜素红染液染色[5]10~15 min,纯化水清洗后显微镜下观察并拍照。
1.2.2.3 成软骨细胞诱导 a)取第3代的人脂肪间充质干细胞,以4.0×104/mL密度接种于预先放置了细胞爬片的孔板中。将分离培养的软骨细胞(第2代)培养上清(2 200 rpm离心)与新鲜DMEM(+10%FBS)1︰1混合成诱导培养液诱导加入诱导分化2周,倒置相差显微镜观察。b)组织学染色检测:10%甲醛溶液固定10 min后水洗,甲苯胺蓝染色10~15 min,纯化水清洗后显微镜下观察并拍照。
1.2.3 患者脂肪组织获取及脂肪间充质干细胞的分离 选择患者腹部脂肪较膨隆处作为供区,采用标准肿胀麻醉法(2%利多卡因15 mL、1︰1 000盐酸肾上腺素1 mL、生理盐水210 mL)。选取长度合适的吸脂针,应用Lipokit技术的振荡注射器负压吸引抽吸脂肪约100 mL。抽脂后采用腹部多头腹带加压包扎。超净台内用PBS缓冲液清洗组织并去除肉眼可见血管组织,眼科剪剪碎后用0.1%Ⅰ型胶原酶37℃振荡消化60 min。终止消化后用200目筛网过滤,去除未消化组织,1 200 rpm离心10 min后收集沉淀,重悬后台酚蓝染色法计数并行活性细胞计数,每例患者留取2×107个细胞备用。
1.2.4 自体PRP制备 采集患者自体静脉血约50 mL,血袋中临时保存标本,采用两次离心法制备PRP,保存备用。
1.2.5 患者ADSCs复合透明质酸钠及PRP注射 将患者自体脂肪间充质干细胞用10% PRP(约7.5 mL)重悬(CaCl2激活),与2.5 mL玻璃酸钠混匀,备用。患者平卧位,膝关节屈曲约45°,保持稳定。皮肤表面消毒后,采用膝关节腔外侧穿刺入路,10 mL注射针头穿刺进入关节腔内,回抽有少量关节液,无回血后注入治疗剂量10 mL,无菌包扎。治疗前1个月及治疗后观察期间均不使用其他任何治疗药物。
1.2.6 观察指标 分别于治疗前及治疗后第1、2、3个月评价以下指标。a)使用视觉模拟评分(visual analogue scale,VAS),记分1~10分;运动性疼痛评估平路行走、上下楼梯以及完全蹲立的疼痛,以此来评价VAS评分。b)关节活动功能。记录膝关节活动时是否伴随弹响、关节僵硬以及关节绞锁,阳性一项记1分。c)膝关节MRI检查。于术前、术后1个月、术后2个月以及术后3个月采用核磁共振仪器行膝关节MRI扫描,使用膝关节线圈,取矢状面,采用脂肪抑制三维稳态自由进动序列观察,512×512矩阵,180 mm视野,1.5 mm层厚,28°翻转角,38 ms重复激发时间,10 ms回波时间,1次激励次数,观察膝关节软骨信号的改变及范围变化,反复多次测量胫骨内侧平台软骨面厚度,取其均值。
1.2.7 疗效评价 临床症状改善率=(治疗前分值-治疗后分值)/治疗前分值×100%。差:疼痛评分减小小于30%或疼痛无改善、关节活动度无改观。一般:疼痛评分减小约30%~50%,关节活动度初步改观。良:疼痛评分减小约50%~80%,关节活动度得到显著改观。优:疼痛评分减小约大于等于80%或完全改观,关节活动度无影响。

2 结 果
2.1 ADSCs形态学观察 细胞接种后24 h开始贴壁,初为小圆形,细胞大小不等。48 h后大部分细胞已贴壁生长,多呈长梭形(见图1)。
2.2 ADSCs定向诱导分化
2.2.1 成脂诱导形态观察及鉴定 细胞于诱导开始后即停止分裂增殖,逐渐由长梭形变为不规则圆形,体积变大,但大小不一。最早于诱导后4 d时可在细胞内看到小脂滴,厚脂滴逐渐增多,可互相融合成较大的脂滴。诱导14 d时细胞分化至高峰,油红O染色即可证实为脂滴(见图2)。
2.2.2 成骨诱导形态观察及鉴定 人脂肪间充质干细胞经成骨诱导培养液培养21 d,细胞形态由梭形改为多角形,细胞呈多层性、重叠排列,其间质内含大量矿盐沉积的钙化结节,茜素红染色可呈现红色(见图3)。
2.2.3 成软骨细胞形态观察及鉴定 单个细胞形态未见明显改变,随着诱导时间延长,在细胞密度较大处细胞群逐渐簇集。诱导7 d后即可在簇集细胞的表面见到淡黄色的物质沉积,后逐渐增多,到14 d时可达高峰。甲苯胺蓝染色后细胞核呈蓝紫色,基质呈蓝色(见图4)。
2.3 ADSCs表面标记物的表达 取扩增培养后第3代ADSCs,胰蛋白酶消化后,PBS清洗2遍,并制备成1.5×106/mL的细胞悬液。经流式细胞仪检测,ADSCs均一地表达CD29、CD105,阳性率分别为91.8%,和97.5%;而CD34、CD45,阳性率分别为1.4%,1.8%(见图5)。
2.4 安全性和有效性评价
2.4.1 VAS疼痛评分及关节功能评价 治疗后疼痛评分较治疗前明显减小,治疗后1个月VAS疼痛评分及关节活动评分较治疗前均未见明显性差异(P>0.05);疼痛评分在治疗后第2个月、第3个月相较于治疗前均差异有统计学意义(P<0.05),关节活动功能评分于治疗后第2月、第3个月均较治疗前有显著性差异(P<0.05,见表1)。本实验30例患者治疗效果:差2例(6.67%),一般4例(13.33%),良6例(20.00%),优18例(60.00%)。全体患者取脂肪处及关节穿刺部位均未见明显出血、细菌感染、局部皮肤过敏等不良反应,2例抽脂后感腹部不适,3d后症状消失,3例自觉穿刺部位稍疼痛,2d后缓解。

表1 治疗前后VAS疼痛评分以及关节活动功能比较±s)
2.4.2 MRI下膝关节软骨面信号及厚度变化 治疗前,于核磁共振序列中关节面体现为中信号强度的斑片状影,环绕胫骨平台及股骨内外髁骨皮质。治疗后1个月可见关节面斑片状影无显著变化,局部可见凹陷形成、信号减低,关节腔可见少量积液;治疗后2个月可见关节面斑片状影相较于治疗前及1个月时减少,低表达信号区较前有所减少,关节腔积液较前有所减少。治疗后3个月关节面斑片状影较治疗前显著减少,大致接近正常,低信号区显著减少,未见明显关节腔积液(见图6),可见胫骨平台轻度水肿,胫骨平台及股骨髁轮廓示厚度大致正常。本试验即观察核磁共振下软骨面的T2值来检测软骨面厚度。治疗前T2值(84.65±1.68),治疗后1个月T2值(79.83±0.85),治疗后2个月T2值(76.79±1.32),治疗后3个月T2值(66.37±1.18)。治疗后3个月T2测量值较治疗前明显减少(P<0.05),差异具有统计学意义。

图1 原代人脂肪间充质干细胞形态学观察×40 图2 诱导成脂细胞油红染色×100

图3 诱导成骨细胞茜素红染色×40 图4 甲苯胺蓝染色结果×40
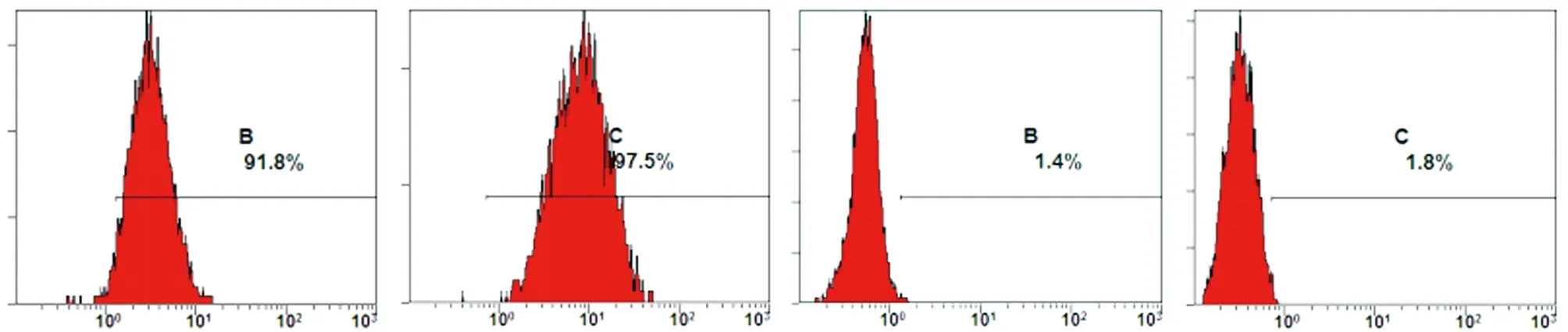
a CD29 b CD105 c CD34 d CD45
图5 流式细胞仪检测第3代ADSCs免疫表型
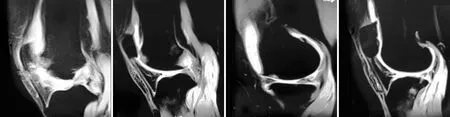
a 治疗前 b 治疗后1个月 c 治疗后2个月 d 治疗后3个月
图6 MRI扫描观察软骨厚度及信号(T2)改变
3 讨 论
研究表明个体因素以及关节活动是引起骨关节炎的主要因素。其可导致关节面软骨细胞、细胞外基质以及软骨下骨的降解与失平衡。目前临床上,针对骨关节炎现有的治疗方法包括非药物治疗、药物治疗及手术治疗。其中轻中度、年轻患者,主要给予理疗、口服非甾体类消炎止痛药等治疗,只能达到短暂的缓解疼痛的目的,无法延缓病情的进展乃至“根治”,且此类药物的不良反应屡见报道。最近再生医学的发展为治疗OA带来一线希望。
1994年Brittberg等[6]研究表明,使用自体软骨细胞移植技术治疗23例膝关节软骨缺损患者。术后随访16~66个月(平均39个月),所有患者的临床症状包括关节疼痛、肿胀、骨擦音均得到改善,并且组织学研究表明生成的是透明软骨组织。研究表明ADSCs具有多能性能,具有成脂肪、成骨以及成软骨的能力。2012年有学者研究表明关节腔注射骨髓间充质干细胞能够使OA动物模型得关节软骨再生[7]。2012年有研究表明骨髓间充质干细胞(bone marrow stem cells,BMSCs)能延迟羊骨关节炎进展以及改善关节软骨组织[8]。以上研究表明关节内微环境能够促使BMSCs向软骨方向分化,延迟关节退化。但是BMSCs取材不方便,以及鉴于目前体外培养的伦理学要求,我们选用取材方便,且具有多能性的ADSCs作为种子细胞来研究它对OA的治疗作用。我们在软骨缺损动物实验中已经发现自体脂肪间充质干细胞可以生成透明软骨组织。脂肪间充质干细胞源于自体脂肪组织,相较于骨髓间充质干细胞,其具有无免疫排斥性、创伤小、取材便利并可反复取材、来源广泛等特点,且其同样具有多向诱导分化潜能,成脂肪细胞、成骨细胞、成软骨细胞等[9-11]。另外PRP来源于自体,具有多种生长因子,不存在免疫排斥反应,取材方便、制作简单。为了模拟体内环境,我们旨在使用人自体脂肪干细胞ADSCs提供种子细胞,利用PRP中多种生长因子和关节腔内微环境促进人自体脂肪干细胞生长分化成软骨细胞进而生成透明软骨组织,联合治疗骨关节炎,改善患者生活质量,期待能有部分逆转退化速度的作用。
本研究结果证眀患者无不良反应,通过患者疼痛VAS评分以及关节活动评分可知,2个月以及3个月后相较于治疗前,两个评分结果都有所改善,说明人自体腹部ADSCs复合玻璃酸钠、PRP注射治疗膝关节骨关节炎有明显的改善症状作用。当然远期效果需要更多样本、更长时间的随访。本研究还采用核磁共振来检测软骨面厚度。治疗后2个月及3个月相较于治疗前关节软骨厚度均有所改善,而T2测量值于治疗后3个月较治疗前明显减少。说明该方法对膝关节骨关节炎软骨退变具有一定治疗效果。故此推断本实验疗效原理:治疗前期玻璃酸钠润滑应用关节面,然后脂肪干细胞贴附关节面,在PRP营养和微环境共同作用诱导分化为软骨细胞,后软骨细胞增生、传代,从而达到关节软骨治疗与修复的可能。
综上所述,人自体ADSCs复合玻璃酸钠和富血小板血浆注射治疗膝关节骨关节炎能有效改善关节活动度,减轻疼痛,提高患者生活质量,延缓关节退化。但其远期效果及具体机制需要更深入一步的组织学研究。
致谢:感谢西安市中心医院烧伤整形科陶谏主任医师、田智泉硕士、张明涛硕士的技术指导。
[1]钱春美,沈艳婷,袁秀荣,等.骨关节炎研究进展[J].吉林中医药,2016,36(5):538-540.
[2]张柏青,张仲文,叶启彬.基质诱导自体软骨细胞移植与软骨缺损的修复[J].中国矫形外科杂志,2008,16(23):1796-1798.
[3]美丽,刘少英,刘福艳,等.脂肪组织来源干细胞治疗骨关节炎研究进展[J].国际骨科学杂志,2016,37(2):102-105.
[4]Fischbach C,Seufert JH,Hacker M,et al.Three-dimensional in vitro model of adipogenesis:comparison of culture conditions.[J].Tissue Engineering,2004,10(1-2):215-229.
[5]Fischbach C,Spruss TB,Neubauer M,et al.Generation of mature fat pads in vitro and in vivo utilizing 3-D long-term culture of 3 T3~L1preadipocytes[J].Experimental Cell Research,2004,300(1):54-64.
[6]Brittberg M,Lindahl A,Nilsson A,et al.Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation[J].N Engl J Med,1994,331(14):889-895.
[7]Mitsuhiko Sato,Kenzo Uchida,Hideaki Nakajima,et al.Direct transplantation of mesenchymal stem cells into the knee joints of Hartley strain guinea pigs with spontaneous osteoarthritis.[J].Arthritis Research & Therapy,2012,14(1):R31[8]Al Faqeh H,Bin Nor Hamdan BM,Chen HC.The potential of intra-articular injection of chondrogenic-induced bone marrow stem cells to retard the progression of osteoarthritis in a sheep model[J].Experimental Gerontology,2012,47(6):458-464.
[9]Huang JI,Zuk PA,Jones NF,et al.Chondrogenic potential of multipotential cells from human adipose tissue.[J].Plastic & Reconstructive Surgery,2004,113(2):585-594.
[10]Cowan CM,Shi YY,Aalami OO,et al.Adipose-derived adult stromal cells heal critical-size mouse calvarial defects[J].Nature Biotechnology,2004,22(5):560-567.
[11]Zuk P A,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Molecular Biology of the Cell,2003,13(12):4279-4295.
Clinical Study of Autologous Adipose Derived Mesenchymal Stem Cells in the Treatment of Osteoarthritis
Han jian1,2,Yin Zhenhua2,Li Fuhang2,et al
(1.Department of Orthopedics,the Second Clinical Medical College of Lanzhou University,Lanzhou 730030,China;2.The Orthopedics of The First People’s Hospital of Xianyang City,Xianyang 712000,China)
Objective To discusses the safety and effectiveness of the treatment injection for knee osteoarthritis by using a utologous ADSCS composite sodium hyaluronate,platelet rich plasma (PRP).Methods Take the abdominal adipose tissue,get hADSCs separation,plenty of ADSCS obtained with in vitro culture,and by flow cytometry instrument to detect the surface markers and analysis into cartilage cells differentiation ability.30 patients with mild-to-moderate of knee joint osteoarthritis were selected from the orthopedic outpatient service center in the first people’s hospital of Xianyang city.ADSCs composite sodium hyaluronate,platelet rich plasma were injected into patient’s articular cavity.The indicators such as patients with adverse reactions,knee activity score,pain visual analogue scale (VAS) score as well as the surface of knee join under MRI were evaluated before and after the intervention.Results Abdominal adipose tissue separated hADSCs were positive expression of CD105 and CD29,CD45,CD34 negative expression,in vitro with good osteogenesis,into fat,cartilage capacity;There was no adverse reaction in the patients who suffered clinical intervention.And patient’s knee pain relief,activity range was improved compared with before treatment.MRI imaging showed that the patchy shadow in the area of the joint surface and low signal area were significantly reduced.There was no obvious joint effusion,and the thickness of articular surface was increased.Conclusion The articular cavity injection therapy with ADSCs compound sodium hyaluronate,platelet rich plasma (PRP) for patients who suffered with osteoarthritis can effectively improved the knee joint motion,to reduce pain and improve the quality of life.The thickness of the joint surface was increased and the joint degeneration was delayed by MRI imaging.
adipose derived stem cells;chondrocytes;osteoarthritis
闫斌(1978- ),男,主治医师,新疆医科大学第二附属医院外二科,830063。
1008-5572(2017)03-0235-05
咸阳市2014年科学技术研究计划项目(2014K04-13);*本文通讯作者:汪玉良
R684.3
A
2016-12-15
韩健,殷振华,李富航,等.人自体脂肪间充质干细胞治疗骨关节炎的临床研究[J].实用骨科杂志,2017,23(3):235-239.

