eNOS、CAV1、PI3K/Akt信号通路在同型半胱氨酸促进大鼠血管平滑肌细胞迁移、增殖中的作用研究
纪 昕,王 鑫,岳晓乐,赵丹丹,郭玉楷,李永军
·论著·
eNOS、CAV1、PI3K/Akt信号通路在同型半胱氨酸促进大鼠血管平滑肌细胞迁移、增殖中的作用研究
纪 昕,王 鑫,岳晓乐,赵丹丹,郭玉楷,李永军*
目的 探讨内皮型一氧化氮合酶(eNOS)、小凹蛋白-1(CAV1)、磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路在同型半胱氨酸(Hcy)促进大鼠血管平滑肌细胞(VSMCs)迁移、增殖中的作用。方法 2016年1—6月采用组织贴块法分离SDF级SD大鼠胸主动脉中膜并传代培养VSMCs,取4~7代细胞用于实验。细胞分为4组,分别为空白对照组、100 μmol/L Hcy组、200 μmol/L Hcy组、500 μmol/L Hcy组,使用相应浓度Hcy(0、100、200、500 μmol/L)进行干预培养,采用Transwell法检测VSMCs迁移能力、MTT法检测VSMCs增殖情况〔以光密度(OD)值表示〕,硝酸还原酶法测定VSMCs 释放NO情况,Western blotting检测VSMCs eNOS、CAV1、PI3K、p-Akt蛋白表达情况。结果 VSMCs穿膜细胞数与Hcy浓度呈正相关(r=0.582,P=0.020)。OD值与Hcy浓度呈正相关(r=0.620,P=0.015)。100、200、500 μmol/L Hcy组释放NO低于空白对照组(P<0.05)。NO(r=-0.479,P=0.028),eNOS蛋白表达水平(r=-0.544,P=0.033)与Hcy浓度呈负相关。NO与eNOS蛋白表达水平呈正相关(r=0.721,P=0.009)。100、200、500 μmol/L Hcy组VSMCs CAV1、PI3K、p-Akt蛋白表达水平均高于空白对照组(P<0.05)。CAV1蛋白表达水平(r=0.505,P=0.042),PI3K蛋白表达水平(r=0.428,P=0.030)、p-Akt蛋白表达水平(r=0.389,P=0.047)与Hcy浓度均呈正相关。结论 Hcy可能通过促进CAV1蛋白表达,抑制eNOS活性和NO释放,活化PI3K/Akt信号通路,从而诱导VSMCs的迁移和增殖,导致动脉粥样硬化。
半胱氨酸;肌细胞,平滑肌;一氧化氮合酶;小凹蛋白;磷脂酰肌醇3-激酶
纪昕,王鑫,岳晓乐,等.eNOS、CAV1、PI3K/Akt信号通路在同型半胱氨酸促进大鼠血管平滑肌细胞迁移、增殖中的作用研究[J].中国全科医学,2017,20(12):1469-1473.[www.chinagp.net]
JI X,WANG X,YUE X L,et al.Effects of eNOS,CAV1 and PI3K/Akt signaling pathway in homocystein promoting rat vascular smooth muscle cell migration and proliferation[J].Chinese General Practice,2017,20(12):1469-1473.
高同型半胱氨酸(Hcy)是动脉粥样硬化(AS)的独立危险因素,在心血管疾病中发挥重要作用[1]。AS的发生、发展与血管内皮细胞损伤和血管平滑肌细胞(VSMCs)的迁移、增殖密切相关。已有研究表明,Hcy可诱导VSMCs的迁移、增殖[2-4],但其具体机制目前尚不清楚,有研究认为可能与其对内皮型一氧化氮合酶(eNOS)活性和一氧化氮(NO)释放的影响有关[5-6]。小凹蛋白-1(CAV1)是平滑肌细胞膜小凹的主要结构蛋白,其可与eNOS结合形成复合物,进而调控细胞跨膜信号转导[7-8],是eNOS的负性调节因子。因此推测Hcy可能通过诱导CAV1的表达,抑制eNOS和NO作用,从而促进AS的发生发展。本研究通过加入Hcy培养VSMCs,以探讨eNOS、CAV1和磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路在Hcy促进大鼠VSMCs迁移、增殖中的作用,以期为AS的治疗研究提供依据。
1 材料与方法
1.1 实验动物及试剂 2016年1—6月选取SPF级SD大鼠6只,8周龄,体质量200~250 g,雄性,由河北医科大学实验动物中心提供,动物健康状况良好,饲养于河北医科大学实验动物中心SPF级实验室,饲养温度25 ℃,相对湿度70%,昼夜照明12 h/12 h。Hcy、四唑盐(MTT)、二甲基亚砜(DMSO)、抗PI3K抗体购自美国Sigma公司,抗eNOS单克隆抗体、抗CAV1多克隆抗体购自美国Introgen Therapeutics公司,抗p-Akt抗体购自美国Bioworld公司,Western blotting试剂盒购自南京碧波生物科技有限公司,一氧化氮(NO)测试盒(硝酸还原酶法)购自南京建成生物工程研究所,DMEM培养液、0.25%胰蛋白酶、胎牛血清(FBS)购自美国GIBCO公司。
1.2 SD大鼠VSMCs分离、培养 采用随机抽样法将SD大鼠分为3批,每批2只,每批饲养1周后处死,所有实验重复3次。每批实验采用颈椎脱臼法处死2只SD大鼠,打开胸腔找出胸主动脉;分离血管周围结缔组织,纵向剪开血管,刮除内膜,取出中膜;将中膜加入含20% FBS的DMEM培养液,并剪成1 mm×1 mm×1 mm的组织块,37 ℃ 5% CO2培养箱培养,24 h后更换新鲜培养液,此后每3 d换液,直至细胞融合度为80%~90%时进行传代。每隔3~4 d 传代1次。取4~7代细胞,加入0.25%胰蛋白酶消化后,用含10% FBS的DMEM培养液制成细胞悬液并计数,按6×103个细胞/孔接种于96孔培养板,待细胞贴壁后,无血清培养液培养24 h使细胞同步化[9]。将同步化后的细胞平均分为3份,分别进行1.3、1.4、1.5的实验。
1.3 Transwell法检测VSMCs迁移能力 取其中1份同步化后的细胞中加入1.8 mmol/L羟基脲作用12 h抑制细胞增殖后加入0.25%胰蛋白酶消化。将消化后的细胞平均分为4份,分别用含不同浓度Hcy(浓度分别为0、100、200、500 μmol/L)的DMEM培养液制成细胞悬液(无FBS),分别为空白对照组、100 μmol/L Hcy组、200 μmol/L Hcy组、500 μmol/L Hcy组,调整细胞浓度为3×104个细胞/ml。在Transwell小室(0.8 μm)上室加入200 μl细胞悬液,下室加入含10% FBS的DMEM培养液500 μl,培养48 h。结束后取出上室,用棉签轻轻擦上室内侧壁,磷酸盐缓冲液(PBS)冲洗,多聚甲醛固定,苏木素、伊红染色,PBS冲洗后,显微镜下每组随机取5个视野计数穿膜细胞数。
1.4 MTT法检测VSMCs增殖 另取1份同步化后的细胞分别加入不同浓度的Hcy(浓度分别为0、100、200、500 μmol/L),分别为空白对照组、100 μmol/L Hcy组、200 μmol/L Hcy组、500 μmol/L Hcy组,4组细胞每组均分为3份,均在37 ℃ 5% CO2培养箱培养,每组3份细胞分别培养12 h、24 h和48 h,后分别加入MTT液20 μl,继续培养4 h。弃去培养液,加入DMSO 150 μl,振荡10 min,用酶标仪检测各孔490 nm处光密度(OD)值。细胞加入MTT培养检测后不复用。
1.5 NO的检测 取最后一份同步化后的细胞分别加入相应浓度的Hcy(浓度分别为0、100、200、500 μmol/L),分别为空白对照组、100 μmol/L Hcy组、200 μmol/L Hcy组、500 μmol/L Hcy组,37 ℃ 5% CO2培养箱培养,培养48 h。150×g离心5 min后,吸取细胞培养上清液,按照NO测试盒(硝酸还原酶法)说明书测定NO浓度。
1.6 Western blotting检测 1.5中细胞离心后,弃去培养液,PBS洗涤,根据Western blotting试剂盒的说明书进行eNOS、CAV1、PI3K、p-Akt蛋白的测定,蛋白条带采用Image Lab软件自动分析。

2 结果
2.1 Hcy对VSMCs迁移的影响 12 h、24 h、48 h时各组VSMCs穿膜细胞数比较,差异有统计学意义(F值分别为3.097、4.152、5.590,P<0.05)。12 h、24 h、48 h时Hcy干预的各组 VSMCs穿膜细胞数多于空白对照组,差异有统计学意义(P<0.05,见表1)。VSMCs穿膜细胞数与Hcy浓度呈正相关(r=0.582,P=0.020)。

表1 各组VSMCs穿膜细胞数比较(n=15)
注:Hcy=同型半胱氨酸;与空白对照组比较,aP<0.05
2.2 Hcy对VSMCs增殖的影响 12 h时,4组OD值比较,差异无统计学意义(F=1.265,P=0.295)。24 h时,4组OD值比较,差异有统计学意义(F=4.239,P=0.022);Hcy干预的各组OD值均高于空白对照组,差异有统计学意义(P<0.05);500 μmol/L Hcy组OD值高于100 μmol/L Hcy组、200 μmol/L Hcy组,差异有统计学意义(P<0.05)。48 h时,4组OD值比较,差异有统计学意义(F=4.237,P=0.009);Hcy干预的各组OD值高于空白对照组,差异有统计学意义(P<0.05,见表2)。OD值与Hcy浓度呈正相关(r=0.620,P=0.015)。
2.3 VSMCs释放NO情况和VSMCs eNOS蛋白表达水平 各组VSMCs释放NO比较,差异有统计学意义(F=4.348,P<0.05)。Hcy干预的各组VSMCs释放NO低于空白对照组,差异有统计学意义(P<0.05,见表3)。NO与Hcy浓度呈负相关(r=-0.479,P=0.028)。各组eNOS蛋白表达水平比较,差异有统计学意义(F=3.204,P<0.05)。Hcy干预的各组eNOS蛋白表达水平低于空白对照组,差异有统计学意义(P<0.05,见表4、图1)。eNOS蛋白表达水平与Hcy浓度呈负相关(r=-0.544,P=0.033)。NO与eNOS蛋白表达水平呈正相关(r=0.721,P=0.009)。
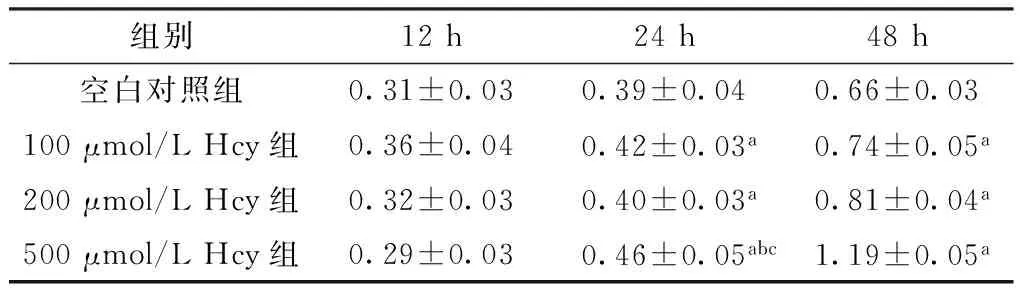
表2 各组VSMCs增殖情况(OD值,n=15)
注:VSMCs=血管平滑肌细胞;与空白对照组比较,aP<0.05;与100 μmol/L Hcy组比较,bP<0.05;与200 μmol/L Hcy组比较,cP<0.05

表3 各组VSMCs释放NO情况(n=15,μmol/L)
注:NO=一氧化氮;与空白对照组比较,aP<0.05
表4 各组VSMCs eNOS、CAV1、PI3K、p-Akt蛋白表达水平(n=15)
Table 4 Protein eNOS,CAV1,PI3K and p-Akt expression of different groups

组别eNOSCAV1PI3Kp-Akt空白对照组0.63±0.280.11±0.090.08±0.100.05±0.06100μmol/LHcy组0.49±0.24a0.16±0.10a0.12±0.08a0.14±0.07a200μmol/LHcy组0.32±0.21ab0.30±0.17ab0.15±0.09a0.27±0.15ab500μmol/LHcy组0.24±0.18ab0.38±0.16abc0.20±0.13ab0.31±0.11ab
注:eNOS=内皮型一氧化氮合酶,CAV1=小凹蛋白-1,PI3K=磷脂酰肌醇3-激酶,p-Akt=磷脂酰肌酶-蛋白激酶;与空白对照组比较,aP<0.05;与100 μmol/L Hcy组比较,bP<0.05;与200 μmol/L Hcy组比较,cP<0.05
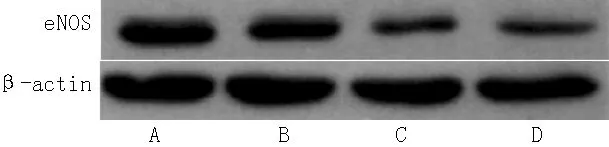
注:eNOS=内皮型一氧化氮合酶,Hcy=同型半胱氨酸;A为空白对照组,B为100 μmol/L Hcy组,C为200 μmol/L Hcy组,D为500 μmol/L Hcy组
图1 各组VSMCs eNOS蛋白表达
Figure 1 eNOS expression in VSMCs cultured in different groups
2.4 VSMCs CAV1蛋白表达水平 各组VSMCs CAV1蛋白表达水平比较,差异有统计学意义(F=3.233,P<0.05)。Hcy干预的各组VSMCs CAV1蛋白表达水平均高于空白对照组,差异有统计学意义(P<0.05,见表4、图2)。CAV1蛋白表达水平与Hcy浓度呈正相关(r=0.505,P=0.042)。
2.5 VSMCs PI3K、p-Akt蛋白表达 各组VSMCs PI3K、p-Akt蛋白表达水平比较,差异有统计学意义(F值分别为2.878、3.799,P<0.05)。Hcy干预的各组VSMCs PI3K、p-Akt蛋白表达水平均较空白对照组高,差异有统计学意义(P<0.05,见表4、图3)。PI3K(r=0.428,P=0.030)、p-Akt(r=0.389,P=0.047)蛋白表达与Hcy浓度均呈正相关。
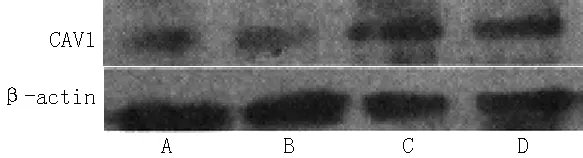
注:CAV1=小凹蛋白-1;A为空白对照组,B为100 μmol/L Hcy组,C为200 μmol/L Hcy组,D为500 μmol/L Hcy组
图2 各组VSMCs CAV1蛋白表达
Figure 2 CAV1 expression in VSMCs cultured in different groups
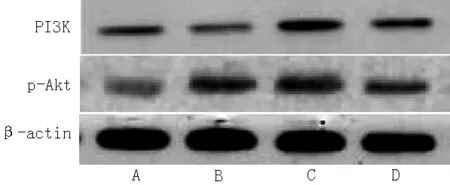
注:PI3K=磷脂酰肌醇3-激酶,p-Akt=磷脂酰肌酶-蛋白激酶;A为空白对照组,B为100 μmol/L Hcy组,C为200 μmol/L Hcy组,D为500 μmol/L Hcy组
图3 各组VSMCs PI3K、p-Akt信号通路蛋白表达
Figure 3 PI3K expression in VSMCs cultured in different groups
3 讨论
VSMCs位于动脉血管中层,主要发挥收缩血管的作用,Hcy作为心血管疾病的独立危险因素,可通过损伤血管内皮细胞、促进黏附分子和趋化因子等炎性因子的合成分泌,进而促进VSMCs向内膜下迁移和增殖[10]。同时,VSMCs通过吞噬氧化低密度脂蛋白,成为肌源性泡沫细胞,进一步分泌大量的炎性因子,导致细胞外基质降解,最终导致动脉粥样斑块的形成和破裂。已有研究认为,Hcy对eNOS活性和NO释放的抑制作用可能是其促进VSMCs迁移、增殖的原因之一[5-6]。CAV1作为eNOS的负性调节因子,是细胞质膜上小凹结构的重要结构蛋白和功能蛋白,其可与多种细胞蛋白分子结合,启动下游信号,是调节细胞信号的关键步骤,在VSMCs的迁移、增殖过程中具有重要作用[11]。而PI3K/Akt是参与AS发生发展的重要信号通路,参与了平滑肌细胞的增殖、分化、凋亡过程[12-13]。因此,本研究通过在体外培养大鼠的VSMCs,以探讨Hcy诱导VSMCs迁移、增殖的作用机制,以及eNOS、CAV1和PI3K/Akt信号通路在其中的作用。
本研究结果显示,Hcy干预的各组VSMCs穿膜细胞数、OD值均高于空白对照组,从而再次证实了Hcy对VSMCs迁移和增殖的促进作用。同时,研究结果显示VSMCs穿膜细胞数、OD值与Hcy浓度呈正相关,这提示Hcy对VSMCs迁移和增殖的促进作用具有剂量依赖性。
近年来有研究发现,Hcy可增强CAV1蛋白表达,CAV1可能通过其骨架结构中的相关氨基酸残基,以蛋白-蛋白相结合的形式结合酪氨酸磷酸化形式的eNOS,形成复合物,进而抑制eNOS活性[14]。本研究结果提示,Hcy干预的各组VSMCs CAV1蛋白表达水平均较空白对照组升高,而eNOS蛋白表达水平下降。并且随Hcy浓度上升,CAV1蛋白表达水平升高,eNOS蛋白表达水平降低。eNOS为促进NO合成释放的关键酶,本研究结果显示,随着eNOS蛋白表达水平降低,NO亦出现下降,结合Hcy呈剂量依赖性促进VSMCs增殖、迁移的研究结果提示,在VSMCs中,Hcy可通过诱导CAV1蛋白表达,降低eNOS活性,抑制NO生成,从而促进细胞增殖、迁移。
PI3K可被多种细胞外信号分子激活,继而使其下游靶分子Akt磷酸化形成p-Akt,p-Akt可调控抗凋亡蛋白基因的表达或通过信号偶联促进细胞增殖,抑制细胞凋亡,是AS发生发展的重要生物学途径[12-13]。前期研究发现,Hcy可通过增强PI3K/Akt信号通路关键蛋白和分子的表达,从而诱导人主动脉平滑肌细胞迁移、增生[15]。CARREIRA等[16]发现高浓度外源性NO可抑制细胞增殖,而TORROGLOSA等[17]研究显示NO此种抑制细胞增殖的作用是通过激活PI3K/Akt信号通路实现的。而国内刘淼青等[18]的研究表明,NO可通过抑制PI3K/Akt信号通路,发挥抑制肠神经干细胞增殖的作用。在本研究中,NO与Hcy浓度呈负相关,PI3K、p-Akt蛋白表达与Hcy浓度呈正相关,这提示NO减少导致了PI3K/Akt信号通路的活化。考虑可能为NO对PI3K/Akt信号通路的抑制作用减弱,导致其抗平滑肌增殖的能力减弱,从而促进了Hcy对VSMCs增殖、迁移的诱导作用。
综上所述,Hcy参与AS的机制,可能与Hcy诱导VSMCs内CAV1蛋白高表达、降低eNOS活性、抑制NO释放并活化PI3K/Akt信号通路,从而促进VSMCs迁移、增殖相关。由于目前关于CAV1在Hcy参与AS形成和发展中的作用研究仍然较少,本研究在此方面进行了相关探究,为日后的研究提供了一定的研究依据和基础。但是,本研究仅取用大鼠主动脉的VSMCs,对于不同种属和部位,Hcy对VSMCs的具体作用情况是否相同,目前仍未可知;其次,本研究在Hcy干预下采用直接检测相关生物标志物的方法进行研究,并未采用更多的阻断、增强表达等途径进一步验证和对比。以上的不足之处仍需通过更多、更深入的实验进一步探讨。
作者贡献:纪昕负责课题构思、实验设计、论文撰写;王鑫负责研究的设计与实施、结果分析;岳晓乐、赵丹丹、郭玉楷进行实验实施、评估统计、资料收集;李永军负责指导课题设计、组织课题实施、论文修订审校、整体质量控制和监督管理。
本文无利益冲突。
[1]鄢高亮,王栋,乔勇,等.高同型半胱氨酸水平对冠心病严重程度及支架置入治疗预后的影响[J].中华心血管病杂志,2015,43(11):943-947. YAN G L,WANG D,QIAO Y,et al.Relationship between hyperhomocysteine and long-term outcome of coronary artery disease patients after drug-eluting stent implantation [J].Chin J Cardiol,2015,43(11):943-947.
[2]鲍晓梅,郑宏超.同型半胱氨酸对大鼠血管平滑肌细胞增殖、迁移能力的影响及其可能机制[J].山东医药,2015,55(44):25-27. BAO X M,ZHENG H C.Influences and possible mechanisms of homocysteine induced rat vascular smooth muscle cells proliferation and migration [J].Shandong Medical Journal,2015,55(44):25-27.
[3]MENG L,LIU L,ZHOU C,et al.Polyphenols and polypeptides in Chinese rice wine inhibit homocysteine-induced proliferation and migration of vascular smooth muscle cells [J].J Cardiovasc Pharmacol,2016,67(6):482-490.
[4]刘龙斌,孟立平,季政,等.黄酒多酚对同型半胱氨酸诱导的血管平滑肌细胞增殖和迁移的影响及其机制研究[J].中国全科医学,2016,19(14):1676-1683. LIU L B,MENG L P,JI Z,et al.Influence of yellow wine polyphenol compounds on homocysteine induced VSMCs proliferation and migration and its mechanism [J].Chinese General Practice,2016,19(14):1676-1683.
[5]LAN T H,XU Z W,WANG Z,et al.Ginsenoside Rb1 prevents homocysteine-induced endothelial dysfunction via PI3K/Akt activation and PKC inhibition [J].Biochem Pharmacol,2011,82(2):148-155.
[6]刘勇,郝宝顺,刘定辉,等.四逆汤对同型半胱氨酸损伤的EAhy926细胞caveolin-1和eNOS表达的影响[J].中国病理生理杂志,2013,29(9):1579-1584. LIU Y,HAO B S,LIU D H,et al.Effect of Sini decoction on expression of caveolin-1 and eNOS in EAhy926 cells injured by homocysteine [J].Chinese Journal of Pathophysiology,2013,29(9):1579-1584.
[7]HUTCHINSON T E,HU H,PATEL J M.Cell penetrating peptide-mediated caveolae-dependent activation of lung endothelial nitric oxide synthase [J].Protein Pept Lett,2016,23(2):169-175.
[8]SCHWENCKE C,BRAUN-DULLAEUS R C,WUNDERLICH C,et al.Caveolae and caveolin in transmembrane signaling:implications for human disease [J].Cardiovasc Res,2006,70(1):42-49.
[9]崔立文,徐金升,白亚玲,等.细胞外 pH 值及其波动对高磷诱导的大鼠血管平滑肌细胞凋亡的作用及机制研究[J].中国全科医学,2015,18(33):4090-4095. CUI L W,XU J S,BAI Y L,et al.Effects of extracellular pH and its fluctuation on high - phosphate - induced apoptosis of rat vascular smooth muscle cells and its mechanism [J].Chinese General Practice,2015,18(33): 4090-4095.
[10]ALEXANDER M R,OWENS G K.Epigenetic control of smooth muscle cell differentiation and phenotypic switching in vascular development and disease [J].Annu Rev Physiol,2012,74:13-40.
[11]毕国善,熊国祚.Caveolae/Caveolin-1在血管再狭窄中的作用[J].现代医药卫生,2012,28(4):562-564. BI G S,XIONG G Z.Roles of Caveolae/Caveolin-1 in vascular restenosis [J].Modern Medicine & Health,2012,28(4):562-564.
[12]LI H,PENG W,ZHUANG J,et al.Vaspin attenuates high glucose-induced vascular smooth muscle cellsproliferation and chemokinesis by inhibiting the MAPK,PI3K/Akt,and NF-κB signaling pathways [J].Atherosclerosis,2013,228(1):61-68.
[13]王振宝,吕品田,贾漪涛,等.磷脂酰肌醇-3-羟基激酶抑制剂LY294002对肝细胞生长因子促人结肠癌细胞SW620增殖和迁移行为的影响[J].中国全科医学,2011,14(36):4170-4172. WANG Z B,LYU P T,JIA Y T,et al.The Role of PI3K inhibitors(LY294002) in the proliferation,apoptosis and migration of SW620 activated by HGF[J].Chinese General Practice,2011,14(36):4170-4172.
[14]陈兆煜,袁乔,谈智.Caveolae-caveolin-1-PTRF/cavin-1系统与血管平滑肌细胞迁移:一种可能的机制[J].中国病理生理杂志,2013,29(5):957-960. CHEN Z Y,YUAN Q,TAN Z.Caveolae-caveolin-1-PTRF/cavin-1 system and VSMC migration: a possible mechanism [J].Chinese Journal of Pathophysiology,2013,29(5):957-960.
[15]纪昕,郭玉楷,岳晓乐,等.同型半胱氨酸通过PI3K/Akt信号通路诱导人主动脉平滑肌细胞增殖[J].中国卫生检验,2017,27(1):1-5. JI X,GUO Y K,YUE X L,et al.Homocysteine induces proliferation of human aortic smooth muscle cells via PI3K/Akt signaling pathway[J].Chinese Journal of Health Laboratory Technology,2017,27(1):1-5.
[16]CARREIRA B P,MORTE M I,INACIO A,et al.Nitric oxide stimulates the proliferation of neural stem cells bypassing the epidermal growth factor receptor [J].Stem Cells,2010,28(7):1219-1230.
[17]TORROGLOSA A,MURILLO-CARRETERO M,ROMERO-GRIMALDI C,et al.Nitric oxide decreases subventricular zone stem cell proliferation by inhibition of epidermal growth factor receptor and phosphoinositide-3-kinase/Akt pathway [J].Stem Cells,2007,25(1):88-97.
[18]刘淼青,胡书奇,王永飚,等.PI3K/AKT信号通路在一氧化氮对肠神经干细胞增殖分化中的作用[J].中华小儿外科杂志,2015,36(8):626-631. LIU M Q,HU S Q,WANG Y B,et al.Role of PI3K/AKT signaling pathway in nitric oxide on the proliferation and differentiation of enteric neural stem cells [J].Chinese Journal of Pediatric Surgery,2015,36(8):626-631.
(本文编辑:崔莎)
Effects of eNOS,CAV1 and PI3K/Akt Signaling Pathway in Homocystein Promoting Rat Vascular Smooth Muscle Cell Migration and Proliferation
JIXin,WANGXin,YUEXiao-le,ZHAODan-dan,GUOYu-kai,LIYong-jun*
ClinicalLaboratory,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
*Correspondingauthor:LIYong-jun,Chieflaboratorian,Mastersupervisor;E-mail:lyjj221@sina.com
Objective To explore the effects of endothelial nitric oxide synthase(eNOS),caveolae-1(CAV1) and phosphatidylinositol3-kinase /protein kinase B(PI3K/Akt) signaling pathway in homocystein(Hcy) promoting rat vascular smooth muscle cells(VSMCs) migration and proliferation.Methods Between January and June 2016 VSMCs were isolated from the thoracic aorta media of the SPF grade SD rats and subcultured by substrate-attached explant method,and by which 4-7 generations of VSMCs were obtained.Four groups were set and given 0(blank control group),100,200 and 500 μmol/L Hcy group,respectively to culture the VSMCs.Transwell assay was used to detect VSMCs migration,while the conditions of VSMCs proliferation were examined by MTT assay.Nitric oxide(NO) concentration in VSMCs culture supernatant fluid was examined by nitrate reductase test,and the expressions of eNOS,CAV1,PI3K and p-Akt in VSMCs were detected by Western blotting.Results The numbers of VSMCs permeating the septum were significantly positively correlated with Hcy concentrations(r=0.582,P=0.020).The MTT assay showed that positive correlations were found between OD values and Hcy concentrations(r=0.620,P=0.015).NO concentrations of 100,200 and 500 μmol/L Hcy groups were all lower than those of the blank control group(P<0.05).Hcy concentrations were negatively associated with NO concentrations(r=-0.479,P=0.028) as well as eNOS expressions(r=-0.544,P=0.033).NO concentrations were positively correlated with eNOS expressions(r=0.721,P=0.009).Expressions of CAV1,PI3K and p-Akt in VSMCs cultured in 100,200 as well as 500 μmol/L Hcy groups were all higher than those in the blank control group(P<0.05).Hcy concentrations showed positive correlation with CAV1 expressions(r=0.505,P=0.042),PI3K expressions(r=0.428,P=0.030),and p-Akt expressions(r=0.389,P=0.047).Conclusion Hcy may induce VSMCs migration and proliferation through promoting the CAV1 expression,inhibiting the activity of eNOS and release of NO,and activating the PI3K/Akt signaling pathway,thereby,the atherosclerosis is developed.
Cysteine;Myocytes,smooth muscle;Nitric oxide synthase;Caveolae;Phosphoinositide 3-kinase
国家高技术研究发展计划(863计划)2014AA022304子课题;河北省卫生厅医学科学研究课题计划(20130466)
R 341.7
A
10.3969/j.issn.1007-9572.2017.12.012
2016-10-25;
2017-02-10)
050000河北省石家庄市,河北医科大学第二医院检验科
*通信作者:李永军,主任检验师,硕士生导师;E-mail:lyjj221@sina.com

